修回日期: 2021-04-05
接受日期: 2021-05-11
在线出版日期: 2021-06-08
转录相关酸性卷曲蛋白3 (transforming acidic coiled coil protein 3, TACC3)是TACC家族的重要成员, 研究表明, TACC3基因在乳腺癌, 非小细胞肺癌, 胃癌中高表达, 并与预后较差有关. 但是其在肝癌中的表达情况及与患者预后的关系鲜见报道.
通过生物信息学手段探讨TACC3基因在肝癌中的表达及其与患者的预后关系.
分别检索BioGPS、Oncomine、癌症细胞系百科全书(cancer cell line encyclopedia, CCLE)数据库, 挖掘分析TACC3基因在正常人体组织、肝癌组织及肝癌细胞系中的表达情况, 应用 Kaplan-Meier Plotter、GEPIA等数据库分析TACC3基因对肝癌患者预后的影响.
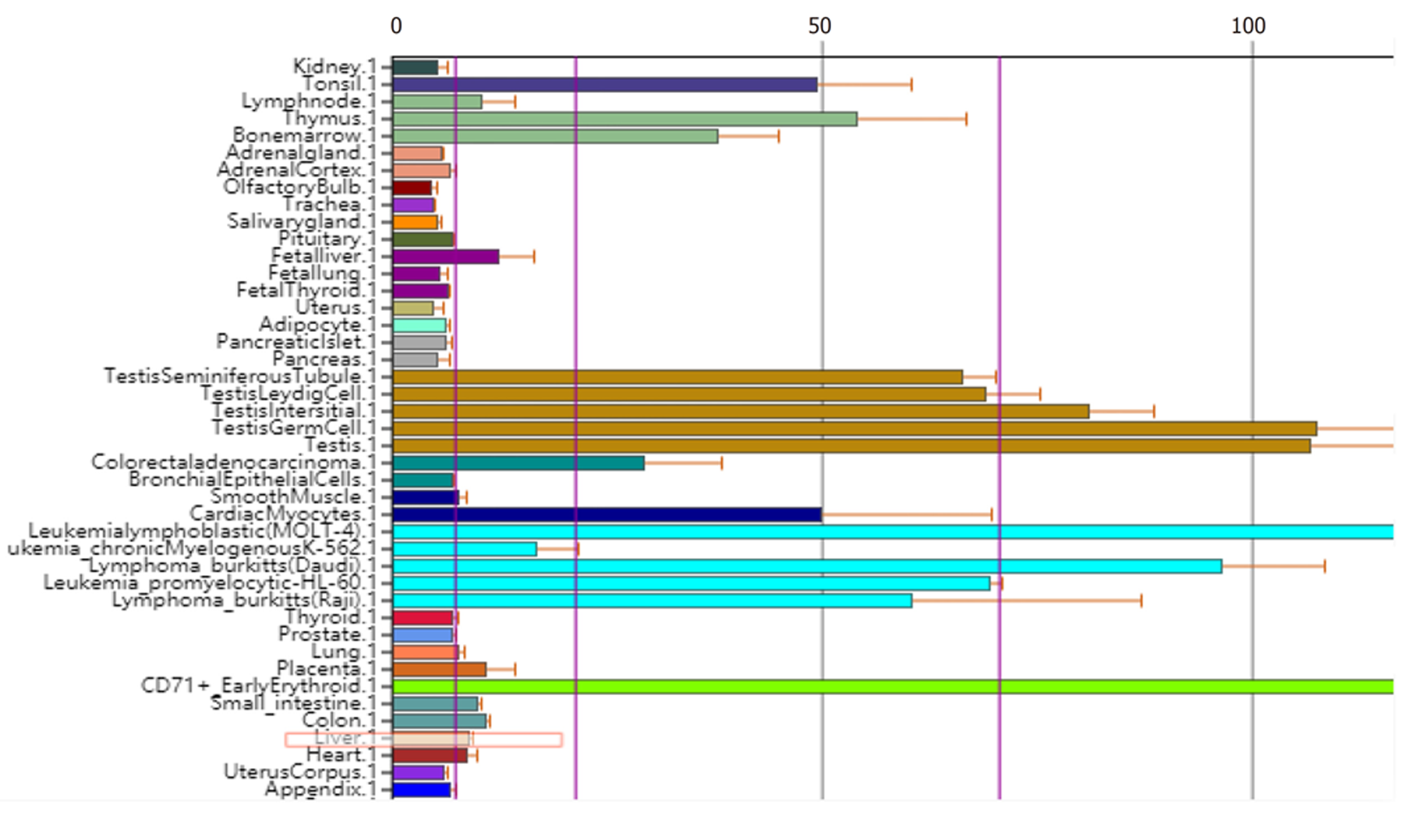
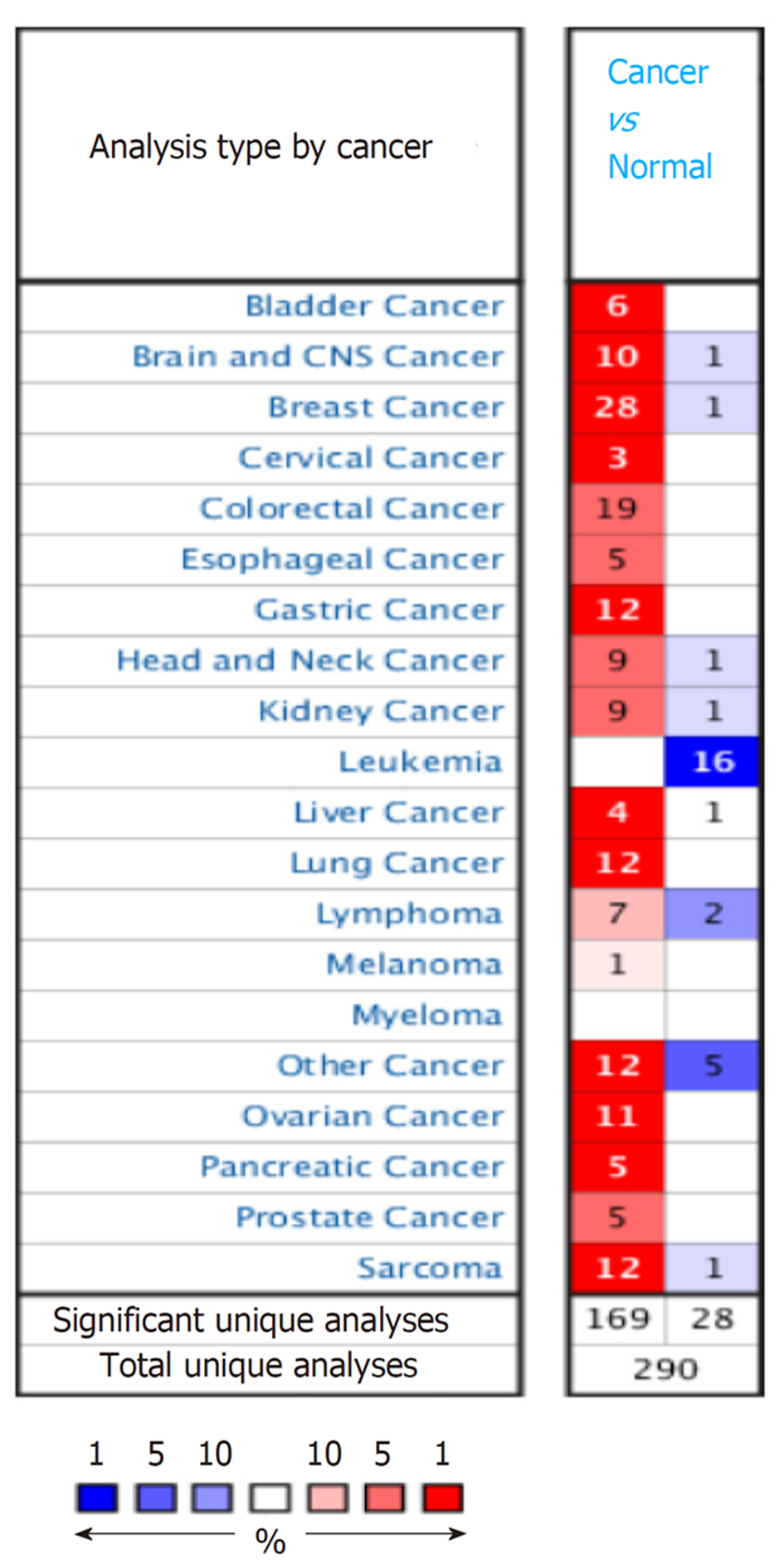
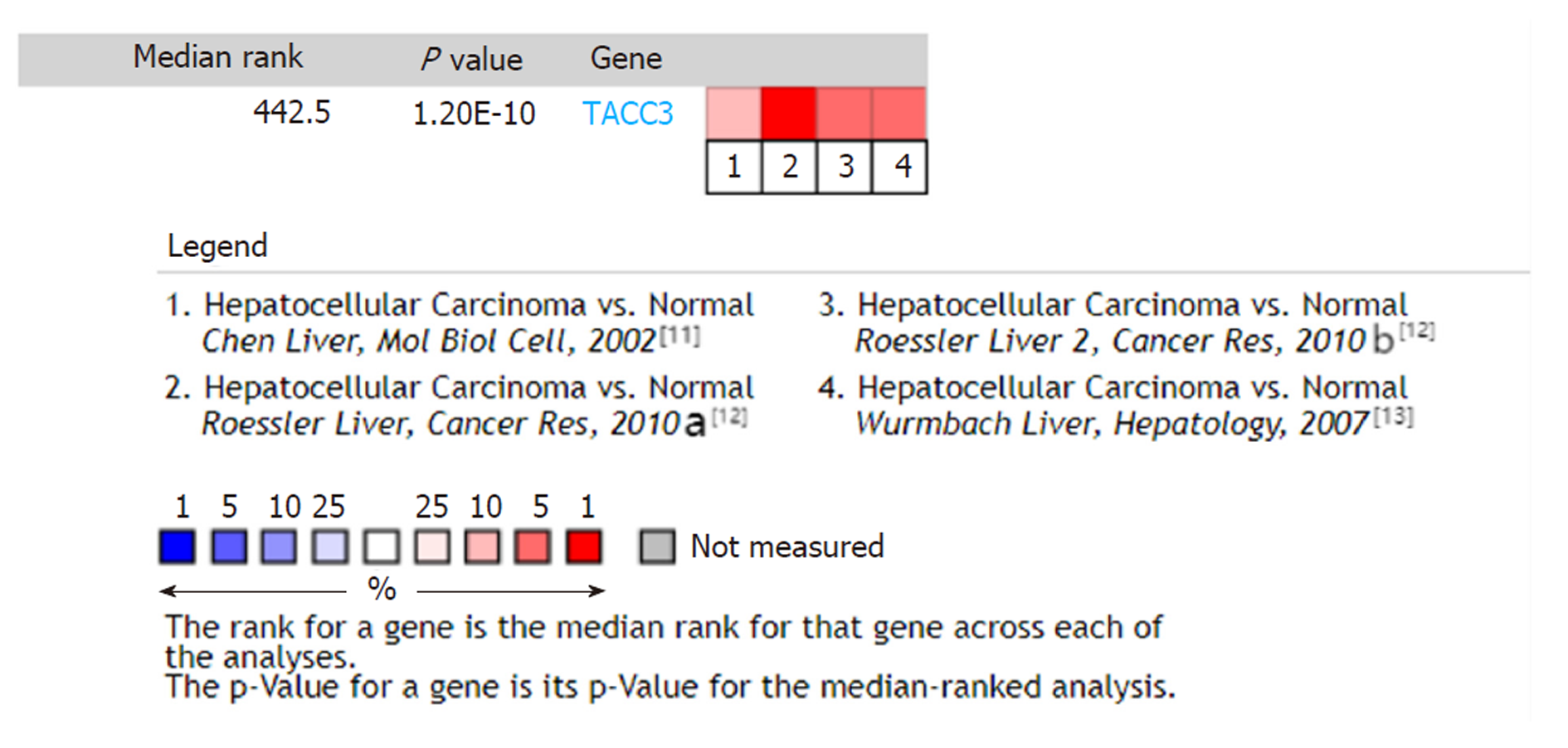
BioGPS数据库分析结果显示TACC3基因在人体各组织中均有表达, 肝脏组织中的表达值中位数略高于其他正常组织(8.95 vs 7.1). 从Oncomine数据库检索出TACC3基因相关研究290项, 显示肝癌组织中TACC3基因高表达4项, 低表达1项, Meta分析显示与正常肝组织相比TACC3基因在肝癌组织中呈高表达状态[中位秩(Median Rank) = 442.5, P<0.05]. CCLE数据库分析显示, 在肝癌细胞系中TACC3 mRNA高表达. Kaplan-Meier Plotter及GEPIA数据库生存分析结果显示, TACC3基因高表达组的肝癌患者总体生存时间(OS)和无进展生存时间(PFS)等生存预后指标均较低表达组差(P<0.05).
TACC3基因在肝癌组织中呈高表达, 且TACC3基因高表达与肝癌患者生存预后差有关.
核心提要: 转录相关酸性卷曲蛋白3 (transforming acidic coiled coil protein 3, TACC3)是TACC家族的重要成员, 本研究通过生物信息学手段证实TACC3基因在肝癌中呈高表达, 并且其高表达与肝癌患者生存预后差有关.
引文著录: 邢国强, 运涛, 赵国刚. TACC3基因在肝癌中的表达及其与患者的预后关系. 世界华人消化杂志 2021; 29(11): 577-584
Revised: April 5, 2021
Accepted: May 11, 2021
Published online: June 8, 2021
Transforming acidic coiled coil protein 3 (TACC3) is an important member of the TACC family. Studies have shown that TACC3 gene is highly expressed in breast cancer, non-small cell lung cancer, and gastric cancer, and is associated with poor prognosis. However, its expression in liver cancer and its relationship with prognosis are rarely reported.
To explore the clinical significance of TACC3 gene expression in liver cancer.
The expression of TACC3 gene in normal human tissues, liver cancer tissues, and liver cancer cell lines was mined by searching databases including BioGPS, Oncomine, and Cancer Cell Line Encyclopedia (CCLE), respectively. Kaplan-Meier plotter and GEPIA were used to analyze the effect of TACC3 gene expression on the prognosis of liver cancer patients.
BioGPS database analysis showed that TACC3 gene was expressed in all normal tissues and TACC3 gene expression in the liver was slightly higher than that in other normal tissues (median expression value, 8.95 vs 7.1). A total of 290 studies on TACC3 gene were retrieved from Oncomine database, showing four studies with high expression and one with low expression of TACC3 gene in liver cancer tissues. Meta-analysis showed that TACC3 gene was highly expressed in liver cancer tissues compared with normal liver tissues (Median rank = 442.5, P < 0.05). CCLE database analysis showed that TACC3 mRNA was highly expressed in liver cancer cell lines. The survival analysis results by Kaplan-Meier plotter based on the GEPIA database showed that the overall survival time (OS) and progression-free survival time (PFS) of liver cancer patients in the TACC3 high expression group were worse than those of the low expression group (P < 0.05).
TACC3 gene is highly expressed in liver cancer tissues. And the high expression of TACC3 gene is associated with poor survival prognosis in liver cancer patients.
- Citation: Xing GQ, Yun T, Zhao GG. Relationship of TACC3 gene expression with prognosis in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2021; 29(11): 577-584
- URL: https://www.wjgnet.com/1009-3079/full/v29/i11/577.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i11.577
在全球范围内, 肝癌是恶性肿瘤相关死亡的第四大常见原因, 在发病率方面排名第六位[1]. 我国癌症统计报告显示2015年我国居民癌症粗死亡率为169.41/10万, 标化死亡率为159.01/10万, 其中肝癌死亡率居于第2位(仅次于肺癌)[2]. 随着手术、化疗、靶向及免疫治疗方式的进步以及多学科综合治疗方案的普及, 肝癌患者生存期虽然有所延长, 但防控形势依旧严峻. 因此, 寻找新的肝癌标志物和潜在治疗靶点, 研究其在肝癌发病过程中的分子机制对于肝癌防控具有重要意义.
转录相关酸性卷曲蛋白3(transforming acidic coiled coil protein 3, TACC3)是TACC家族的重要成员, TACC3受到Aurora-A激酶的调节, 靶向中心体, 在有丝分裂期间对微管生长至关重要[3]. 有研究表明, TACC3基因在乳腺癌[4], 非小细胞肺癌[5], 胃癌[6]中高表达, 并与预后较差有关. 目前关于TACC3基因在肝癌中的表达情况及其与患者预后的关系鲜见报道. 本研究旨在通过生物信息学探讨TACC3基因在肝癌中的表达水平及其与患者预后的关系.
检索BioGPS[7]、Oncomine[8]、癌症细胞系百科全书(cancer cell line encyclopedia, CCLE)等数据库, 获取TACC3基因在肝癌中的表达数据. 应用Kaplan-Meier Plotter[9]、GEPIA[10]数据库分析TACC3基因对肝癌患者预后生存的影响.
1.2.1 利用BioGPS数据库分析:TACC3基因在人体正常组织中的表达情况, 在BioGPS数据库检索框中输入"TACC3"进行检索, 物种选择Human.
1.2.2 在Oncomine数据库主界面设定检索条件: (1)Cancer Type: Liver Cancer; (2)Gene: TACC3; (3)Data Type: mRNA;(4)Analysis Type: Cancer vs Normal analysis; (5)临界值限定: P<0.05, Fold Change = all, Gene Rank = all DNA type = mRNA.
1.2.3 在CCLE数据库检索框中输入"TACC3"进行检索: 对TACC3基因在各细胞系中的表达进行分析.
1.2.4 利用Kaplan-Meier Plotter(http://kmplot.com/analysis/)的肝癌数据集进行在线生存分析: 设定检索条件, (1)Cancer Type: Liver Cancer; (2)Gene: TACC3; (3)Survival: 总体生存时间(OS)/无复发生存时间(RFS)/无进展生存时间(PFS)/疾病特异性存活率(DSS).
1.2.5 利用GEPIA数据库的肝癌数据集进行在线生存分析: 设定检索条件, (1)Gene: TACC3; (2)Methods: OS/RFS; (3)Cancer name: LIHC.
统计学处理 采用t检验评估TACC3基因在不同组中的表达差异. 通过Kaplan-Meier方法绘制生存曲线, 采用对数秩检验(Log-rank test)分析. 在Oncomine数据库中对各项研究中肝脏正常组织及肝癌组织中TACC3表达差异进行统计对比并生成Meta分析结果. P<0.05为有显著差异.
通过BioGPS数据库在线分析表明TACC3基因在人体大部分正常组织中均存在表达, 而在肝脏组织中表达水平略高于平均值, 表达的中位值分别为8.95和7.1, 见图1.
Oncomine数据库中检索结果显示, TACC3基因在各肿瘤中表达的相关研究290项, 显示正常组织和肿瘤组织TACC3表达具有显著差异的研究197项, 其中高表达169项, 低表达28项. TACC3基因在乳腺癌、胃癌、肺癌等组织中呈现高表达. 肝癌相关研究5项, 其中4项为高表达, 1项为低表达(为肝硬化病变研究), 见图2. 剔除1项肝硬化病变的研究, 对符合条件的4项肝癌研究[11-13]中760个样本进行Meta分析, 结果显示TACC3基因在肝癌组织中呈现高表达状态[中位秩(Median Rank) = 442.5, P<0.05], 见图3.
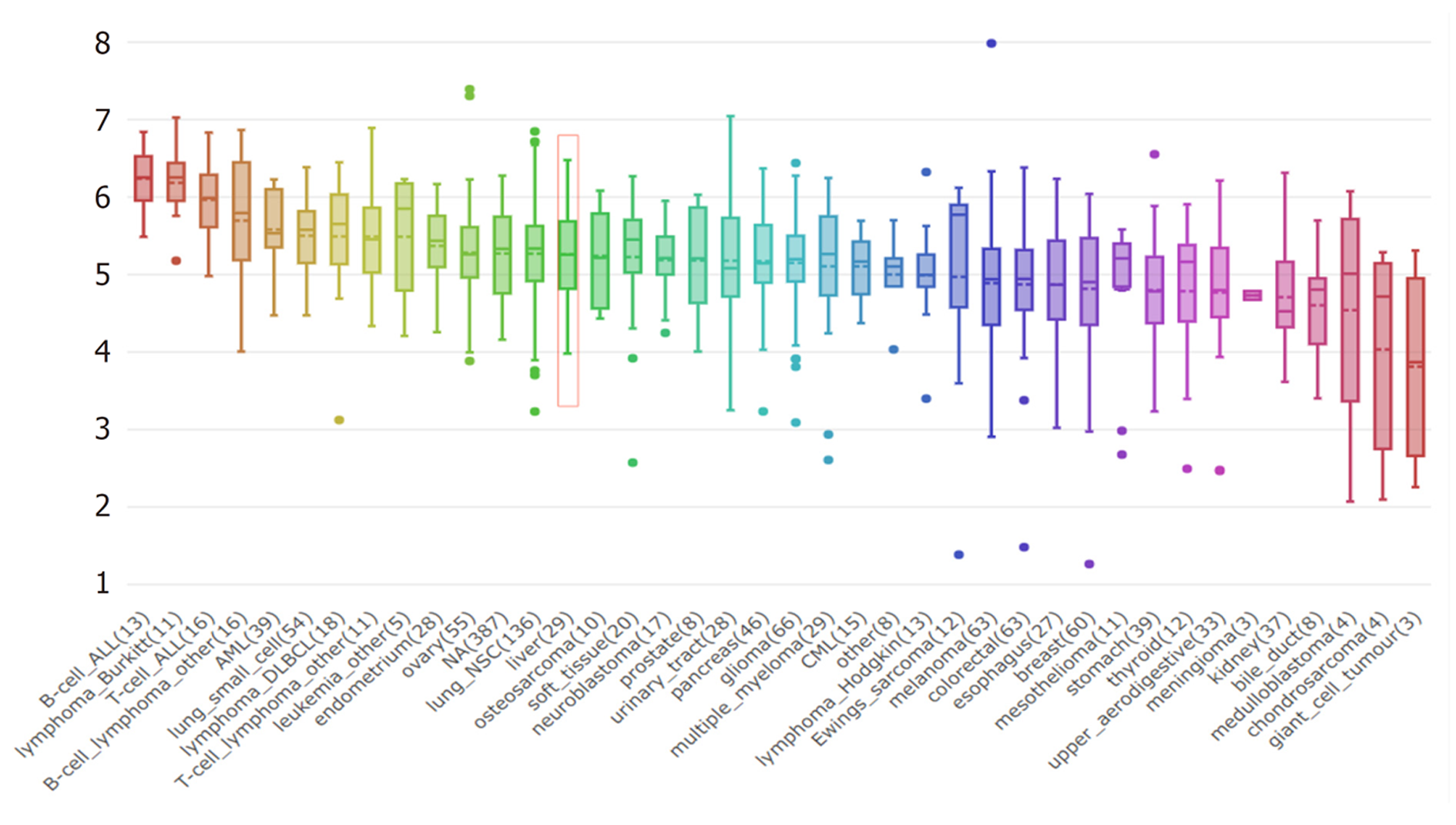
CCLE数据库分析结果显示, TACC3在40种细胞系中高表达, 排在前三位的分别为B细胞、Burkitt淋巴瘤细胞、T细胞(表达中位值分别为6.23、6.18、5.96); 在肝癌细胞系中高表达(表达值为5.25), 并且在40种癌细胞系中排名第14 位, 见图4.
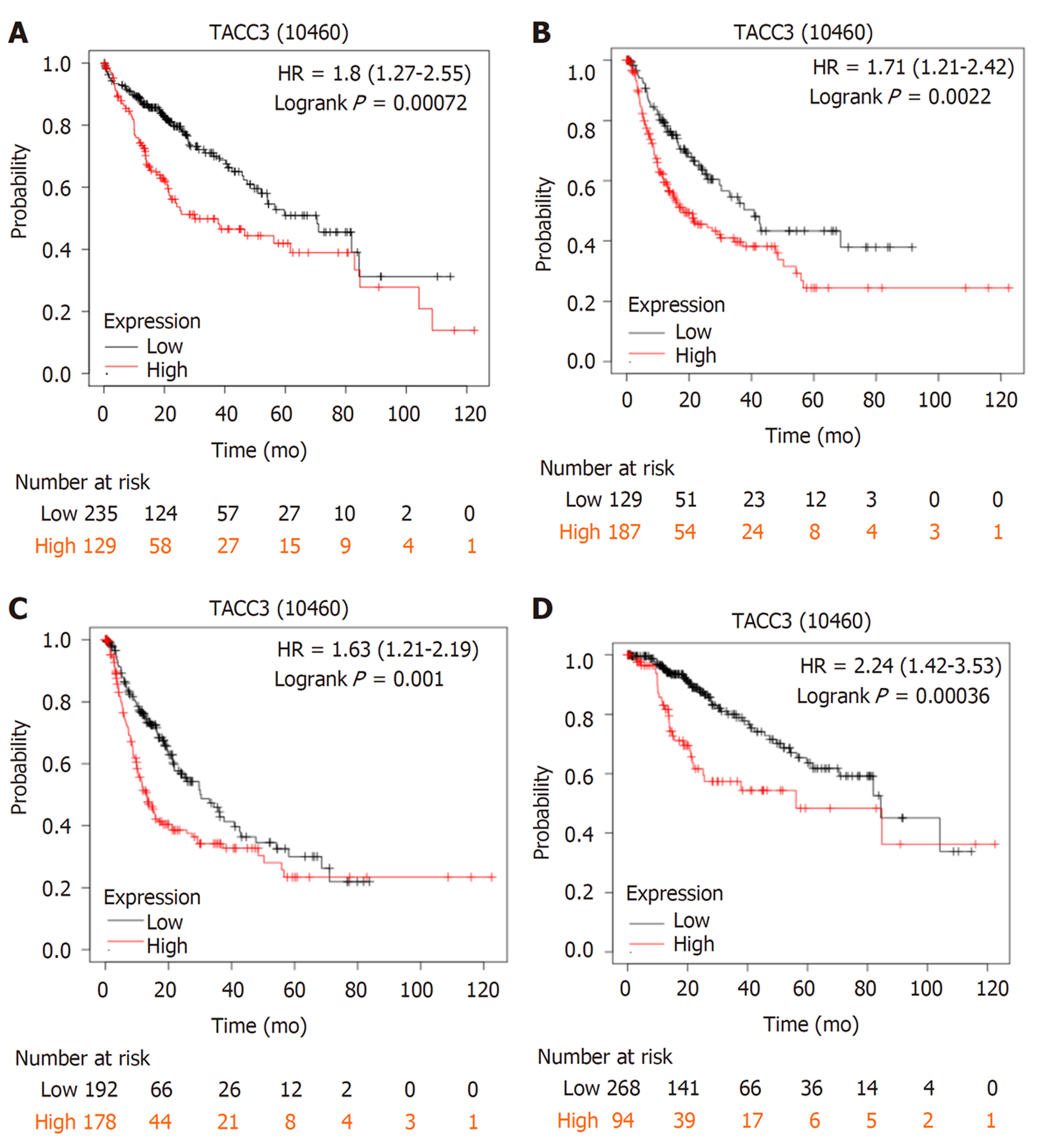
2.4.1 在Kaplan-Meier Plotter数据库中检索到: 具有完整OS数据的肝癌患者364例(高表达组129例, 低表达组235例), 具有完整RFS数据的肝癌患者316例(高表达组187例, 低表达组129例), 具有完整PFS数据的肝癌患者370例(高表达组178例, 低表达组192例), 具有完整DSS数据的肝癌患者362例(高表达组94例, 低表达组268例), 生存分析结果显示, TACC3基因表达水平对肝癌患者的OS、RFS、PFS及DSS均有显著影响, TACC3基因高表达组的OS、RFS、PFS、DSS等生存预后指标均较低表达组差(P<0.05), 图5.
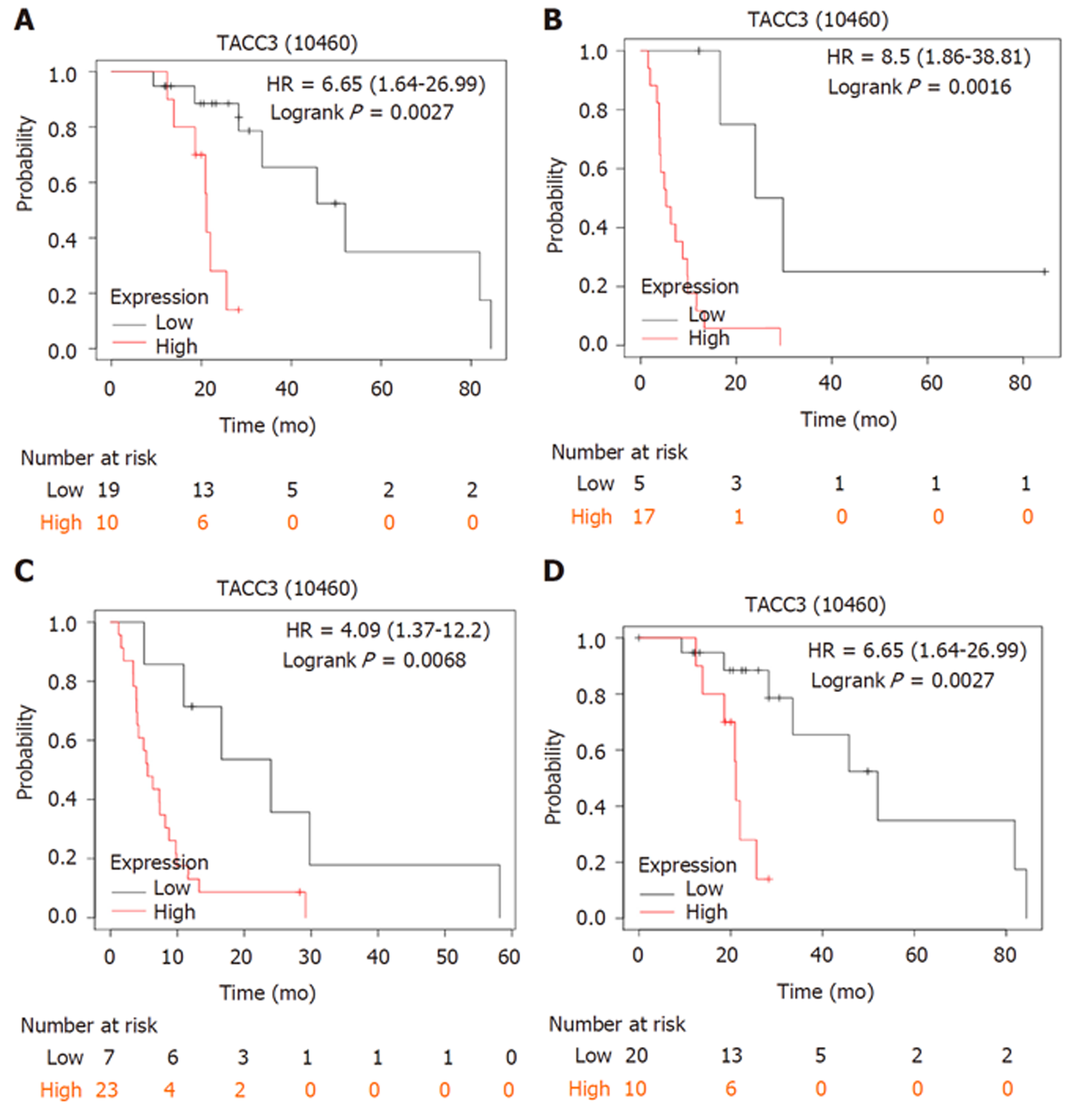
进一步在Kaplan-Meier Plotter数据库中检索到具有完整OS数据的索拉非尼治疗肝癌患者29例(高表达组10例, 低表达组19例), 具有完整RFS数据的索拉非尼治疗肝癌患者22例(高表达组17例, 低表达组5例), 具有完整PFS数据的索拉非尼治疗肝癌患者30例(高表达组23例, 低表达组7例), 具有完整DSS数据的索拉非尼治疗肝癌患者30例(高表达组10例, 低表达组20例), 生存分析结果显示, TACC3基因表达水平对索拉非尼治疗肝癌患者的OS、RFS、PFS及DSS均有显著影响, TACC3基因高表达组的OS、RFS、PFS、DSS等生存预后指标同样均较低表达组差(P<0.05), 图6.
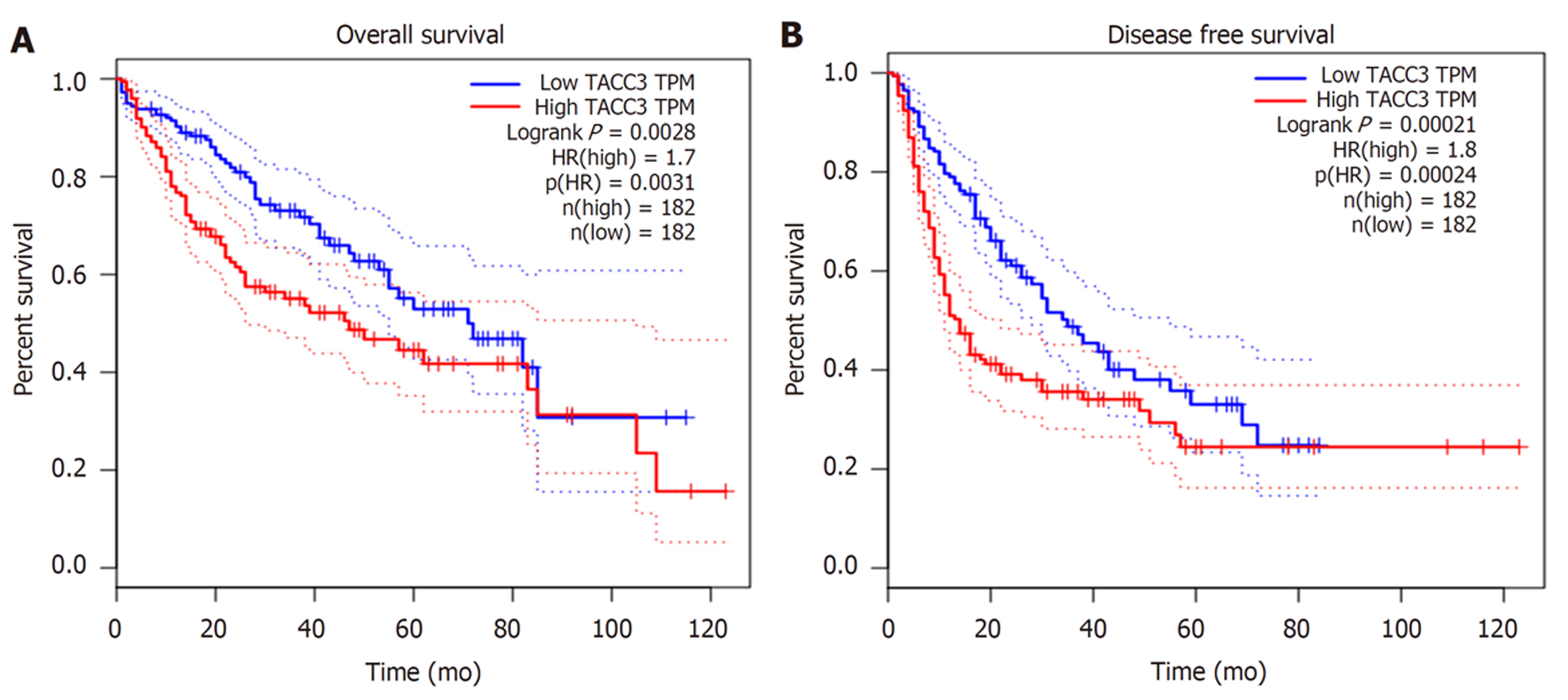
2.4.2 在GEPIA数据库中检索: 共检索到364例肝癌患者(高表达组182例, 低表达组182例), 生存分析结果显示TACC3基因表达水平对肝癌患者的OS、PFS均有显著影响, TACC3基因高表达组的OS、PFS均较低表达组差(P<0.05), 见图7.
TACC蛋白家族的成员是组成中心体的主要蛋白. 它们因具有较强的酸性, 且于羧基末端包含一卷曲螺旋区域(现被称为TACC结构域), 同时具有促进细胞转化的活性, 因此被命名为酸性卷曲转化相关蛋白(transforming acidic coiled-coil proteins, TACC). 与非洲爪蟾和其他脊椎动物一样, 人类细胞中共有3种TACC蛋白: TACC1、TACC2、TACC3[14,15]. TACC3基因定位于染色体4p16.3, 含有高度保守的C-末端卷曲螺旋结构域, 其主要功能是在细胞有丝分裂时保持中心体微管成核稳定和中心体完整性[3,16-18]. 同时TACC3在细胞增殖、分化和基因调控中也起着重要的作用[19,20].
大量研究表明, TACC3在乳腺癌[4], 非小细胞肺癌[5], 胃癌[6], 前列腺癌[21], 骨肉瘤[22]等患者中高表达, 且其高表达状态与患者生存预后差紧密相关. Qie等[21]研究发现TACC3在前列腺癌中显著上调, 并且通过体外和体内实验, 证实TACC3的敲除抑制肿瘤发生和肿瘤生长, 其机制可能与TACC3水平的升高破坏了filamin A与meckelin之间的相互作用, 从而抑制前列腺癌细胞中初级纤毛的形成相关. Zhao等[22]研究发现骨肉瘤组织和细胞系中TACC3表达显著增加, 并且TACC3敲除后能够抑制骨肉瘤细胞的增殖、迁移和侵袭, 考虑与NF-κB信号通路相关. 本研究采用生物信息学分析方法探讨了TACC3基因在肝癌中的表达情况, 同时分析了其与患者预后的相关性. 研究结果认为肝癌癌组织中的表达水平明显高于正常肝脏组织, 提示TACC3在肝癌的发生发展中可能发挥重要作用. 生存分析显示TACC3高表达与肝癌的较短生存期有关. 本研究与既往Zhou等[23]的研究报道结果相一致, 其研究证实肝癌组织标本中TACC3蛋白和mRNA水平均升高. 此外, TACC3高表达与总生存率和无病生存率差呈正相关, 同时在基础实验中TACC3基因敲除或潜在的TACC3抑制剂能够抑制肝癌细胞的增殖、克隆形成. 因此, 阻断TACC3有望成为治疗肝癌的新靶点.
本研究通过数据挖掘全面分析了TACC3基因在肝癌中的表达及与患者预后的相关性, 对靶向TACC3治疗肝癌提供理论依据. 但本研究结果均为各数据库挖掘分析数据, 具有一定的局限性, 关于TACC3基因是如何调控并促进肝癌的发生、发展及其与各相关信号通路之间的关系仍不甚明确, 尚需大量基础实验及临床试验进一步探讨.
肝癌是恶性肿瘤相关死亡的第四大常见原因, 在发病率方面排名第六位. 随着手术、化疗、靶向及免疫治疗方式的进步以及多学科综合治疗方案的普及, 肝癌患者生存期虽然有所延长, 但防控形势依旧严峻. 因此, 寻找新的肝癌标志物和潜在治疗靶点, 研究其在肝癌发病过程中的分子机制对于肝癌防控具有重要意义.
转录相关酸性卷曲蛋白3(transforming acidic coiled coil protein 3, TACC3)是TACC家族的重要成员,其受到Aurora-A激酶的调节, 靶向中心体, 在有丝分裂期间对微管生长至关重要. 研究表明, TACC3基因在乳腺癌, 非小细胞肺癌, 胃癌中高表达, 并与预后较差有关. 但是其在肝癌组织中的表达及其与患者预后关系不明.
本研究通过生物信息学方法探讨TACC3在肝癌组织的表达情况, 及其与患者的预后关系.
检索BioGPS、Oncomine、癌症细胞系百科全书(cancer cell line encyclopedia, CCLE)等数据库, 获取TACC3基因在肝癌中的表达数据. 应用Kaplan-Meier Plotter、GEPIA数据库分析TACC3基因对肝癌患者预后生存的影响.
BioGPS数据库分析结果显示TACC3基因在人体各组织中均有表达, 肝脏组织中的表达值中位数略高于其他正常组织(8.95 vs 7.1). 从Oncomine数据库检索显示肝癌组织中TACC3基因高表达4项, 低表达1项, Meta分析显示与正常肝组织相比TACC3基因在肝癌组织中呈高表达状态中位秩(Median Rank) = 442.5, P<0.05. CCLE数据库分析显示, 在肝癌细胞系中TACC3 mRNA高表达. Kaplan-Meier Plotter及GEPIA数据库生存分析结果显示, TACC3基因高表达组的肝癌患者总体生存时间(OS)和无进展生存时间(PFS)等生存预后指标均较低表达组差(P<0.05).
TACC3基因在肝癌组织中呈高表达, 且TACC3基因高表达与肝癌患者生存预后差有关.
TACC3基因有望成为肝癌靶向治疗或预测预后的潜在分子标志物.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑:刘继红 制作编辑:张砚梁
| 1. | Villanueva A. Hepatocellular Carcinoma. N Engl J Med. 2019;380:1450-1462. [PubMed] [DOI] |
| 3. | Ding ZM, Huang CJ, Jiao XF, Wu D, Huo LJ. The role of TACC3 in mitotic spindle organization. Cytoskeleton (Hoboken). 2017;74:369-378. [PubMed] [DOI] |
| 4. | Song H, Liu C, Shen N, Yi P, Dong F, Li X, Zhang N, Huang T. Overexpression of TACC3 in Breast Cancer Associates With Poor Prognosis. Appl Immunohistochem Mol Morphol. 2018;26:113-119. [PubMed] [DOI] |
| 5. | Jung CK, Jung JH, Park GS, Lee A, Kang CS, Lee KY. Expression of transforming acidic coiled-coil containing protein 3 is a novel independent prognostic marker in non-small cell lung cancer. Pathol Int. 2006;56:503-509. [PubMed] [DOI] |
| 6. | Yun M, Rong J, Lin ZR, He YL, Zhang JX, Peng ZW, Tang LQ, Zeng MS, Zhong Q, Ye S. High expression of transforming acidic coiled coil-containing protein 3 strongly correlates with aggressive characteristics and poor prognosis of gastric cancer. Oncol Rep. 2015;34:1397-1405. [PubMed] [DOI] |
| 7. | Wu C, Orozco C, Boyer J, Leglise M, Goodale J, Batalov S, Hodge CL, Haase J, Janes J, Huss JW, Su AI. BioGPS: an extensible and customizable portal for querying and organizing gene annotation resources. Genome Biol. 2009;10:R130. [PubMed] [DOI] |
| 8. | Rhodes DR, Kalyana-Sundaram S, Mahavisno V, Varambally R, Yu J, Briggs BB, Barrette TR, Anstet MJ, Kincead-Beal C, Kulkarni P, Varambally S, Ghosh D, Chinnaiyan AM. Oncomine 3.0: genes, pathways, and networks in a collection of 18,000 cancer gene expression profiles. Neoplasia. 2007;9:166-180. [PubMed] [DOI] |
| 9. | Nagy Á, Lánczky A, Menyhárt O, Győrffy B. Validation of miRNA prognostic power in hepatocellular carcinoma using expression data of independent datasets. Sci Rep. 2018;8:9227. [PubMed] [DOI] |
| 10. | Tang Z, Li C, Kang B, Gao G, Li C, Zhang Z. GEPIA: a web server for cancer and normal gene expression profiling and interactive analyses. Nucleic Acids Res. 2017;45:W98-W102. [PubMed] [DOI] |
| 11. | Chen X, Cheung ST, So S, Fan ST, Barry C, Higgins J, Lai KM, Ji J, Dudoit S, Ng IO, Van De Rijn M, Botstein D, Brown PO. Gene expression patterns in human liver cancers. Mol Biol Cell. 2002;13:1929-1939. [PubMed] [DOI] |
| 12. | Roessler S, Jia HL, Budhu A, Forgues M, Ye QH, Lee JS, Thorgeirsson SS, Sun Z, Tang ZY, Qin LX, Wang XW. A unique metastasis gene signature enables prediction of tumor relapse in early-stage hepatocellular carcinoma patients. Cancer Res. 2010;70:10202-10212. [PubMed] [DOI] |
| 13. | Wurmbach E, Chen YB, Khitrov G, Zhang W, Roayaie S, Schwartz M, Fiel I, Thung S, Mazzaferro V, Bruix J, Bottinger E, Friedman S, Waxman S, Llovet JM. Genome-wide molecular profiles of HCV-induced dysplasia and hepatocellular carcinoma. Hepatology. 2007;45:938-947. [PubMed] [DOI] |
| 14. | Nigg EA, Raff JW. Centrioles, centrosomes, and cilia in health and disease. Cell. 2009;139:663-678. [PubMed] [DOI] |
| 15. | Peset I, Vernos I. The TACC proteins: TACC-ling microtubule dynamics and centrosome function. Trends Cell Biol. 2008;18:379-388. [PubMed] [DOI] |
| 16. | Lappin TR, Mullan RN, Stewart JP, Morgan NA, Thompson A, Maxwell AP. AINT/ERIC/TACC: an expanding family of proteins with C-terminal coiled coil domains. Leuk Lymphoma. 2002;43:1455-1459. [PubMed] [DOI] |
| 17. | Thakur HC, Singh M, Nagel-Steger L, Kremer J, Prumbaum D, Fansa EK, Ezzahoini H, Nouri K, Gremer L, Abts A, Schmitt L, Raunser S, Ahmadian MR, Piekorz RP. The centrosomal adaptor TACC3 and the microtubule polymerase chTOG interact via defined C-terminal subdomains in an Aurora-A kinase-independent manner. J Biol Chem. 2014;289:74-88. [PubMed] [DOI] |
| 18. | Still IH, Vince P, Cowell JK. The third member of the transforming acidic coiled coil-containing gene family, TACC3, maps in 4p16, close to translocation breakpoints in multiple myeloma, and is upregulated in various cancer cell lines. Genomics. 1999;58:165-170. [PubMed] [DOI] |
| 19. | Barr AR, Gergely F. Aurora-A: the maker and breaker of spindle poles. J Cell Sci. 2007;120:2987-2996. [PubMed] [DOI] |
| 20. | Gangisetty O, Lauffart B, Sondarva GV, Chelsea DM, Still IH. The transforming acidic coiled coil proteins interact with nuclear histone acetyltransferases. Oncogene. 2004;23:2559-2563. [PubMed] [DOI] |
| 21. | Qie Y, Wang L, Du E, Chen S, Lu C, Ding N, Yang K, Xu Y. TACC3 promotes prostate cancer cell proliferation and restrains primary cilium formation. Exp Cell Res. 2020;390:111952. [PubMed] [DOI] |
| 22. | Zhao C, He X, Li H, Zhou J, Han X, Wang D, Tian G, Sui F. Downregulation of TACC3 inhibits tumor growth and migration in osteosarcoma cells through regulation of the NF-κB signaling pathway. Oncol Lett. 2018;15:6881-6886. [PubMed] [DOI] |
| 23. | Zhou DS, Wang HB, Zhou ZG, Zhang YJ, Zhong Q, Xu L, Huang YH, Yeung SC, Chen MS, Zeng MS. TACC3 promotes stemness and is a potential therapeutic target in hepatocellular carcinoma. Oncotarget. 2015;6:24163-24177. [PubMed] [DOI] |