修回日期: 2020-03-19
接受日期: 2020-03-23
在线出版日期: 2020-03-28
结肠癌在我国恶性肿瘤中发病率和死亡率均居第5位, 化疗是其主要治疗方式, 有研究表明免疫抑制剂FTY720对癌症细胞增殖起一定的抑制作用, 抑制剂联合化疗药物可提高癌症治疗效果. 本研究使用免疫抑制剂FTY720与吉西他滨联合处理结肠癌细胞, 并探索miR-494/哺乳动物Ste20样激酶1(mammalian Ste20-like kinase 1, MST1)对在此过程中对结肠癌细胞增殖和凋亡的影响, 以期为结肠癌的治疗提供新的思路.
研究FTY720和吉西他滨对结肠癌细胞存活率和凋亡的影响和潜在的分子机制.
用0.0001 μg/mL、0.001 μg/mL、0.01 μg/mL、0.1 μg/mL、1 μg/mL的吉西他滨和2.5 μmol/L、5 μmol/L、7.5 μmol/L、10 μmol/L、12.5 μmol/L的FTY720处理结肠癌SW1116细胞, CCK8法和流式细胞术检测SW1116细胞存活率和凋亡率, 实时定量聚合酶链式反应检测miR-494和MST1 mRNA的含量, Western blot检测MST1、p21和Caspase-3蛋白表达水平, 双荧光素酶报告系统验证miR-494与MST1的调控关系.
吉西他滨(0.0001 μg/mL、0.001 μg/mL、0.01 μg/mL、0.1 μg/mL、1 μg/mL)和FTY720 (2.5 μmol/L、5 μmol/L、7.5 μmol/L、10 μmol/L、12.5 μmol/L)均可降低结肠癌SW1116细胞的存活率, 且具有浓度依赖性, 根据结果选取抑制率约为50%的0.1 μg/mL吉西他滨和10 μmol/L的FTY720进行后续实验, 吉西他滨和FTY720均可抑制细胞存活并促进细胞凋亡, 且联合使用比单独使用效果更好; 过表达miR-494可逆转FTY720、吉西他滨对SW1116细胞存活率和凋亡的作用; miR-494靶向调控MST1; 抑制MST1可逆转FTY720和吉西他滨对SW1116细胞存活率和凋亡的影响.
FTY720和吉西他滨通过miR-494/MST1抑制SW1116细胞存活, 促进细胞凋亡. FTY720和吉西他滨对结肠癌SW1116具有抑制作用, 且联合使用效果更佳.
核心提要: 化疗是结肠癌的主要治疗方式, 免疫抑制剂对癌症患者起一定的作用. 本研究中使用免疫抑制剂FTY720与吉西他滨联合处理结肠癌细胞, 对结肠癌的治疗可能起到一定的积极作用.
引文著录: 薛珊, 邢颖, 宋华伟. FTY720通过miR-494/MST1抑制结肠癌细胞并增加吉西他滨敏感性的分子机制. 世界华人消化杂志 2020; 28(6): 217-225
Revised: March 19, 2020
Accepted: March 23, 2020
Published online: March 28, 2020
Colon cancer ranks 5th in both incidence and mortality among malignant tumors in China. Chemotherapy is the main treatment method. Studies have shown that immunosuppressive agent FTY720 has a certain inhibitory effect on cancer cell proliferation. Inhibitors combined with chemotherapy drugs can improve the therapeutic effect of cancer. In this study, immunosuppressive agent FTY720 and gemcitabine were used together to treat colon cancer cells, and the role of miR-494/mammalian Ste20-like kinase 1 (MST1) in the proliferation and apoptosis of colon cancer cells was explored, with an aim to provide a new treatment for colon cancer.
To investigate the effects of FTY720 and gemcitabine on the survival and apoptosis of colon cancer cells and the potential molecular mechanisms involved.
Colon cancer SW1116 cells were treated with gemcitabine at concentrations of 0.0001 μg/mL, 0.001 μg/mL, 0.01 μg/mL, 0.1 μg/mL, and 1 μg/mL and FTY720 at concentrations of 2.5 μmol/L, 5 μmol/L, 7.5 μmol/L, 10 μmol/L, and 12.5 μmol/L. CCK8 assay and flow cytometry were applied to detect the survival rate and apoptosis rate of SW1116 cells. Quantitative real-time polymerase chain reaction was used to measure the levels of miR-494 and MST1 mRNA. Western blot was carried out to detect the expression levels of MST1, p21, and Caspase-3 proteins. Dual-luciferase reporter assay was performed to verify the relationship between miR-494 and MST1.
Gemcitabine and FTY720 reduced the survival rate of colon carcinoma SW1116 cells in a concentration dependent manner. According to the results, 0.1 μg/mL gemcitabine and 10 μmol/L FTY720 with an inhibition rate of about 50% were selected for subsequent experiments. Gemcitabine and FTY720 both inhibited cell survival and promoted cell apoptosis, and their combined use was better than the single use. Overexpression of miR-494 reversed the effects of FTY720 and gemcitabine on survival and apoptosis in SW1116 cells. MiR-494 targeted and regulated MST1. Inhibition of MST1 reversed the effects of FTY720 and gemcitabine on the survival and apoptosis in SW1116 cells.
FTY720 and gemcitabine inhibit SW1116 cell survival and promote apoptosis through the miR-494/MST1 pathway. The combination of FTY720 and gemcitabine has more significantly inhibitory effects on the survival and apoptosis of SW1116 cells.
- Citation: Xue S, Xing Y, Song HW. FTY720 inhibits colon cancer cell survival and increases their sensitivity to gemcitabine through the miR-494/MST1 pathway. Shijie Huaren Xiaohua Zazhi 2020; 28(6): 217-225
- URL: https://www.wjgnet.com/1009-3079/full/v28/i6/217.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i6.217
我国结肠癌患病率和死亡率均在上升, 2015年新发37.6万例, 死亡19.1万例, 在我国恶性肿瘤中发病率和死亡率均居第5位[1]. 化疗是大多结直肠癌患者的标准治疗方法, 化疗中加入生物制剂可延长患者总生存期的中位数[2].
FTY720又称芬戈莫德, 是在器官移植和多发性硬化症中广泛使用的免疫调节剂. 研究表明, FTY720对结肠癌细胞具有明显的抑制作用[3]. 吉西他滨是一种抗肿瘤药物, 被应用于包括结直肠癌在内的多种癌症治疗, 吉西他滨可通过激活哺乳动物Ste20样激酶1 (mammalian Ste20-like kinase 1, MST1)诱导结肠癌细胞凋亡[4]. 但FTY720对吉西他滨作用的结肠癌细胞的敏感性有怎样的影响目前还不清楚. 本研究发现, miR-494与MST1存在结合位点. miR-494在结直肠癌中表达上调, 并可促进癌细胞增殖、迁移、侵袭等行为[5,6]. 本研究假设, FTY720可通过miR-494调控MST1增加结肠癌细胞对吉西他滨的敏感性.
本课题以人结肠癌细胞系SW1116为研究对象, 检测FTY720和吉西他滨联合使用对结肠癌细胞存活和凋亡的影响, 以及miR-494和MST1在此机制中的作用.
人结肠癌细胞株SW1116购自美国模式菌种收集中心(american type culture collection, ATCC); FTY720、吉西他滨和胰蛋白酶购自美国Sigma-Aldrich公司; DMEM高糖培养基和胎牛血清(fetal bovine serum, FBS)购自美国Gibco公司; 双荧光素酶报告系统(Dual-Luciferase Reporter Assay System)购自美国Promega公司; Lipofectamine 2000转染试剂、RNA提取试剂Trizol、实时定量聚合酶链式反应(real-time polymerase chain reaction, RT-PCR)试剂盒、反转录试剂盒购自宝生物工程(大连)有限公司公司; CCK8试剂盒购自上海碧云天生物技术有限公司; 双染色流式法细胞凋亡检测试剂盒购自美国BD公司; miR-494 mimics(miR-494)、miR-494抑制物(anti-miR-494)、MST1抑制剂(si-MST1)和阴性对照(miR-NC、anti-miR-NC和si-NC)、MST1双荧光素酶报告载体购自上海吉玛制药有限公司; MST1抗体、p21抗体、Caspase-3抗体和GAPDH抗体购自美国Santa-cruz公司; Real-time PCR仪购自美国Bio-Rad公司; 流式细胞仪购自美国BD公司; BCA蛋白检测试剂盒购自美国Thermo.
1.2.1 细胞培养、药物处理: SW1116细胞培养于含10% FBS、1% 青-链霉素的DMEM高糖培养基中, 置于37 ℃ 5% CO2培养箱中培养, 湿度保持95%. 将细胞培养至对数生长期, 消化传代. 将细胞培养至贴壁后, 在培养液中加入终浓度为0.0001 μg/mL、0.001 μg/mL、0.01 μg/mL、0.1 μg/mL、1 μg/mL的吉西他滨和/或2.5 μmol/L、5 μmol/L、7.5 μmol/L、10 μmol/L、12.5 μmol/L的FTY720, 继续培养24 h, 收集细胞进行实验.
1.2.2 细胞转染: 将对数生长期的SW1116细胞用培养液稀释至1×l06-2×l06个/mL, 以200 μL细胞/孔的密度接种于6孔板中, 融合度为80%-90%时进行转染. 先用无血清培养液稀释脂质体、miR-NC、miR-494、anti-miR-NC、anti-miR-494、si-NC、si-MST1等载体, 将脂质体和各组载体分别以体积混合, 室温孵育20 min, 加入到培养好的细胞中, 混匀, 培养6 h, 换完全培养基, 转染48 h, 收集细胞进行实验或药物处理. 分组: miR-NC组、miR-494组、anti-miR-NC组、anti-miR-494组、si-NC组、si-MST1组.
1.2.3 qRT-PCR检测mRNA的表达: 收集各组SW1116细胞, Trizol试剂提取细胞总RNA, 反转录合成cDNA, 再以cDNA为模板按照Real-time PCR的说明书进行反应合成miR-494和MST1 mRNA. 引物如下: miR-494上游: 5'-TGAAACATACACGGGAAACCTC-3', 下游采用通用引物5'-GCGAGCACAGAATTAATACGAC-3'; MST1上游: 5'-GGGTCCCAGTAGCCAAGAT-3', 下游: 5'-GAGGCACCACATACCATTCA-3'; 内参U6上游引物: 5'-CGCTTCGGCAGCACATATACTA-3', 下游采用通用引物. 运用2−ΔΔCt方法进行数据分析.
1.2.4 CCK8实验检测细胞存活率和半数抑制浓度: 收集FTY720和/或吉西他滨处理24 h后的SW1116细胞, 0.25%胰蛋白酶消化, 培养液稀释细胞以2×103个/孔(100 μL细胞)接种于96微孔板中, 加入10 μL CCK8溶液, 培养2 h, 酶标仪测定450 nm吸光度(Absorbance value, A)值. 细胞存活率 = 实验组A值/对照组A值×100%. 抑制率% = (对照组A值-实验组A值)/对照组A值×100%. 以药物浓度和抑制率分别为横轴和纵轴, 绘制浓度效应曲线, 计算半数抑制浓度(50% inhibiting concentration, IC50).
1.2.5 流式细胞术测定细胞凋亡率: 将SW1116细胞以2×105个/孔接种于6孔板中, 培养24 h (细胞贴壁), 然后用FTY720和/或吉西他滨处理24 h, 消化收集细胞, 按照凋亡试剂盒说明书进行操作, 加入5 μL膜联蛋白标记的V-FITC和5 μL碘化丙啶, 混匀后室温避光20 min, 流式细胞仪检测凋亡率.
1.2.6 双荧光素酶报告实验: SW1116细胞转染48 h, 收集细胞, Trypsin消化, 计数, 以1×104个细胞/孔接种于24孔板中, 培养24 h , 观察若细胞融合度达到80%-90%, 进行转染, 分别构建MST1的野生型(WT-MST1)和突变型(MUT-MST1)双荧光素酶报告载体, 将报告载体分别与miR-NC或miR-494共转染SW1116细胞, 转染后培养48 h, 裂解细胞, 根据试剂盒检测荧光素酶活性. 以海肾荧光素酶活性为内参照, 计算相对萤火虫荧光素酶活性.
1.2.7 Western blot实验: 将转染48 h后的各组SW1116细胞用RIPA裂解液裂解, 超声破碎细胞, 收集蛋白. 将蛋白样本进行SDS-PAGE, 转膜, 封闭1 h, 加入一抗(MST1: 1:1000, p21: 1:2000, Caspase-3: 1:2000), 4 ℃孵育过夜. 洗膜2次, 然后加入的二抗(1:1000), 室温孵育1 h. 以GAPDH为内参照, 分析蛋白水平.
统计学处理 结果均以mean±SD表示, 数据采用SPSS 19.0统计软件进行分析, 采用独立样本t检验和单因素方差进行分析. 以P<0.05为差异具有统计学意义.
与0 μg/mL浓度的吉西他滨(100.11%±10.02%)相比, 0.0001 μg/mL、0.001 μg/mL、0.01 μg/mL、0.1 μg/mL、1 μg/mL的吉西他滨处理的结肠癌SW1116细胞的存活率(95.14%±9.26%、86.84%±8.73%、0.16%±7.14%、54.18%±5.27%、37.68%±3.59%)逐渐降低, 具有剂量依赖性, 计算得IC50 = 0.1024 μg/mL, 差异均具有统计学意义(P<0.05); 与0 μmol/L的FTY720 (100.01%±10.01%)相比, 2.5 μmol/L、5 μmol/L、7.5 μmol/L、10 μmol/L、12.5 μmol/L的FTY720处理的结肠癌SW1116细胞的存活率(87.67%±8.37%、71.34%±7.25%、64.30%±6.51%、48.28%±4.56%、39.97%±4.03%)逐渐降低, 具有剂量依赖趋势, 差异均具有统计学意义(P<0.05), 计算得IC50 = 8.625 μg/mL (表1、表2). 根据结果, 后期实验选用存活率约为50%的吉西他滨浓度0.1 μg/mL, FTY720浓度10 μmol/L.
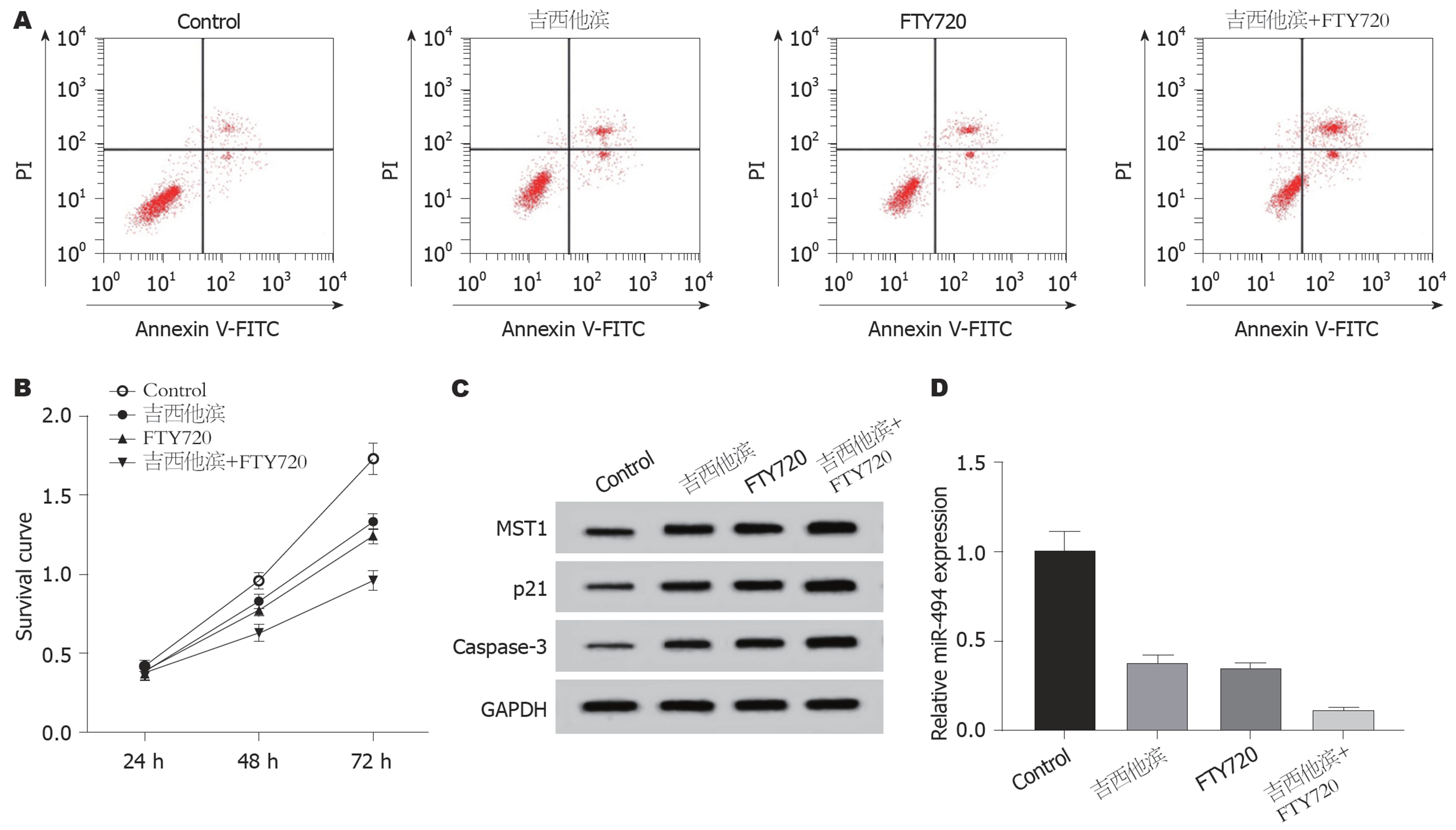
与对照组相比, 吉西他滨组和FTY720组的SW1116细胞中miR-494的含量均降低(P<0.05), MST1、p21和Caspase-3蛋白表达量均升高, 细胞存活率均降低(P<0.05), 细胞凋亡率均上升(P<0.05); 吉西他滨+FTY720组结果与吉西他滨组和FTY720组结果趋势一致, 且效果更显著(图1、表3). 说明两者联合使用可抑制SW1116细胞存活并促进细胞凋亡, 且比单独使用效果更好.
| 分组 | miR-494 | MST1蛋白 | p21 | Caspase-3 | 细胞存活率(%) | 凋亡率(%) |
| Control | 1.01±0.10 | 0.31±0.03 | 0.16±0.01 | 0.11±0.01 | 100.00±10.01 | 8.81±0.92 |
| 吉西他滨 | 0.38±0.04a | 0.68±0.07a | 0.52±0.05a | 0.44±0.04a | 54.16±5.27a | 20.15±2.06a |
| FTY720 | 0.35±0.03a | 0.75±0.07a | 0.59±0.06a | 0.48±0.05a | 51.01±5.11a | 22.37±2.48a |
| 吉西他滨+FTY720 | 0.12±0.01abc | 1.61±0.12abc | 1.13±0.09abc | 0.96±0.09abc | 33.64±3.35abc | 45.67±3.62abc |
| F值 | 415.714 | 144.618 | 134.545 | 119.569 | 174.905 | 43.759 |
| P值 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 |
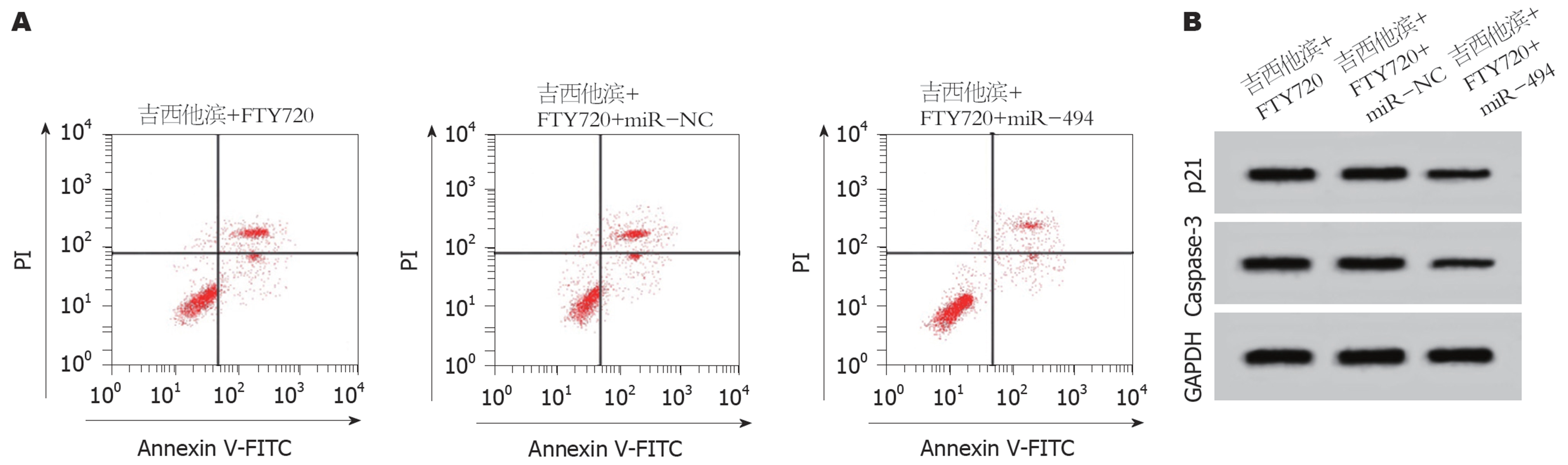
与吉西他滨+FTY720+miR-NC组相比, 吉西他滨+FTY720+miR-494组SW1116细胞的miR-494含量升高(P<0.05), p21和Caspase-3表达显著降低(P<0.05), 细胞存活率升高(P<0.05), 凋亡率下降(P<0.05)(图2、表4、表5). 说明过表达miR-494可逆转FTY720、吉西他滨对SW1116细胞存活率和凋亡的作用.
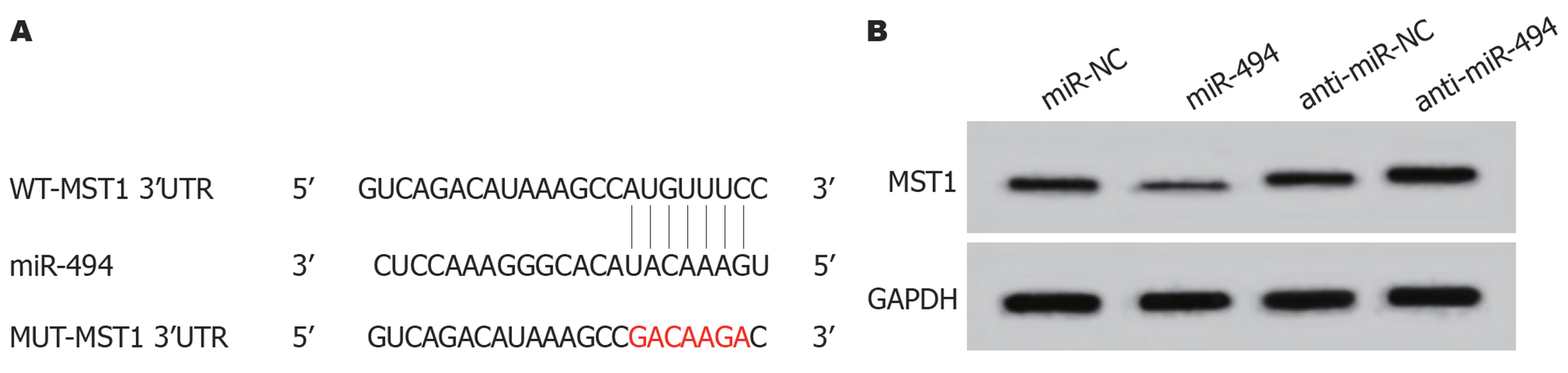
Targetscan预测结果显示, MST1的3'-UTR序列中含有与miR-494互补的位点(图3A). 双荧光素酶报告系统结果如表6所示, 与miR-NC组相比, miR-494组野生型WT-MST1的萤火虫荧光素酶相对活性显著下降(P<0.05); 而突变型MUT-MST1的萤火虫荧光素酶相对活性无明显变化. Western blot结果发现, 过表达miR-494组的MST1mRNA和蛋白表达量显著下降(P<0.05); miR-494抑制组的MST1 mRNA和蛋白表达量均显著上升(P<0.05)(图3B、表7).
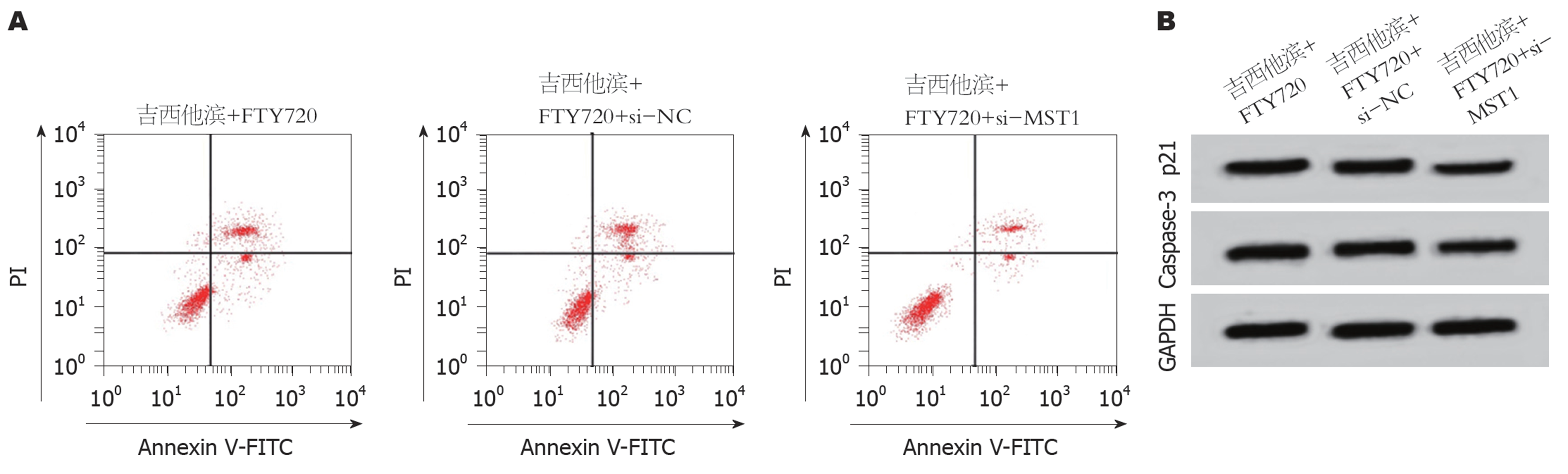
与吉西他滨+FTY720组和吉西他滨+FTY720+si-NC组相比, 吉西他滨+FTY720+si-MST1组的SW1116细胞中MST1 mRNA含量降低(P<0.05), p21和Caspase-3表达显著降低(P<0.05), 细胞存活率升高(P<0.05), 凋亡率下降(P<0.05)(图4、表8). 说明抑制MST1可逆转FTY720和吉西他滨对SW1116细胞存活率和凋亡的影响.
| 分组 | MST1 mRNA | p21 | Caspase-3 | 细胞存活率(%) | 凋亡率(%) |
| 吉西他滨+FTY720 | 1.17±0.12 | 0.91±0.09 | 0.86±0.08 | 33.41±3.28 | 38.40±3.57 |
| 吉西他滨+FTY720+si-NC | 1.18±0.12 | 0.92±0.09 | 0.84±0.08 | 33.37±3.30 | 38.27±3.56 |
| 吉西他滨+FTY720+si-MST1 | 0.51±0.05ac | 0.56±0.05ac | 0.38±0.04ac | 62.68±5.98ac | 18.14±1.66ac |
| F值 | 374.377 | 359.406 | 423.333 | 411.490 | 434.858 |
| P值 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 |
FTY720是临床批准的多发性硬化症免疫调节剂, 通过鞘氨醇-1-磷酸1受体的功能拮抗作用将T细胞隔离于淋巴结, 有研究表明[7]其在肿瘤的化疗中也可发挥作用. FTY720可增强卡铂和它莫西芬在卵巢癌患者来源的异种移植模型中的抗肿瘤活性[8]; FTY720可抑制基底样乳腺癌生长[9]并增强胶质母细胞瘤细胞对替莫唑胺的敏感性[10]. 有研究表明[11], FTY720对结直肠癌细胞也有毒性作用. 吉西他滨用于治疗结肠癌、肺癌、卵巢癌、肝胆系统肿瘤等肿瘤, 且效果良好[12,13]. FTY720在吉西他滨对结肠癌的治疗中是否有辅助作用, 目前尚不完全清楚.
本研究通过用不同浓度的FTY720和吉西他滨分别或联合处理结肠癌SW1116细胞发现, FTY720和吉西他滨均可抑制结肠癌细胞SW1116的存活并促进细胞凋亡, 细胞存活率约为50%时吉西他滨浓度为0.1 μg/mL, FTY720浓度为10 μmol/L, 且两者联合使用对SW1116细胞的抑制作用更强. 说明FTY720对吉西他滨抗结肠癌治疗具有促进作用, 但具体机制尚不清楚.
有研究表明[4], 吉西他滨可通过激活MST1并与亲环素D形成线粒体复合物促进结肠癌细胞的死亡. 而本研究通过生物信息学预测发现, miR-494与MST1的3'UTR区存在互补序列, 推测MST1可能是miR-494的靶基因. 因此, 本研究假设, FTY720可能通过miR-494靶向MST1促进吉西他滨对SW1116细胞的抑制作用.
MST1是一种促凋亡激酶, 是凋亡信号传导和细胞功能障碍的关键介质, 其过表达可引起细胞的持续凋亡, 其缺失可导致严重的免疫缺陷, MST1在脑及心肌缺血再灌注损伤、糖尿病、器官大小控制及肿瘤抑制中起着重要作用[14-17]. Hippo通路在癌症中发挥其独特的致瘤能力, 而MST1是Hippo通路的核心成分(MST1/2、LATS1/2、YAP和TAZ)之一, 因此MST1通过Hippo通路参与对肿瘤的调控过程, 其过表达可抑制肿瘤细胞增殖和存活[18]. MST1在胰腺导管癌(PDAC)和非小细胞肺癌A549细胞中均表达下调, 其过表达可降低细胞活力并促进细胞死亡, MST1过表达与线粒体呼吸功能受损和细胞能量代谢受抑制密切相关[19,20]. MST1在结直肠癌中也表达下调, 其过表达可诱导癌细胞凋亡并抑制细胞增殖和迁移[21]. 本研究结果发现, FTY720和吉西他滨均可促进MST1 mRNA和蛋白的表达, 抑制细胞存活并促进细胞凋亡, 抑制MST1可逆转FTY720和吉西他滨对SW1116细胞存活和凋亡的作用, 说明FTY720通过促进MST1抑制结肠癌.
miR-494在结肠癌5-氟尿嘧啶(5-fluorouracil, 5-Fu)耐药细胞系中表达下调, 通过调节DPYD表达增强结肠癌细胞对5-Fu的敏感性[22]. 本研究证实了, FTY720和吉西他滨均可抑制SW1116细胞中miR-494的表达, 过表达miR-494可逆转FTY720、吉西他滨对SW1116细胞存活率和凋亡的作用. 通过双荧光素酶报告系统和Western blot结果发现, miR-494靶向负调控MST1的表达, 间接证实两者的调控关系.
综上所述, 本研究阐述了, 在结直肠癌SW1116细胞中, FTY720和吉西他滨通过下调miR-494靶向促进MST1的表达, 进而抑制SW1116细胞存活, 促进细胞凋亡, 从而达到治疗结直肠癌的目的. FTY720具有增强结直肠癌对吉西他滨敏感性的作用.
结肠癌患者确诊时多为中晚期, 化疗是其主要治疗方式. FTY720是一种作用机制独特的免疫抑制剂,可用于器官移植、自体免疫疾病、肿瘤和炎症等疾病的治疗. 研究表明, FTY720联合化疗药物在癌症中起到积极作用, 本研究采用FTY720联合吉西他滨处理结肠癌细胞, 并探讨两者对结肠癌细胞的抑制作用和机制.
本研究中使用到的是吉西他滨, 它是目前治疗结肠癌的有效药物之一; FTY720对结肠癌细胞也具有一定的毒性作用, 两者联合使用可能对患者的健康有一定的积极意义.
提高吉西他滨对结肠癌细胞的抑制作用, 探讨其对结肠癌的抑制机制.
本篇论文为了达到目标采用了细胞转染、实时定量聚合酶链式反应、CCK8法、流式细胞术、Western blot和双荧光素酶报告实验的方法, 同时进行数据比较时选择独立样本t检验进行两组间比较, 单因素方差进行多组间比较.
选取抑制率约为50%的0.1 μg/mL吉西他滨和10 μmol/L的FTY720进行实验, 吉西他滨和FTY720均可抑制细胞存活并促进细胞凋亡, 且联合使用比单独使用效果更好; 过表达miR-494可逆转FTY720、吉西他滨对SW1116细胞存活率和凋亡的作用; miR-494靶向调控MST1; 抑制MST1可逆转FTY720和吉西他滨对SW1116细胞存活率和凋亡的影响.
根据实验结果, 得出吉西他滨和FTY720可能通过调控miR-494/MST1途径抑制结肠癌细胞增殖, 促进细胞凋亡, 达到抑制结肠癌的目的.
吉西他滨和FTY720的联合使用在结肠癌的临床治疗中具有潜在的应用价值.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑:王禹乔 电编:刘继红
| 2. | Geng F, Wang Z, Yin H, Yu J, Cao B. Molecular Targeted Drugs and Treatment of Colorectal Cancer: Recent Progress and Future Perspectives. Cancer Biother Radiopharm. 2017;32:149-160. [PubMed] [DOI] |
| 3. | 李 娟. FTY720在结肠癌细胞中对自噬的影响及相关机制的探索. 江苏: 南京医科大学 2016; . |
| 4. | 李 向阳, 张 力, 卢 翔. 吉西他滨诱导的结肠癌细胞凋亡与MST1、CypD线粒体复合物的关系. 胃肠病学和肝病学杂志. 2015;24:33-37. [DOI] |
| 5. | Zhang Y, Guo L, Li Y, Feng GH, Teng F, Li W, Zhou Q. MicroRNA-494 promotes cancer progression and targets adenomatous polyposis coli in colorectal cancer. Mol Cancer. 2018;17:1. [PubMed] [DOI] |
| 6. | Sun HB, Chen X, Ji H, Wu T, Lu HW, Zhang Y, Li H, Li YM. miR494 is an independent prognostic factor and promotes cell migration and invasion in colorectal cancer by directly targeting PTEN. Int J Oncol. 2014;45:2486-2494. [PubMed] [DOI] |
| 7. | White C, Alshaker H, Cooper C, Winkler M, Pchejetski D. The emerging role of FTY720 (Fingolimod) in cancer treatment. Oncotarget. 2016;7:23106-23127. [PubMed] [DOI] |
| 8. | Kreitzburg KM, Fehling SC, Landen CN, Gamblin TL, Vance RB, Arend RC, Katre AA, Oliver PG, van Waardenburg RCAM, Alvarez RD, Yoon KJ. FTY720 enhances the anti-tumor activity of carboplatin and tamoxifen in a patient-derived xenograft model of ovarian cancer. Cancer Lett. 2018;436:75-86. [PubMed] [DOI] |
| 9. | Martin JL, Julovi SM, Lin MZ, de Silva HC, Boyle FM, Baxter RC. Inhibition of basal-like breast cancer growth by FTY720 in combination with epidermal growth factor receptor kinase blockade. Breast Cancer Res. 2017;19:90. [PubMed] [DOI] |
| 10. | Zhang L, Wang H. FTY720 inhibits the Nrf2/ARE pathway in human glioblastoma cell lines and sensitizes glioblastoma cells to temozolomide. Pharmacol Rep. 2017;69:1186-1193. [PubMed] [DOI] |
| 11. | Li J, Wang SW, Zhang DS, Sun Y, Zhu CY, Fei Q, Hu J, Zhang C, Sun YM. FTY720-induced enhancement of autophagy protects cells from FTY720 cytotoxicity in colorectal cancer. Oncol Rep. 2016;35:2833-2842. [PubMed] [DOI] |
| 14. | Galan JA, Avruch J. MST1/MST2 Protein Kinases: Regulation and Physiologic Roles. Biochemistry. 2016;55:5507-5519. [PubMed] [DOI] |
| 15. | Li D, Ni H, Rui Q, Gao R, Chen G. Mst1: Function and Mechanism in Brain and Myocardial Ischemia Reperfusion Injury. Curr Neuropharmacol. 2018;16:1358-1364. [PubMed] [DOI] |
| 16. | Ardestani A, Maedler K. MST1: a promising therapeutic target to restore functional beta cell mass in diabetes. Diabetologia. 2016;59:1843-1849. [PubMed] [DOI] |
| 17. | Song H, Mak KK, Topol L, Yun K, Hu J, Garrett L, Chen Y, Park O, Chang J, Simpson RM, Wang CY, Gao B, Jiang J, Yang Y. Mammalian Mst1 and Mst2 kinases play essential roles in organ size control and tumor suppression. Proc Natl Acad Sci U S A. 2010;107:1431-1436. [PubMed] [DOI] |
| 18. | Han Y. Analysis of the role of the Hippo pathway in cancer. J Transl Med. 2019;17:116. [PubMed] [DOI] |
| 19. | Cui J, Zhou Z, Yang H, Jiao F, Li N, Gao Y, Wang L, Chen J, Quan M. MST1 Suppresses Pancreatic Cancer Progression via ROS-Induced Pyroptosis. Mol Cancer Res. 2019;17:1316-1325. [PubMed] [DOI] |
| 20. | Zhang W, Liu K, Pei Y, Ma J, Tan J, Zhao J. Mst1 regulates non-small cell lung cancer A549 cell apoptosis by inducing mitochondrial damage via ROCK1/Factin pathways. Int J Oncol. 2018;53:2409-2422. [PubMed] [DOI] |
| 21. | Li Q, Qi F, Meng X, Zhu C, Gao Y. Mst1 regulates colorectal cancer stress response via inhibiting Bnip3-related mitophagy by activation of JNK/p53 pathway. Cell Biol Toxicol. 2018;34:263-277. [PubMed] [DOI] |
| 22. | Chai J, Dong W, Xie C, Wang L, Han DL, Wang S, Guo HL, Zhang ZL. MicroRNA-494 sensitizes colon cancer cells to fluorouracil through regulation of DPYD. IUBMB Life. 2015;67:191-201. [PubMed] [DOI] |