修回日期: 2018-12-24
接受日期: 2019-01-10
在线出版日期: 2019-01-28
胃癌(gastric cancer, GC)是严重危害人体健康的恶性肿瘤, 其发病率和死亡率分别占世界恶性肿瘤的第5位和第3位. 中医药治疗能够减轻患者病痛, 改善术后复发, 槲寄生多糖(viscum coloratum polysaccharide, VCP)是槲寄生抗肿瘤的主要活性成分之一, 能够抑制癌细胞增殖并诱导凋亡.
观察VCP对胃癌细胞增殖、迁移和侵袭能力的影响并探讨其潜在作用机制.
以不同浓度(20 μg/mL、40 μg/mL、60 μg/mL、80 μg/mL、100 μg/mL)VCP干预SGC-7901人GC细胞48 h, MTT法检测细胞活力. 以100 μg/mLVCP干预SGC-7901细胞, Western blot、Transwell小室分别检测细胞中周期蛋白依赖性蛋白激酶4(cyclin-dependent protein kinases 4, CDK4)、基质金属蛋白酶2(matrix metalloproteinase-2, MMP-2)、基质金属蛋白酶9(matrix metalloproteinase-9, MMP-9)和核转录因子κB p65蛋白表达及细胞迁移和侵袭能力变化.
不同浓度VCP均可抑制SGC-7901细胞活力(P<0.05), 呈浓度依赖性. Western blot和Transwell实验结果表明: 与对照组相比, 100 μg/mL VCP处理的SGC-7901细胞中CDK4、MMP-2、MMP-9、核转录因子-κB (nuclear factor kappa beta, NF-κB)p65蛋白表达下调(P<0.05), 同时视野内迁移和侵袭细胞数明显减少(P<0.05).
VCP对SGC-7901人GC细胞增殖、迁移和侵袭具有抑制作用, 其机制可能与NF-κB信号通路及CDK4、MMP-2和MMP-9蛋白有关.
核心提要: 核转录因子-κB(nuclear factor kappa beta, NF-κB)的信号传导可能与胃癌(gastric cancer, GC)发展及预后有关, 槲寄生多糖可能通过抑制NF-κB信号通路, 调节相关基因表达, 抑制GC细胞增殖、迁移和侵袭.
引文著录: 宣平, 李子芳, 周亮, 李厥宝. 槲寄生多糖调控胃癌细胞增殖、迁移和侵袭的机制研究. 世界华人消化杂志 2019; 27(2): 80-86
Revised: December 24, 2018
Accepted: January 10, 2019
Published online: January 28, 2019
Gastric cancer (GC) is the fifth most common cancer globally and the third leading cause of cancer death. Traditional Chinese medicine treatment can alleviate patients' pain and improve postoperative recurrence. Viscum coloratum polysaccharide is one of the main anti-tumor active components of Viscum coloratum and can inhibit proliferation and induce apoptosis of cancer cells.
To investigate the effect of Viscum coloratum polysaccharide on the proliferation, migration, and invasion of human gastric cancer cells (SGC-7901) and the underlying mechanism.
Viability of SGC-7901 cells treated with Viscum coloratum polysaccharide at 20 μg/mL, 40 μg/mL, 60 μg/mL, 80 μg/mL, and 100 μg/mL for 48 h was detected by MTT assay. Cell migration and invasion were detected by Transwell assays, and the protein expression of cyclin-dependent kinases 4 (CDK4), matrix metalloproteinase 2 (MMP-2), matrix metalloproteinase 9 (MMP-9), and nuclear factor κB (NF-κB) p65 in SGC-7901 cells was detected by Western blot.
Different concentrations of Viscum coloratum polysaccharide could inhibit the viability of SGC-7901 cells in a dose-dependent manner (P < 0.05). The results of Western blot indicted that the protein expression of CDK4, MMP-2, MMP-9, and NF-κB p65 in SGC-7901 cells treated with 100 μg/mL Viscum coloratum polysaccharide was down-regulated (P < 0.05), and Transwell assays showed that the numbers of migratory and invaded cells in the visual field were significantly decreased (P < 0.05).
Viscum coloratum polysaccharide may inhibit the proliferation, migration, and invasion of SGC-7901 cells by regulating the NF-κB signaling pathway and the expression of CDK4, MMP-2, and MMP-9 proteins.
- Citation: Xuan P, Li ZF, Zhou L, Li JB. Mechanism of Viscum coloratum polysaccharide to regulate proliferation, migration, and invasion of gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2019; 27(2): 80-86
- URL: https://www.wjgnet.com/1009-3079/full/v27/i2/80.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i2.80
胃癌(gastric cancer, GC)是严重危害人体健康的一种消化道恶性肿瘤, 其发病率和死亡率分别占世界恶性肿瘤的第5位和第3位[1]. 据我国国家癌症中心统计, 2015年约有66.7万GC新发病例, 是我国癌症患者死亡的主要原因[2]. 吸烟、高盐饮食、幽门螺杆菌感染等环境因素是GC的主要危险因素, 预防和早期诊断有助于降低GC发病率[3,4]. GC发病早期无明显症状, 多数患者就诊时已为晚期, 化疗是晚期GC患者的主要治疗方式, 但治疗效果欠佳[5]; 即使使用根治切除术, 但术后易出现远处转移、局部复发, 5年患者生存率仍难以提升[6].
中医药治疗是我国传统的疾病治疗方式, 研究认为, 传统中草药的使用能够提高GC患者机体免疫力, 延长患者生存期[7]. 槲寄生是一种具有多种生物学活性的药用植物, 其分离物中包含黄酮类、生物碱、萜类、糖类等高分子化合物, 其中生物碱、糖类被证明具有抗肿瘤、抗病毒、抗辐射、抗氧化和抗感染等作用[8,9]. 为探讨槲寄生多糖(viscum coloratum polysaccharide, VCP)在GC细胞增殖、迁移和侵袭中的作用, 本文以不同浓度VCP干预SGC-7901人GC细胞, 检测细胞增殖、迁移、侵袭和相关蛋白的表达, 以期改善GC的早期预防及治疗.
SGC-7901人GC细胞(批号: SGC-7901)购自ATCC; 槲寄生购自亳州市润元堂药业有限公司; 胎牛血清(批号: SH41288)、RPMI1640培养液(批号: SH30807)、胰蛋白酶(批号: 25200056)购自美国Gibco-BRL公司; MTT(批号: M2129)购自美国Sigma公司; BCA试剂盒(批号: PC0020)、二甲基亚砜(DMSO)(批号: D8370)、ECL发光液(批号: PE0030)、结晶紫(批号: C8470)、4%多聚甲醛(批号: P1110)、PVDF膜(批号: BSP0161)、RIPA裂解液(批号: R0020)购自北京Solarbio公司; 兔抗人周期蛋白依赖性蛋白激酶4(cyclin-dependent protein kinases 4, CDK4)多克隆抗体(批号: 11026-1-AP)、兔抗人MMP-2多克隆抗体(批号: 10373-2-AP)购自美国Proteintech公司; 兔抗人核转录因子-κB(nuclear factor kappa beta, NF-κB)p65多克隆抗体(批号: ABP51955)购自武汉艾美捷科技有限公司; 兔抗人MMP-9多克隆抗体(批号: PAB0982)、兔抗人GAPDH多克隆抗体(批号: LS-C108027)购自上海煊翎生物科技有限公司; 酶标仪购自德国AID公司; 细胞培养箱购自上海复昌科技有限公司; 荧光显微镜购自上海炳宇光学仪器有限公司.
1.2.1 VCP的提取: 参照文献[10]的方法, 取2 kg槲寄生粉末, 加入2 L95%乙醇溶解24 h后过滤, 去除脂类杂质. 滤渣风干后加入适量蒸馏水, 95 ℃浸提2 h, 重复3次. 收集滤液, 采用聚乙二醇透析浓缩, 8000 g离心5 min去除杂质, Sevag法[11]脱蛋白. 向上清液中加入无水乙醇, 调整溶液终浓度为80%, 4 ℃过夜, 3000 g离心15 min, 弃上清. 分别使用无水乙醇、丙酮、乙醚润洗3次, 冷冻干燥后得到VCP.
1.2.2 细胞培养与分组: 使用含10%胎牛血清的RPMI-1640培养液于37 ℃、5% CO2饱和湿度的细胞培养箱中培养SGC-7901细胞, 1-2 d换液一次, 每隔3-4 d传代一次. 取生长对数期的SGC-7901细胞, 胰酶消化并重悬, 调整浓度为1×106个/mL并接种至96孔板. 将细胞分为对照(Control)组和VCP处理组. 处理方法: Control组: 常规培养; VCP处理组: 培养液中加入VCP并调整其终浓度分别为20 μg/mL、40 μg/mL、60 μg/mL、80 μg/mL、100 μg/mL, 一次标记为20 μg/mL VCP组、40 μg/mL VCP组、60 μg/mL VCP组、80 μg/mL VCP组、100 μg/mL VCP组用于细胞活力检测. 后续实验中, 以含终浓度为100 μg/mL VCP的培养液培养SGC-7901细胞, 记为VCP组. 每组6个复孔, 实验重复5次.
1.2.3 MTT法检测细胞活力: Control组、20 μg/mL VCP组、40 μg/mL VCP组、60 μg/mL VCP组、80 μg/mL VCP组和100 μg/mL VCP组细胞在37 ℃、5% CO2饱和湿度条件下培养48 h, 每孔加入20 μL浓度为5 mg/mL的MTT, 继续孵育4 h; 去除多余培养基, 加入150 μL二甲基亚砜, 振荡反应10 min, 酶标仪检测490 nm处吸光度(A)值.
1.2.4 克隆形成实验: 取对数生长期的Control组和VCP组细胞, 0.25%胰蛋白酶消化后吹打成单个细胞, 悬浮于新鲜含10%胎牛血清的培养液中; 梯度稀释后接种于培养皿, 轻轻转动使细胞分散均匀, 继续培养至肉眼可见克隆形成, 吸除培养液. PBS洗涤后加入适量甲醇固定20 min, 0.2%结晶紫染色10 min, 计数≥50个细胞的克隆数. 克隆形成率(%) = (克隆数/接种细胞数)×100%;
1.2.5 Western blot: 收集Control组和VCP组细胞, 使用含蛋白酶抑制剂的RIPA细胞裂解液于冰上裂解30 min, 4 ℃, 12000 g离心15 min取上清液. BCA试剂盒测定蛋白样品浓度, 取50 μg蛋白样品进行SDS-PAGE电泳后电转至PVDF膜上, 5%脱脂奶粉封闭液液室温封闭1 h; 分别加入兔抗人CDK4多克隆抗体(1:1000)、兔抗人MMP-2多克隆抗体(1:500)、兔抗人MMP-9多克隆抗体(1:500)、兔抗人NF-κB p65多克隆抗体(1:500)、兔抗人GAPDH多克隆抗体(1:1000), 4 ℃孵育过夜; 洗膜后加入辣根过氧化物酶(HRP)标记的二抗(1:5000)室温孵育2 h, TBST洗膜3次, 每次10 min. ECL曝光显影, 实验重复3次.
1.2.6 Transwell小室检测细胞迁移和侵袭: 取Control组和VCP组细胞, 胰酶消化后用无血清培养基重悬细胞, 调整浓度为5×104个/mL, 取200 μL接种于包被和未包被基质胶的小室. 将小室放于含完全培养基的下室中常规培养24 h, 弃去多余培养基, PBS洗涤后加入4%多聚甲醛固定30 min, 0.1%结晶紫染色10 min, 显微镜观察并随机选取6个视野拍照, 计数.
统计学处理 实验数据均以mean±SD表示, 使用SPSS 19.0软件进行统计学分析, Graphpad prism 7作图. 两组间数据比较采用t检验, 多组间数据比较采用单因素方差分析, P<0.05为差异具有统计学意义.
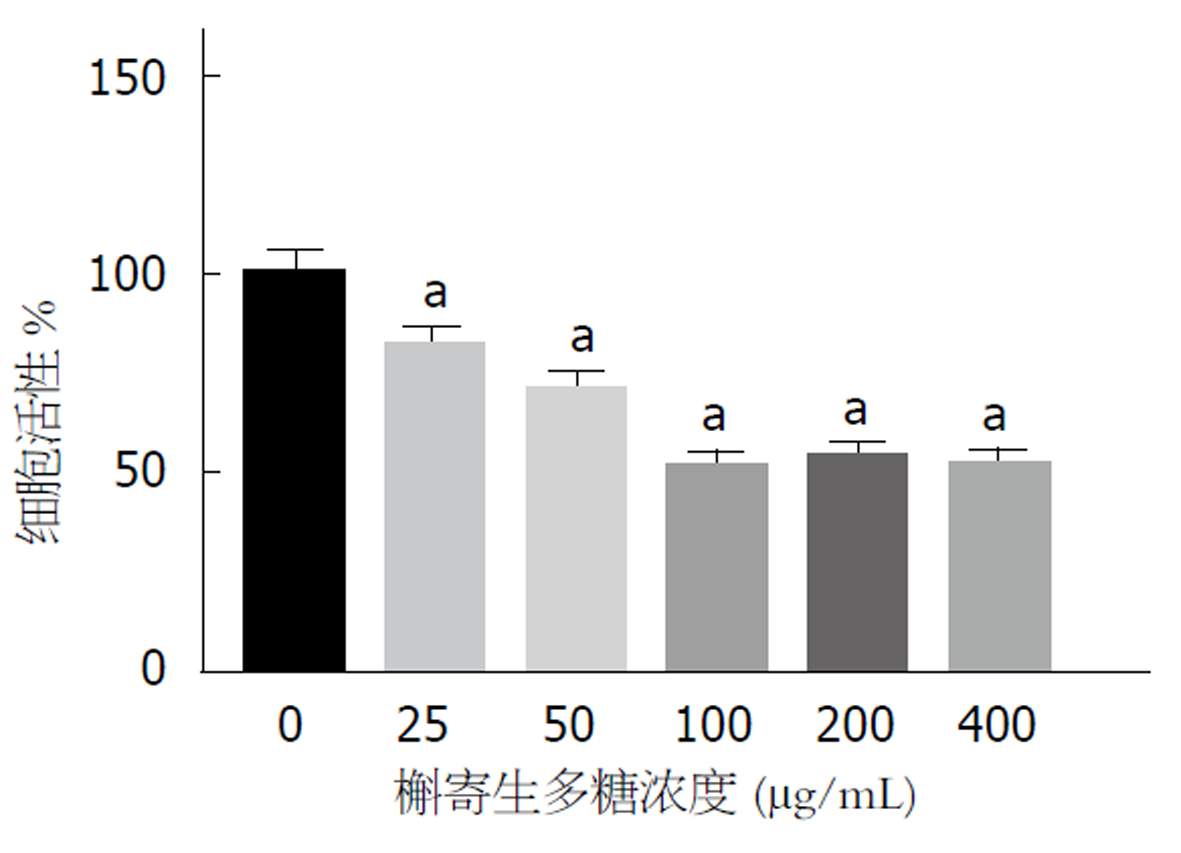
使用不同浓度VCP干预SGC-7901细胞48 h后检测细胞活力, 结果如图1所示: 对比Control组, 20 μg/mL、40 μg/mL、60 μg/mL、80 μg/mL、100 μg/mL的VCP能明显抑制SGC-7901细胞活力(P<0.05), 呈浓度依赖性. 浓度100 μg/mLVCP对SGC-7901细胞活力的抑制作用较大, 用于后续实验.
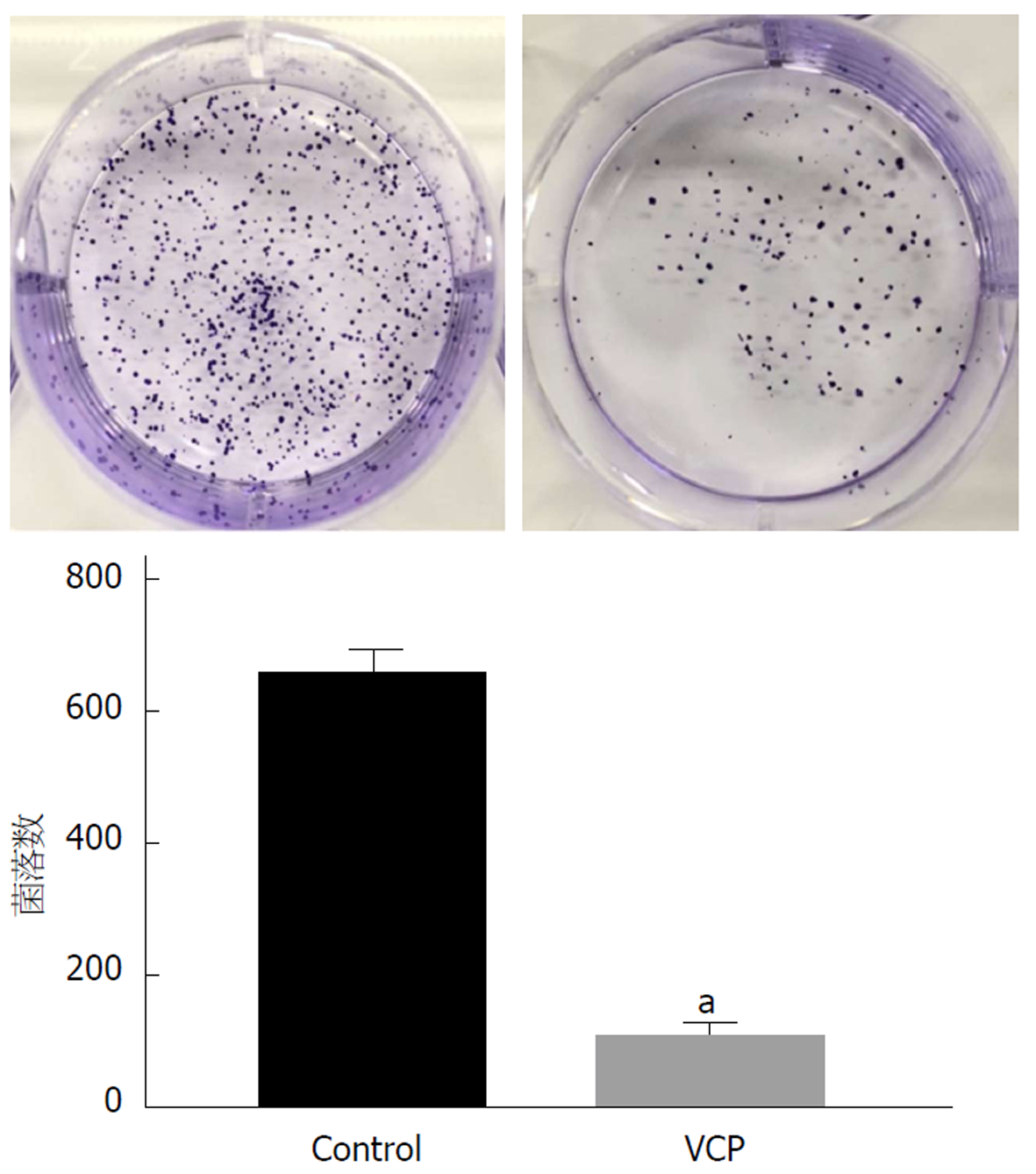
由图2可知, 经100 μg/mLVCP处理的SGC-7901细胞克隆形成数明显少于Control组(P<0.05).
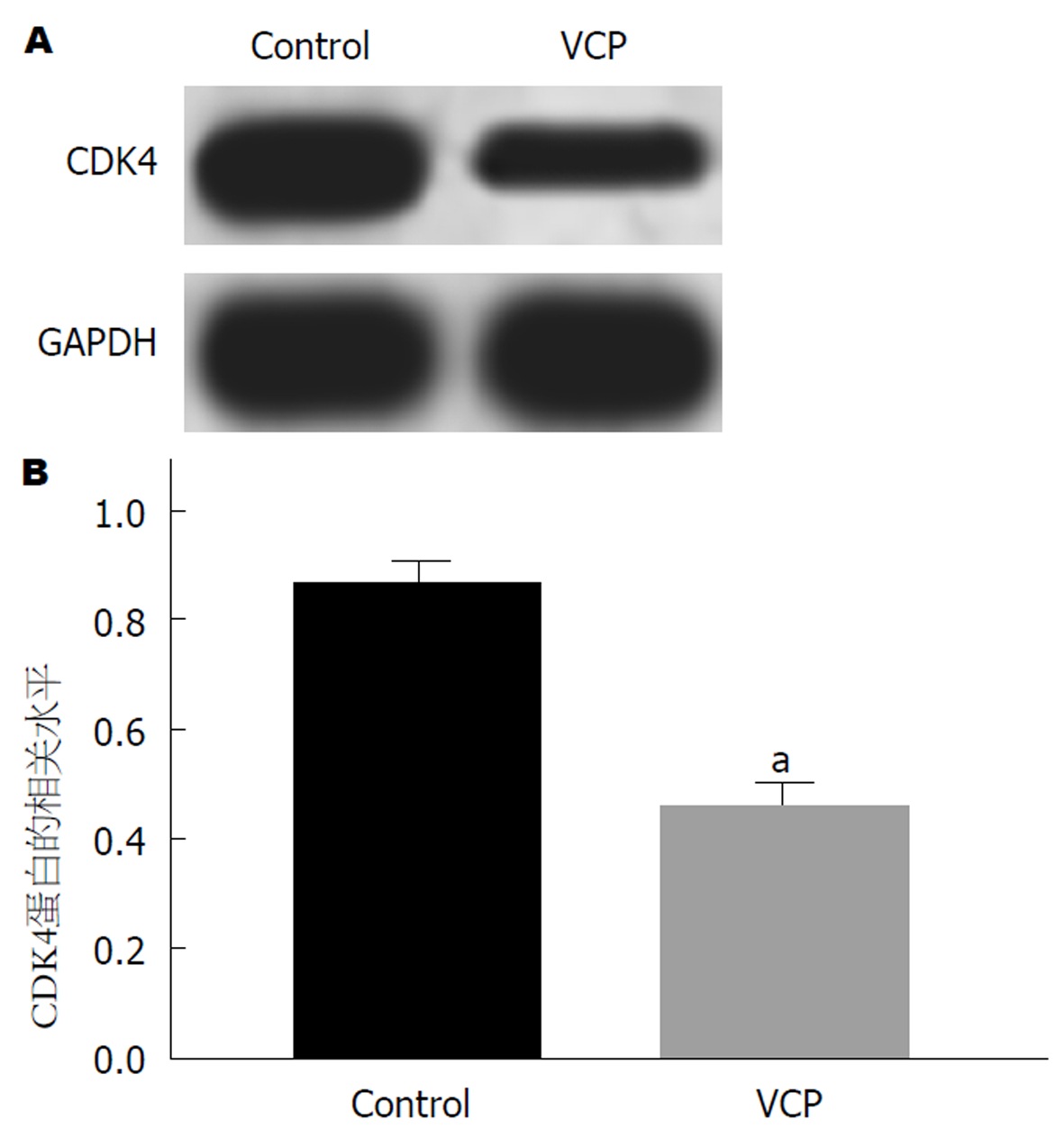
以100 μg/mLVCP干预SGC-7901细胞48 h, Western blot实验检测CDK4蛋白表达. 结果(图3)表明: 对比Control组, 100 μg/mLVCP能下调CDK4蛋白表达(P<0.05), 差异具有统计学意义.
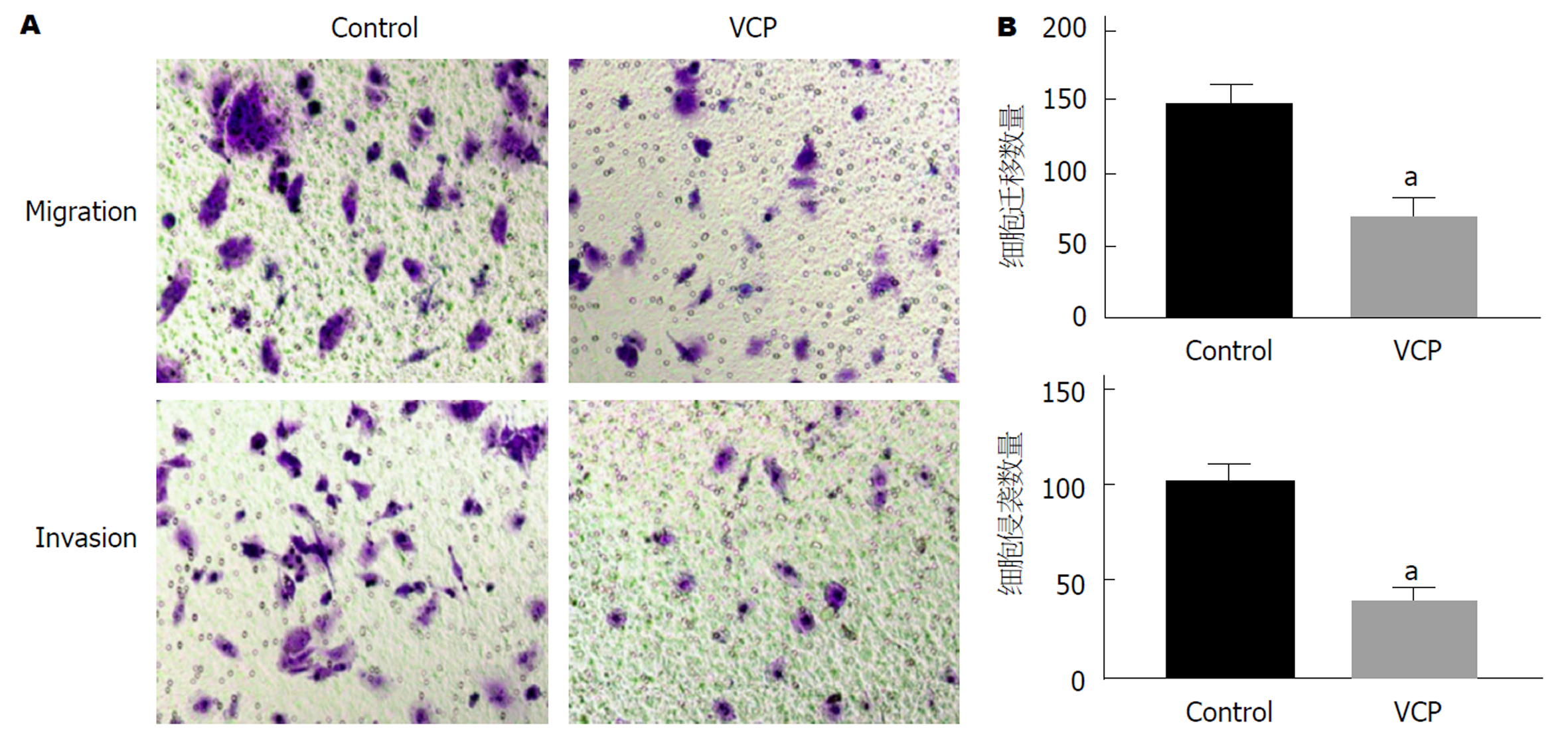
以100 μg/mL VCP干预SGC-7901细胞, 使用Transwell小室检测细胞迁移和侵袭数变化. 显微镜下观察发现, 视野内VCP组迁移和侵袭细胞数明显少于Control组(P<0.05), 差异具有统计学意义(图4).
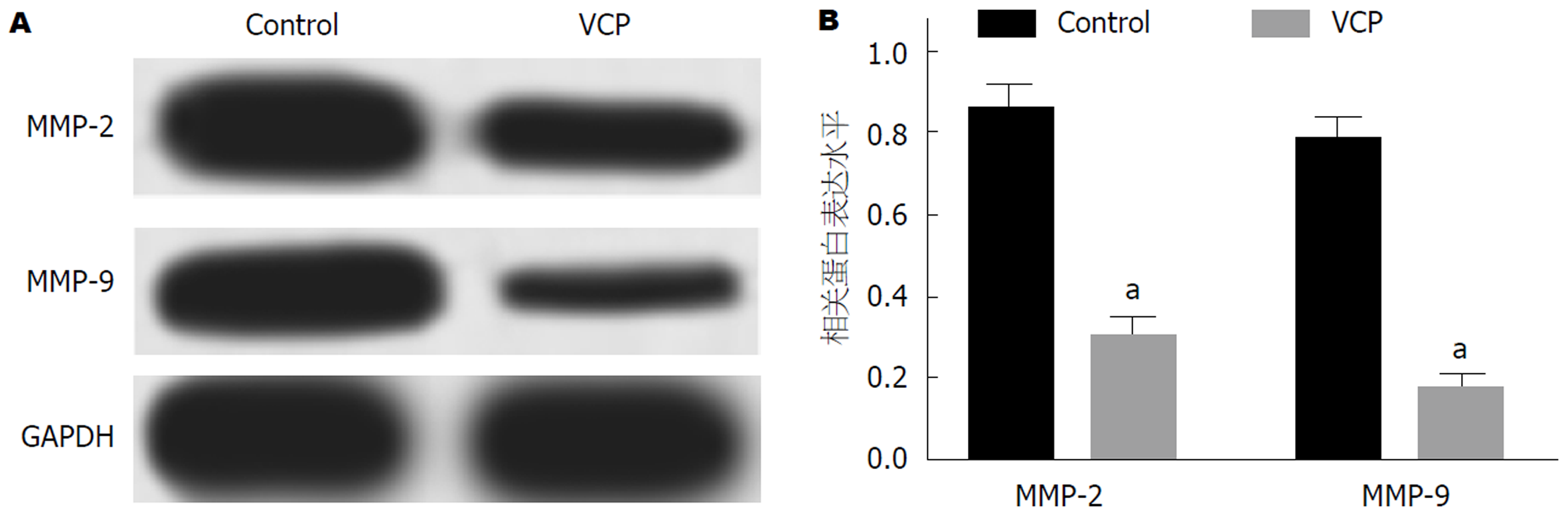
100 μg/mL VCP干预SGC-7901细胞48 h后, Western blot实验检测细胞中MMP-2和MMP-9蛋白表达. 检测结果如图5所示: VCP组细胞中MMP-2和MMP-9蛋白表达水平低于Control组(P<0.05), 差异具有统计学意义.
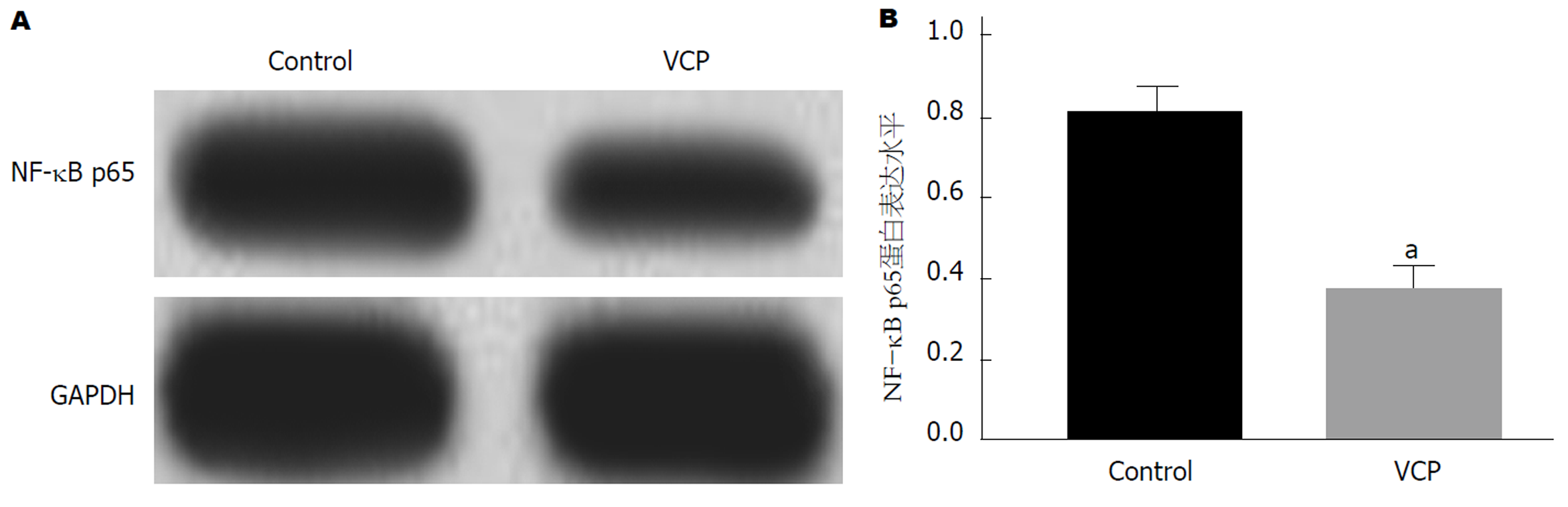
Control组和VCP组SGC-7901细胞培养48 h后, 提取各组细胞总蛋白并采用Western blot法检测蛋白样品中NF-κB p65蛋白表达. 检测结果如图6所示: 与Control组相比, VCP组细胞中NF-κB p65蛋白表达明显下调(P<0.05), 差异具有统计学意义.
GC的临床表现多为食欲不振、腹部疼痛、吞咽困难、恶心呕吐、淋巴结肿大等, 在中医范畴中属"反胃""噎膈""积聚"等, 脾虚气亏、血瘀痰阻是GC的基本病机, 应用中医药活血化痰、理气养血、补益脾胃为基本疗法[7,12]. 中药已广泛应用于肿瘤的临川治疗, 在提高肿瘤患者免疫力、减轻放化疗副作用、改善患者预后方面取得了一定的效果. 已有研究[13,14]表明, 白花蛇舌草、小柴胡汤、大黄等中药制剂在肝细胞癌的临床治疗中取得了显著的效果; 传统中草药半枝莲可抑制致癌物处理的小鼠乳腺癌癌前病变的发展, 已被用作抗肿瘤药物.
槲寄生常寄生于桦、柳、榆树、梨树、枫树等树木的分支和主干上, 其药理作用广泛, 可用于关节炎、病毒感染、脂肪肝、癌症等多种疾病的治疗[15,16]. 夏超等[17]从槲寄生中分离提取了多种生物碱, 并发现不同生物碱对乳腺癌细胞增殖均有抑制作用; 其黄酮提取物同样具有肝癌、膀胱癌等抗肿瘤活性[18]. 而VCP作为槲寄生的有效活性成分之一, 能够调节细胞免疫和体液免疫, 同时还能抑制肿瘤细胞增殖[19]. 王鹏雁等[20]研究发现, VCP通过调节肝癌细胞周期, 抑制细胞增殖, 并且促进肝癌细胞凋亡; 但其在GC中的作用尚无相关报道. 本研究中, 以不同浓度(20 μg/mL、40 μg/mL、60 μg/mL、80 μg/mL、100 μg/mL VCP, 干预SGC-7901细胞48 h并检测细胞活力, 结果发现不同浓度VCP均能抑制SGC-7901细胞活力(P<0.05), 且呈浓度依赖性. 100 μg/mL VCP干预SGC-7901细胞, 视野内迁移和侵袭细胞数减少(P<0.05).
NF-κB是细胞中重要的转录调节因子, 能与免疫球蛋白κ轻链特异性结合, 是NF-κB信号通路的核心; 细胞黏附因子、细胞趋化因子等均可刺激NF-κB从抑制状态转化为活化状态, 激活NF-κB信号通路[21]. NF-κB信号通路是重要的细胞信号传导途径, 参与细胞增殖、分化、凋亡等生物过程[22]. p65/p50二聚体是NF-κB的主要存在形式, 当细菌、病毒等因素刺激使IκB激酶复合体活化, p65/p50二聚体移位至细胞核, 从而诱导下游靶基因进行转录[23]. 毛俊[24]研究发现: 在乳腺干细胞癌变的过程中, NF-κB信号通路的激活促进了CDK4表达, 周期蛋白依赖性蛋白激酶可与cyclin结合形成复合物, 从而调节细胞周期. 此外, Lin等[25]研究发现, p65和磷酸化p105的表达水平可能与非小细胞肺癌患者预后有关. 本文研究结果表明, 100 μg/mL VCP可下调SGC-7901细胞中CDK4、MMP-2、MMP-9和NF-κB p65蛋白表达(P<0.05), 抑制细胞迁移和侵袭.
总之, VCP对SGC-7901人GC细胞增殖、迁移和侵袭有抑制作用, 其机制可能是通过NF-κB信号通路调节CDK4、MMP-2、MMP-9蛋白表达来完成; 为VCP应用于GC的早期预防及临床治疗提供实验依据.
槲寄生多糖(Viscum coloratum polysaccharide, VCP)能够调节机体免疫功能, 对肝癌细胞增殖具有抑制作用, 同时诱导细胞凋亡; 但VCP影响胃癌(gastric cancer, GC)细胞的相关研究较少.
本研究旨在研究VCP对GC细胞增殖、迁移和侵袭的影响, 并探讨其分子作用机制, 以期望为解决GC治疗过程中的问题提供线索.
探讨VCP对GC细胞增殖、迁移和侵袭能力的作用机制, 以期为GC的治疗提供新方向.
将用100 μg/mL的VCP处理的SGC-7901细胞, 用MTT法、Transwell小室分析GC细胞对VCP的治疗作用, Western blot检测GC细胞中CDK4、MMP-2、MMP-9及核转录因子κB p65蛋白表达.
本研究成功筛选出对GC细胞具有最佳作用效果的VCP浓度为100 μg/mL并发现, VCP治疗的GC细胞的增殖、迁移、侵袭能力均减弱, 同时, 失活核转录因子-κB(Nuclear factor kappa beta, NF-κB)信号通路.
VCP可抑制GC细胞的增殖、迁移和侵袭, 这与失活NF-κB信号通路有关, 可为GC的治疗提供新药.
本研究仅在体外研究VCP对GC细胞增殖、迁移和侵袭的抑制作用, 并未在动物体内研究其对GC生长转移是否具有抑制作用, 后期实验会进行该部分研究, 以更清晰的展示VCP对GC细胞的治疗价值, 也为VCP更广泛的临床应用提供更充分的理论依据.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
编辑:崔丽君 电编:张砚梁
| 1. | Tan P, Yeoh KG. Genetics and Molecular Pathogenesis of Gastric Adenocarcinoma. Gastroenterology. 2015;149:1153-1162.e3. [PubMed] [DOI] |
| 2. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 3. | Wang T, Cai H, Zheng W, Michel A, Pawlita M, Milne G, Xiang YB, Gao YT, Li HL, Rothman N, Lan Q, Shu XO, Epplein M. A Prospective Study of Urinary Prostaglandin E2 Metabolite, Helicobacter pylori Antibodies, and Gastric Cancer Risk. Clin Infect Dis. 2017;64:1380-1386. [PubMed] [DOI] |
| 4. | Lee YC, Lin JT. Screening and treating Helicobacter pylori infection for gastric cancer prevention on the population level. J Gastroenterol Hepatol. 2017;32:1160-1169. [PubMed] [DOI] |
| 5. | Harada K, Mizrak Kaya D, Shimodaira Y, Ajani JA. Global chemotherapy development for gastric cancer. Gastric Cancer. 2017;20:92-101. [PubMed] [DOI] |
| 6. | Özer İ, Bostancı EB, Ulaş M, Özoğul Y, Akoğlu M. Changing Trends in Gastric Cancer Surgery. Balkan Med J. 2017;34:10-20. [PubMed] [DOI] |
| 7. | Hung KF, Hsu CP, Chiang JH, Lin HJ, Kuo YT, Sun MF, Yen HR. Complementary Chinese herbal medicine therapy improves survival of patients with gastric cancer in Taiwan: A nationwide retrospective matched-cohort study. J Ethnopharmacol. 2017;199:168-174. [PubMed] [DOI] |
| 8. | Amer B, Juvik O J, Dupont F. Novel aminoalkaloids from European mistletoe (Viscum album, L.). Phytochem Lett. 2012;5:677-681. [DOI] |
| 13. | Ting CT, Kuo CJ, Hu HY, Lee YL, Tsai TH. Prescription frequency and patterns of Chinese herbal medicine for liver cancer patients in Taiwan: a cross-sectional analysis of the National Health Insurance Research Database. BMC Complement Altern Med. 2017;17:118. [PubMed] [DOI] |
| 14. | Cheng CS, Chen J, Tan HY, Wang N, Chen Z, Feng Y. Scutellaria baicalensis and Cancer Treatment: Recent Progress and Perspectives in Biomedical and Clinical Studies. Am J Chin Med. 2018;46:25-54. [PubMed] [DOI] |
| 15. | Nazaruk J, Orlikowski P. Phytochemical profile and therapeutic potential of Viscum album L. Nat Prod Res. 2016;30:373-385. [PubMed] [DOI] |
| 16. | Patel BP, Singh PK. Viscum articulatum Burm. f.: a review on its phytochemistry, pharmacology and traditional uses. J Pharm Pharmacol. 2018;70:159-177. [PubMed] [DOI] |
| 17. | 夏 超, 郑 马庆, 刘 媛, 陈 群英, 陈 妍, 黄 新恩, 许 潇月, 沈 波. 槲寄生抗肿瘤有效成份提取及其对乳腺癌细胞的抑制作用. 南京医科大学学报(自然科学版). 2016;36:1313-1315. [DOI] |
| 18. | Zhao YL, Wang XY, Sun LX, Fan RH, Bi KS, Yu ZG. Cytotoxic constituents of Viscum coloratum. Z Naturforsch C. 2012;67:129-134. [PubMed] [DOI] |
| 19. | Zhang Z, Wang F, Wang M, Ma L, Ye H, Zeng X. A comparative study of the neutral and acidic polysaccharides from Allium macrostemon Bunge. Carbohydr Polym. 2015;117:980-987. [PubMed] [DOI] |
| 21. | Zhang Q, Lenardo MJ, Baltimore D. 30 Years of NF-κB: A Blossoming of Relevance to Human Pathobiology. Cell. 2017;168:37-57. [PubMed] [DOI] |
| 22. | Cildir G, Low KC, Tergaonkar V. Noncanonical NF-κB Signaling in Health and Disease. Trends Mol Med. 2016;22:414-429. [PubMed] [DOI] |
| 23. | Xiang N, He M, Ishaq M, Gao Y, Song F, Guo L, Ma L, Sun G, Liu D, Guo D, Chen Y. The DEAD-Box RNA Helicase DDX3 Interacts with NF-κB Subunit p65 and Suppresses p65-Mediated Transcription. PLoS One. 2016;11:e0164471. [PubMed] [DOI] |
| 25. | Lin G, Li C, Huang C, Zhuang W, Huang Y, Xu H, Miao Q, Hu D. Co-expression of NF-κB-p65 and phosphorylated NF-κB-p105 is associated with poor prognosis in surgically resectable non-small cell lung cancer. J Cell Mol Med. 2018;22:1923-1930. [PubMed] [DOI] |