修回日期: 2019-08-13
接受日期: 2019-08-26
在线出版日期: 2019-09-08
胃癌(gastric cancer, GC)是严重危害人体健康的恶性肿瘤, 其发病率和死亡率分别占中国恶性肿瘤的第2位和第1位, 早期诊断困难, 因此, 寻找GC诊断的新标志物对于提高GC的早期发现率及改善患者预后至关重要. 目前,吞噬细胞运动蛋白1(engulfment and cell motility 1, ELMO1)基因甲基化在GC中诊断价值研究鲜有报道.
探讨ELMO1基因甲基化与GC的关系, 旨在为GC早期诊断提供新思路.
选取海南省肿瘤医院内镜中心2017-01/2018-08诊治的慢性非萎缩性胃炎20例、慢性萎缩性胃炎20例、GC37例(早期GC15例, 进展期GC22例), 胃镜检查同时收集胃液及活组织检查收集病理组织标本. 通过甲基化特异聚合酶链反应检测三组患者ELMO1基因甲基化水平, 并进行组间对比分析, 并分析ELMO1基因甲基化与GC的发生、分期及转移的关系.
ELMO1基因甲基化率在病理组织DNA中依次为慢性浅表性胃炎组0%, 慢性萎缩性胃炎20%, GC组93.3%, 差异显著(P<0.01); 在胃液DNA中依次为: 慢性浅表性胃炎组0%, 慢性萎缩性胃炎组12.3%, GC组76.7%, 差异显著(P<0.05). 癌旁组织DNA中ELMO1基因甲基化率为96.7%, 与GC组比较差异不显著(P>0.05); 早期GC与进展期GC患者胃液中ELMO1基因甲基化率分别为73.3%、80.0%, 两者组织中ELMO1基因甲基化率分别为86.7%、100%, 两者在胃液及组织中比较均无显著差异(P>0.05).
GC患者病理组织及胃液DNA中ELMO1基因启动子区均呈高甲基化状态, 并有较高的一致性, 并且在早期GC中即明显升高, ELMO1基因甲基化可作为GC早期诊断的分子靶标, 并且胃液可用于ELMO1基因甲基化检测的良好临床标本.
核心提要: 胃癌(gastric cancer, GC)组织及胃液DNA中吞噬细胞运动蛋白1(engulfment and cell motility 1, ELMO1)基因启动子区均呈高甲基化状态, 在早期GC中即明显升高, 具有较好的特异性和敏感性. ELMO1基因甲基化异化可作为GC早期诊断的分子靶标, 检测胃液DNA中ELMO1基因甲基化异化可用于GC的早期诊断.
引文著录: 宋健, 黎萍, 袁桂红, 贾真, 张荣琳, 王发宝, 钟国柄, 李依倪, 钟敦璟. ELMO1基因甲基化检测在胃癌早期诊断中的价值. 世界华人消化杂志 2019; 27(17): 1055-1061
Revised: August 13, 2019
Accepted: August 26, 2019
Published online: September 8, 2019
Gastric cancer (GC) is a malignant tumor that seriously endangers human health. Its morbidity and mortality rank second and first, respectively, among malignant tumors in China. It is difficult to diagnose early. Therefore, finding new markers for GC diagnosis is very important to improve the early detection rate and prognosis of GC. At present, there are few reports on the diagnostic value of engulfment and cell motility 1 (ELMO1) gene methylation in GC.
To explore the relationship between the methylation of ELMO1 gene and GC in order to provide new ideas for early diagnosis of this malignancy.
From January 2017 to August 2018, 20 cases of chronic superficial gastritis, 20 cases of chronic atrophic gastritis, and 37 cases of GC (15 cases of early GC and 22 cases of advanced GC) were selected. The gastric juice and biopsy were collected at the same time. Methylation-specific polymerase chain reaction was used to detect the methylation level of ELMO1 gene in the three groups, and the correlation between ELMO1 gene methylation and the occurrence, stage, and metastasis of GC was analyzed.
The methylation rate of ELMO1 gene in tissues and gastric juice of chronic superficial gastritis, chronic atrophic gastritis, and GC were 0%, 20.5%, and 93.3% (P < 0.01), and 0%, 12.3%, and 76.7% (P < 0.05), respectively. The methylation rate of ELMO1 gene in adjacent tissue DNA was 96.7%, which was not significantly different from that in the GC group (P > 0.05). The methylation rates of ELMO1 gene in gastric juice of patients with early GC and advanced GC were 73.3% and 80.0%, respectively. The methylation rates of ELMO1 gene in the two tissues were 86.7% and 100%, respectively. There was no significant difference between them in both gastric juice and tissues (P > 0.05).
The promoter region of ELMO1 gene in gastric juice DNA and pathological tissues of patients with GC is hypermethylated, which has high consistency. ELMO1 gene methylation can be used as a molecular target for early diagnosis of GC, and gastric juice can be used as a good clinical sample for detection of ELMO1 gene methylation.
- Citation: Song J, Li P, Yuan GH, Jia Z, Zhang RL, Wang FB, Zhong GB, Li YN, Zhong DJ. Value of of ELMO1 gene methylation detection in early diagnosis of gastric cancer. Shijie Huaren Xiaohua Zazhi 2019; 27(17): 1055-1061
- URL: https://www.wjgnet.com/1009-3079/full/v27/i17/1055.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i17.1055
胃癌(gastric cancer, GC)是一种消化道常见的恶性肿瘤, 其发病率在我国居第二位, 死亡率居第一位, 早期诊断困难. GC的发病机制与基因启动子甲基化等表观遗传学改变密切相关[1-3], 近几年国外有研究表明, 吞噬细胞运动蛋白1(engulfment and cell motility 1, ELMO1)基因在GC患者中呈高甲基化状态, 但能否作为GC的分子诊断靶标尚无定论[4,5]. 胃液中含有大量的胃黏膜脱落细胞及其DNA, 检测胃液中的DNA甲基化能较病理活检具有更好的敏感性[6]. 本研究对慢性浅表性胃炎、慢性萎缩性胃炎、GC患者病理组织及胃液中ELMO1基因甲基化水平进行检测, 旨在探讨ELMO1基因甲基化能否作为GC的分子诊断标记物, 为GC的早期诊断提供理论依据.
1.1.1 病例入组及取材: 本研究选取2017-01/2018-08海南省肿瘤医院内镜中心诊治的胃病患者77例, 其中男性40例, 女性37例, 年龄35-75岁, 平均年龄56.3岁±12.5岁; 所有患者在此之前均未接受放射、化学治疗及生物免疫治疗. 纳入标准: 经病理诊断为慢性浅表性胃炎、慢性萎缩性胃炎及GC患者, 前两组各20例. GC组37例, 其中早期GC15例及进展期GC22例. 胃炎的诊断标准按中华医学会消化病学分会. 中国慢性胃炎共识意见(2017年, 上海)[7], GC的诊断标准按中国临床肿瘤学会. 原发性GC诊疗指南(2017.V1)[8]. 排除患有其他系统肿瘤、其他胃肠系统疾病及其他器官衰竭等疾病的患者. 在胃镜检查过程中用集液器收集每例患者胃液10 mL置于15 mL冻存管, 同时用活检钳钳取每例患者的病理组织, 胃炎患者病理标本取胃窦、胃体各2块, GC患者取病变部位5块, 距离病变部位5 cm处2块. 胃液标本-80 ℃保存备用, 胃炎组织标本留取胃窦1块10%甲醛固定行病理检查, GC组织标本留取2块10%甲醛固定后行病理检查, 其余组织标本-80 ℃保存备用. 此研究符合医学研究伦理规范, 获海南省肿瘤医院伦理委员会批准, 所有患者知情同意并签署知情同意书. 三组患者在一般基线资料上无明显差异(P>0.05), 具有可比性(表1).
| 项目 | 非萎缩性胃炎 | 萎缩性胃炎 | 早期胃癌 | 进展期胃癌 | |
| 性别/例 | 男 | 10 | 10 | 8 | 12 |
| 女 | 10 | 10 | 7 | 10 | |
| 总计 | 20 | 20 | 15 | 22 | |
| 年龄/岁 | 范围 | 35-69 | 43-74 | 42-75 | 41-71 |
| 平均 | 55.2±13.5 | 57.7±14.7 | 56.5±13.6 | 55.7±14.6 |
1.1.2 主要仪器和试剂: PCR扩增仪(Long Gene公司MyGene MG96+型); 离心机(北京京立离心机有限公司LG16-WA型); 凝胶电泳仪(北京六一仪器厂DYY-6C型); 凝胶成像仪(Gel Ocumentuteon systern Beosens SC 805型). EZ DNA Methylation-GoldTM Kit (zymo research Catalog Nos. D5005); ZymoTaq PreMix (zymo research Catalog Nos. E2003); Quick-DNATM Universal Kit (zymo research Catalog Nos. D4068)
将各组胃液于4 ℃, 1000 g, 离心10 min, 弃掉沉渣留上清液, 将上清液再次于4 ℃, 10000 g, 离心20 min, 留取沉淀物用于DNA抽提. 各组组织样本保存在DNA保护剂中, 提取DNA. 步骤详见说明书Quick-DNATM Universal Kit (zymo research Catalog Nos. D4068). DNA纯度分析采用核酸蛋白分析仪, 采用凝胶电泳进行质量检测. 之后进行DNA亚硫酸盐修饰, 针对修饰前后的序列差异用MethPrimer软件设计甲基化与未甲基引物, 进行PCR扩增, 引物序列(表2). 本研究采用双蒸水作为空白对照. PCR反应采用ZymoTaqTM Pre Mix试剂盒, 反应体系为25μL, 反应条件为: 95 ℃, 预变性5 min, 循环体系为94 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸30 s, 共进行40个循环, 之后72 ℃延伸10 min, 4 ℃保存. PCR产物经琼脂糖凝胶电泳进行检测.
| 引物名称 | 引物序列 |
| ELMO1-M-F | 5'-AGTAGCGGTAGTCGGCGGTGTAG-3' |
| ELMO1-M-R | 5'-AATCGCAAAACAACAACGACAAA-3' |
| ELMO1-U-F | 5'-AGTAGTGGTAGTTGGTGGTGTAG-3' |
| ELMO1-U-R | 5'-AATTGCAAAACAACAATGACAAA-3' |
统计学处理 本研究数据采用SPSS 22统计学软件进行分析, 计量资料以mean±SD表示, 采用t检验; 计数资料采用卡方检验、Mann-Whitney U检验及Fisher's精确检验, P<0.05表示差异有统计学意义.
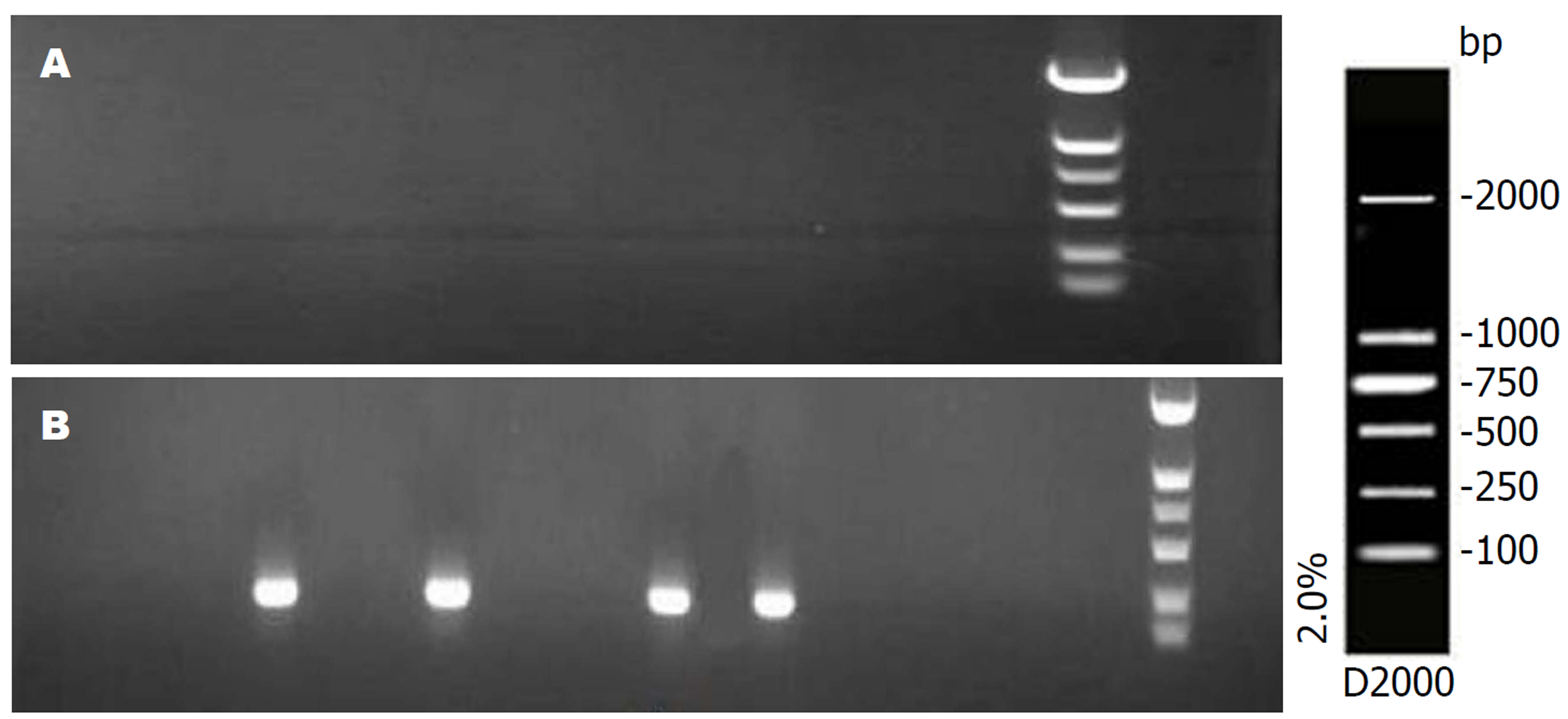
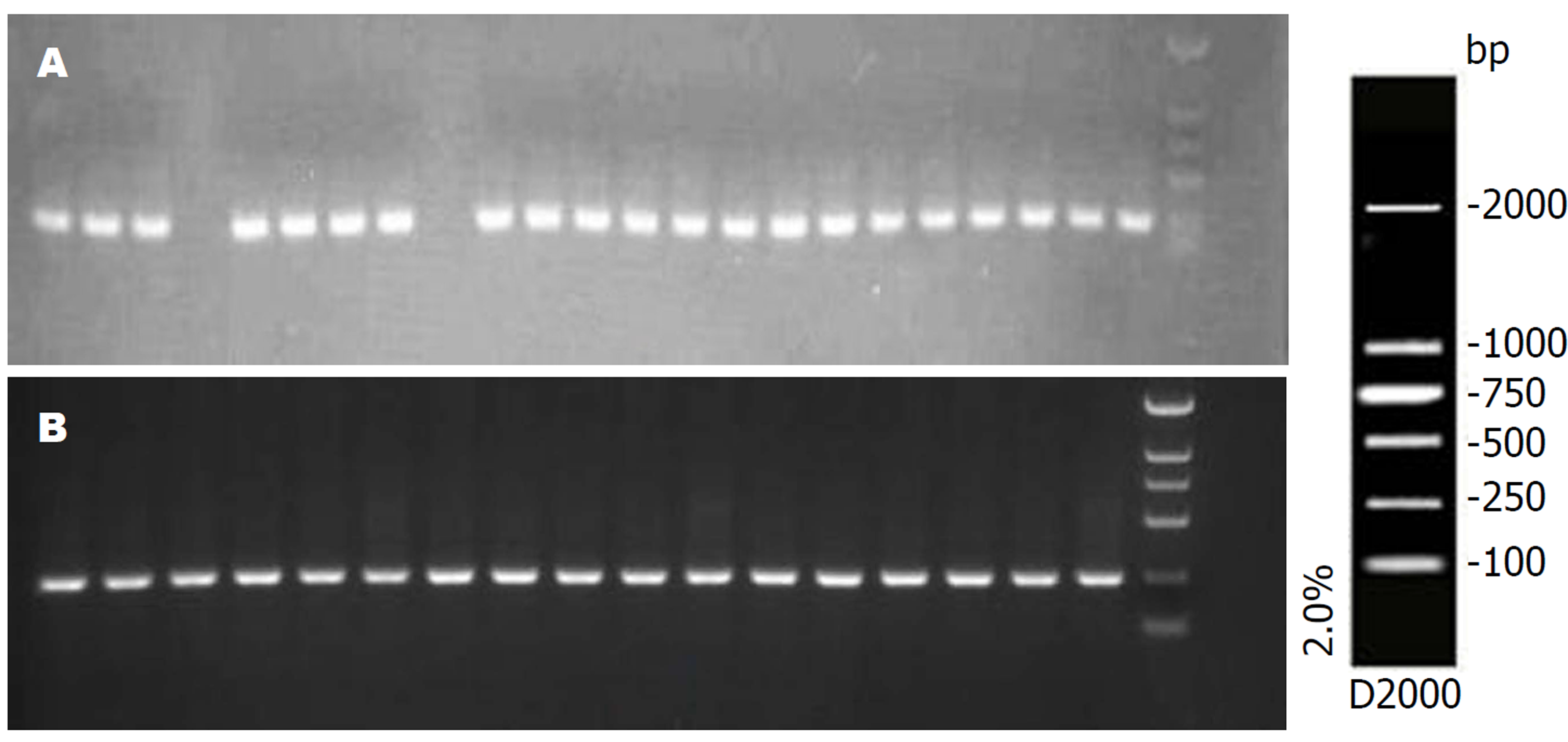
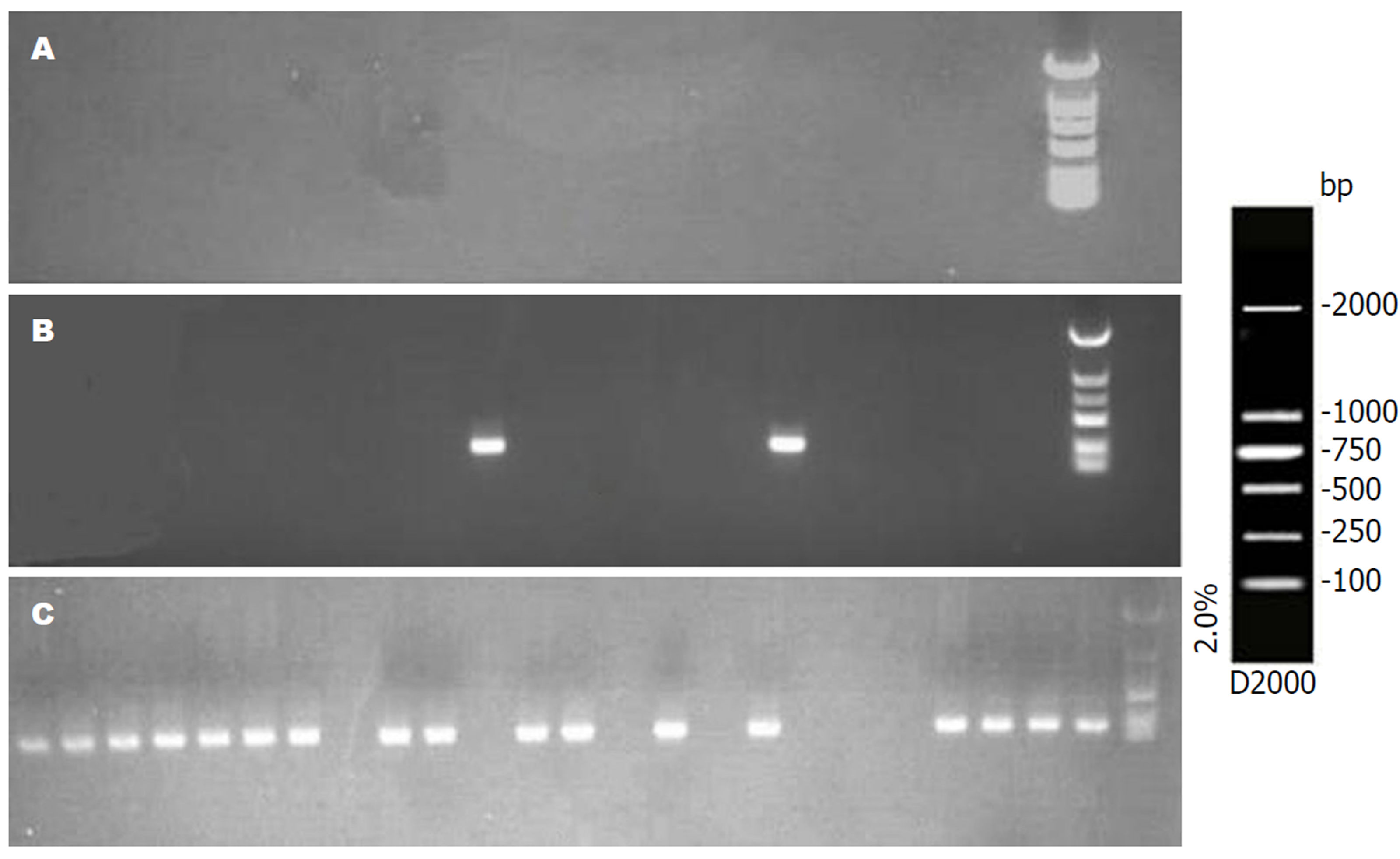
各组病理组织中ELMO1基因MSP电泳结果(图1、2). 慢性非萎缩性胃炎组、慢性萎缩性胃炎组、GC组及癌旁组织ELMO1基因甲基化率分别为0%、20%、93.3%、96.7%, 前三者两两比较差异显著(P<0.01); GC与癌旁组织DNA中无显著差异(P>0.05).
各组胃液中ELMO1基因MSP电泳结果(图3). 在胃液DNA中ELMO1基因甲基化率分别为: 慢性浅表性胃炎组0%, 慢性萎缩性胃炎组10%, GC组76.7%, 前二者比较显著差异(P<0.05), 前两者分别与GC组比较差异显著(P<0.01). 早期GC与进展期GC患者胃液ELMO1基因甲基化率分别为73.3%、80.0%, 两者比较差异不显著(P>0.05).
15例早期GC与22例进展期GC患者组织中ELMO1基因甲基化率分别为86.7%、100%, 两者无显著差异(P>0.05), 与肿瘤临床分期、大小及淋巴结转移等无明显相关性(表3).
| 临床参数 | 总数 | ELMO1 | ELMO1 | P值 | |
| 37例 | 高甲基化35例 | 非甲基化2例 | |||
| 平均年龄(岁)(范围) | 56.3 (35-75) | 57.5 (38-75) | 52.6 (36-67) | 0.895 | |
| 性别, 例(%) | 男 | 20 (54.05) | 19 (54.29) | 1 (50.0) | 0.675 |
| 女 | 17 (45.95) | 16 (45.71) | 1 (50.0) | ||
| 肿瘤分期 | 早期胃癌 | 15 (40.54) | 13 (37.14) | 2 (100.0) | 1.000 |
| 进展期胃癌 | 22 (59.45) | 22 (62.86) | 0 (0) | ||
| 肿瘤位置 | 胃窦 | 20 (54.05) | 19 (54.29) | 1 (50.0) | 0.675 |
| 胃体 | 17 (45.95) | 16 (45.71) | 1 (50.0) | ||
| 淋巴结转移 | 有 | 27 (72.97) | 27 (72.97) | 0 (0) | 1.000 |
| 无 | 10 (27.03) | 10 (27.03) | 2 (100) | ||
统计分析: Mann-Whitney U检验(年龄); Fisher's精确检验(性别, 肿瘤分期, 肿瘤大小, 淋巴结转移)
近年研究表明, 早期GC患者的5年生存率超过90%, 中晚期GC患者的5年生存率则降至20%-30%[9,10]. 早期干预对于GC患者具有重要意义, 但由于缺乏GC早期的独特临床诊断特征及指标, 早期GC的诊断率不到15%, 多数患者确诊时已处于中晚期, 大大降低了生存率, 因此, 寻找有效的早期诊断指标对于提高GC患者的生存率具有重要意义[11,12]. 目前GC的早期诊断依赖于对包括慢性胃炎黏膜萎缩、肠上皮化生及异常增生等在内的癌前病变的追踪随访. 近年来研究发现, 以DNA甲基化为代表的表观遗传学可在肿瘤的诊断及预后中具有重要作用[13,14]. ELMO1基因, 是进化上非常保守的一种序列, 主要介导细胞的吞噬、移动和形态改变. ELMO1在包括肺癌、乳腺癌、食管腺癌、卵巢癌、甲状腺癌、横纹肌肉瘤和神经胶质瘤等多种恶性肿瘤中有不同程度的异常表达, 且与肿瘤的临床分期及预后密切相关, 是与肿瘤细胞迁移相关的基因之一[15-20], 其在GC发生中的作用机制还不清楚.
GC的甲基化异化基因能否作为GC的分子诊断靶标文献报道较少, 目前还没文献报道有明确可靠的甲基化分子靶标用于GC的基因诊断. 2017年Pirini等[4]报道, 通过对胃镜活检标本进行全基因组甲基化指数(GDMI) 及联合检测IRF4, ELMO1, CLIP4 and MSC启动子区甲基化, 发现GDMI大于4及RF4, ELMO1, CLIP4 and MSC启动子区高甲基化对于GC风险的预测具有较大的价值.
胃液中含有大量的胃黏膜脱落细胞及其DNA, 易于获取, 是进行GC分子诊断的良好标本. 在我国人口众多, GC是高发肿瘤, 但现有的GC筛查方法包括血清学及胃镜检查费用较高, 且不易在人群中推广和接受, 如能在胃液中找到理想的GC诊断分子靶标, 通过胃管法获取胃液进行GC分子靶标的检测, 对于人群GC的筛查具有更好的接受度和社会经济效益比. 2016年Yamamoto等[6]报道, 通过对GC患者组织及胃液DNA中BARHL2基因甲基化研究发现: BARHL2基因甲基化异化在GC患者中敏感性达到90%, 特异性达到100%, 但未见后续研究报道. 我们也进行了该基因的类同研究, 但结果是BARHL2基因在GC、癌旁及慢性胃炎中均呈高甲基化状态, 没有特异性, 不能作为GC的分子诊断靶标.
本文研究了ELMO1基因在慢性非萎缩性胃炎、慢性萎缩性胃炎及GC和癌旁组织及相应胃液中该基因甲基化情况, 及其与GC患者肿瘤分期、淋巴结转移及预后的关系. 研究结果表明: GC患者病理组织及胃液DNA中ELMO1基因启动子区均呈高甲基化状态, 并有较高的一致性, 并且在早期GC中即明显升高, 在慢性非萎缩性胃炎患者中无甲基化发生, 在慢性萎缩性胃炎患者中有少量甲基化发生, 在GC患者中ELMO1几乎均发生甲基化, 提示ELMO1基因甲基化可作为GC的分子诊断靶标. 我们的研究结果表明在早癌GC患者胃液中进行ELMO1基因甲基化检测具有较高的敏感性和特异性, 可作为早期GC的诊断方法. ELMO1在萎缩性胃炎的患者中也有20%的甲基化率, 提示该基因甲基化对GC的发生有一定的预警作用. GC患者ELMO1基因启动子区甲基化与性别、临床病理分期、肿瘤部位及淋巴结转移等无明显相关性. 另外癌旁组织中ELMO1基因同样发生高甲基化, 并与癌组织基本一致, 其发生机制尚不明确, 需要进一步研究.
综上所述, ELMO1基因启动子区甲基化在GC组织中具有很高的发生率, 并且在早癌GC中既可发生, 可作为GC早期诊断的分子靶标. 在胃液中检测ELMO1基因甲基化可用于GC的早期诊断; 在胃镜检查的同时留取胃液检测ELMO1甲基化的改变有助于提高GC的诊断率及预测GC的发生风险. 同时, 可通过胃管法留取胃液进行GC的无症状人群筛查, 避免胃镜检查的痛苦及提高经济社会效益. ELMO1基因启动子区CpG岛也可作为GC治疗的一个潜在药物靶点, 为GC的早期诊断和治疗提供新的思路与理论依据.
胃癌(gastric cancer, GC)是我国发病率和死亡率分别位于第二位和第一位的恶性肿瘤, GC的预后与诊断时的疾病阶段密切相关. 在早期发现时, GC通常是可治愈的, 5年生存率大于90%, 而晚期GC的预后很差, 5年生存率仅为20-30%. 早期GC被定义为癌组织局限于胃黏膜或黏膜下层(不论有无淋巴结转移), 由于没有特异性症状, 仅有不到20%的GC被诊断为早期GC. 胃镜是目前GC早期诊断的金标准, 但由于我国人口众多、胃镜检查接受度差及内镜医师缺乏等, 不能作为GC早筛、早诊的手段. 近年来肿瘤基因甲基化的研究为肿瘤早期诊断带来了曙光, 部分肿瘤的甲基化基因诊断已进入临床应用, 并取得了较好的经济社会效益. 近年有文献报道吞噬细胞运动蛋白1(engulfment and cell motility 1, ELMO1)基因在GC患者中呈高甲基化状态, 但能否作为GC的分子诊断靶标尚无定论. 本文对慢性浅表性胃炎、慢性萎缩性胃炎、GC患者病理组织及胃液中ELMO1基因甲基化水平进行研究, 旨在探讨ELMO1基因甲基化能否作为GC的分子诊断标记物以及胃液能否用于检测标本.
本文研究的主题是ELMO1基因在慢性浅表性胃炎、慢性萎缩性胃炎、GC组织及胃液DNA中甲基化异化情况. 拟解决的关键问题是ELMO1基因甲基化异化是否具有GC特异性和敏感性, 在胃液DNA中可否检测到ELMO1基因甲基化异化, 以及其能否作为GC的分子诊断靶标. 问题的解决将为GC的早期诊断提供一种新的方法.
本研究的主要目标是ELMO1基因甲基化异化是否具有GC特异性和敏感性, 对于早期GC是否具有诊断价值, 以及胃液可否用于ELMO1基因甲基化异化的诊断标本. 如实验达成这三个目标, 将为早期GC的分子靶标诊断研究及临床应用奠定基础.
以慢性非萎缩性胃炎、慢性萎缩性胃炎、GC患者(包括早期GC及进展期GC)为研究对象, 胃镜检查同时收集胃液及组织标本. 通过甲基化特异聚合酶链反应(MSP)检测三组患者组织及胃液DNA中ELMO1基因甲基化水平, 并进行组间对比分析, 并分析ELMO1基因甲基化异化与GC的发生、分期及转移的关系等.
本实验的结果是ELMO1基因甲基化率在慢性浅表性胃炎、慢性萎缩性胃炎及GC组分别为0%、20%、93.3%, 差异显著(P<0.01); 在胃液DNA中依次为: 0%、12.3%、76.7%, 差异显著(P<0.05). 癌旁组织DNA中ELMO1基因甲基化率为96.7%, 与GC组比较差异不显著(P>0.05); 早期GC与进展期GC患者组织中ELMO1基因甲基化率分别为86.7%、100%, 两者胃液中ELMO1基因甲基化率在分别为73.3%、80.0%, 两者在胃液及组织中比较均无显著差异(P>0.05). ELMO1基因甲基化异化与GC的临床分期、大小及淋巴结转移等无明显相关性. 本实验达成了实验目标, ELMO1基因甲基化异化在GC患者组织及胃液DNA中具有较高的特异性和敏感性, 为早期GC的分子靶标诊断研究及临床应用奠定了基础.
GC ELMO1基因启动子区甲基化异化具有特异性, 在GC组织及胃液中检测其甲基化异化具有敏感性, 并且在早期GC中也具有较高敏感性, ELMO1基因甲基化可作为GC早期诊断的分子靶标, 并且胃液可作为ELMO1基因甲基化检测的良好标本. 本研究为GC的分子靶标诊断及临床应用进行了探索, 为以后GC甲基化分子靶标在粪便及血液等标本的检测研究奠定了基础.
本研究入组实验样本数偏少, 需要进一步扩大样本量验证实验结果, 需要更进一步细化研究, 如慢性萎缩性胃炎中不典型增生或肠上皮化生与早期GC的差异, 为临床提供更科学的数据支撑. 下一步将扩大样本量研究, 并进一步研究血液及粪便中该基因甲基化异化情况, 并建立该基因甲基化高通量定量检测方法, 为临床应用奠定基础.
学科分类: 胃肠病学和肝病学
手稿来源地: 海南省
同行评议报告分类
A级 (优秀): A
B级 (非常好): B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑:王禹乔 电编:刘继红
| 2. | Sapari NS, Loh M, Vaithilingam A, Soong R. Clinical potential of DNA methylation in gastric cancer: a meta-analysis. PLoS One. 2012;7:e36275. [PubMed] [DOI] |
| 4. | Pirini F, Noazin S, Jahuira-Arias MH, Rodriguez-Torres S, Friess L, Michailidi C, Cok J, Combe J, Vargas G, Prado W, Soudry E, Pérez J, Yudin T, Mancinelli A, Unger H, Ili-Gangas C, Brebi-Mieville P, Berg DE, Hayashi M, Sidransky D, Gilman RH, Guerrero-Preston R. Early detection of gastric cancer using global, genome-wide and IRF4, ELMO1, CLIP4 and MSC DNA methylation in endoscopic biopsies. Oncotarget. 2017;8:38501-38516. [PubMed] [DOI] |
| 5. | Anderson BW, Suh YS, Choi B, Lee HJ, Yab TC, Taylor WR, Dukek BA, Berger CK, Cao X, Foote PH, Devens ME, Boardman LA, Kisiel JB, Mahoney DW, Slettedahl SW, Allawi HT, Lidgard GP, Smyrk TC, Yang HK, Ahlquist DA. Detection of Gastric Cancer with Novel Methylated DNA Markers: Discovery, Tissue Validation, and Pilot Testing in Plasma. Clin Cancer Res. 2018;24:5724-5734. [PubMed] [DOI] |
| 6. | Yamamoto H, Watanabe Y, Oikawa R, Morita R, Yoshida Y, Maehata T, Yasuda H, Itoh F. BARHL2 Methylation Using Gastric Wash DNA or Gastric Juice Exosomal DNA is a Useful Marker For Early Detection of Gastric Cancer in an H. pylori-Independent Manner. Clin Transl Gastroenterol. 2016;7:e184. [PubMed] [DOI] |
| 12. | Ding Y, Yang Q, Wang B, Ye G, Tong X. The Correlation of MGMT Promoter Methylation and Clinicopathological Features in Gastric Cancer: A Systematic Review and Meta-Analysis. PLoS One. 2016;11:e0165509. [PubMed] [DOI] |
| 13. | 高 哈尔, 张 阳, 周 静, 李 哲轩, 马 峻岭, 刘 卫东, 邓 大君, 游 伟程, 潘 凯枫. p16基因甲基化与胃黏膜异型增生恶性转化的关系. 中华肿瘤防治杂志. 2017;24:431-436. [DOI] |
| 14. | 王 崇宇. RUNX3与CHFR基因甲基化提示胃癌癌前病变的研究. 基因组学与应用生物学. 2017;36:1301-1306. [DOI] |
| 15. | Jarzynka MJ, Hu B, Hui KM, Bar-Joseph I, Gu W, Hirose T, Haney LB, Ravichandran KS, Nishikawa R, Cheng SY. ELMO1 and Dock180, a bipartite Rac1 guanine nucleotide exchange factor, promote human glioma cell invasion. Cancer Res. 2007;67:7203-7211. [PubMed] [DOI] |
| 16. | Kristensen LS, Søes S, Hansen LL. ELMO3: a direct driver of cancer metastasis? Cell Cycle. 2014;13:2483-2484. [PubMed] [DOI] |
| 17. | Søes S, Daugaard IL, Sørensen BS, Carus A, Mattheisen M, Alsner J, Overgaard J, Hager H, Hansen LL, Kristensen LS. Hypomethylation and increased expression of the putative oncogene ELMO3 are associated with lung cancer development and metastases formation. Oncoscience. 2014;1:367-374. [PubMed] [DOI] |
| 18. | Li H, Yang L, Fu H, Yan J, Wang Y, Guo H, Hao X, Xu X, Jin T, Zhang N. Association between Gαi2 and ELMO1/Dock180 connects chemokine signalling with Rac activation and metastasis. Nat Commun. 2013;4:1706. [PubMed] [DOI] |
| 19. | Abu-Thuraia A, Gauthier R, Chidiac R, Fukui Y, Screaton RA, Gratton JP, Côté JF. Axl phosphorylates Elmo scaffold proteins to promote Rac activation and cell invasion. Mol Cell Biol. 2015;35:76-87. [PubMed] [DOI] |
| 20. | Peng HY, Yu QF, Shen W, Guo CM, Li Z, Zhou XY, Zhou NJ, Min WP, Gao D. Knockdown of ELMO3 Suppresses Growth, Invasion and Metastasis of Colorectal Cancer. Int J Mol Sci. 2016;17. [PubMed] [DOI] |