修回日期: 2019-06-19
接受日期: 2019-06-25
在线出版日期: 2019-07-08
肝纤维化与肝星状细胞(hepatic stellate cells, HSCs)上皮细胞间充质转化(epithelial mesenchymal transformation, EMT)相关, TGF-β1在其中起着重要的作用, 而BMP7能够拮抗TGF-β1, 目前主要研究的是TGF-β/BMPs-Smad信号通路, ALK3属于BMPs的持续活化Ⅰ型受体, 在肝纤维化分子研究机制中较少运用.
观察大鼠HSCs中稳定表达持续活化型ALK3时Smad1磷酸化及纤维化相关基因E-cadherin、α-SMA、col1A2等表达情况, 探讨BMP-7信号转导在肝纤维化发生发展过程中拮抗TGF-β1信号及其抗肝纤维化机制.
建立体外培养大鼠HSCs (HSC-T6)持续活化型ALK3的稳定表达细胞株, MTT检测细胞的增殖; RT-PCR检测col1A2等相关分子mRNA水平; Western blotting检测Samd1、E-cadherin、α-SMA、col1A2蛋白表达和Smad1磷酸化; 显微镜下观察细胞形态.
稳定表达持续活化型ALK3的HSC-T6细胞增殖受到抑制, Smad1磷酸化显著升高, α-SMA, col1A2表达下调, E-cadherin表达上调.
BMP-7信号转导通过增强Samd1的磷酸化而拮抗TGF-β1致纤维化作用,抑制大鼠HSCs的活化.
核心提要: 利用BMP-7Ⅰ型受体的持续性活化突变基因真核表达载体, 建立稳定高表达持续活化型BMP-7Ⅰ型受体ALK3细胞株. 无需BMP-7刺激, 持续活化型ALK3即可激活下游信号通路, 证实BMP-7信号转导通过增强Samd1的磷酸化而拮抗TGF-β1致纤维化作用, 抑制大鼠肝星状细胞的活化, 从而逆转肝纤维化,解决临床上肝硬化难以逆转的问题, 挽救早期肝硬化患者.
引文著录: 石慧, 柳长柏, 肖和杰. 表达持续活化型ALK3抑制大鼠肝星状细胞活化. 世界华人消化杂志 2019; 27(13): 807-813
Revised: June 19, 2019
Accepted: June 25, 2019
Published online: July 8, 2019
Hepatic fibrosis is related to activation of hepatic stellate cells (HSCs) and epithelial mesenchymal transformation (EMT), in which transforming growth factor-β1 (TGF-β1) plays a pivotal role, but bone morphogenetic protein-7 (BMP7) can antagonize TGF-β1. Currently, the TGF-β/BMPs-Smad signaling pathway is a hot topic of research in this field. ALK3 belongs to the constitutively activated type Ⅰ receptor of BMPs, and its role in the molecular mechanism of hepatic fibrosis is rarely studied.
To detect the expression of Samd1, P-Smad1, and fibrosis-related genes E-cadherin, α-SMA, and col1A2 in cultured rat HSCs (HSC-T6) to investigate how BMP-7 antagonizes TGF-β1 in the development of liver fibrosis and its anti-hepatic fibrosis mechanisms.
After HSCs-T6 were transfected with constitutively active cDNA construct expressing ALK3, RT-PCR method was used to screen the cell line with stable ALK3 expression and detect the mRNA level of col1A2. MTT assay was used to examine the proliferation of HSC-T6 cells with high expression of ALK3. Western blot method was used to detect the expression of Smad1, P-Smad1, E-cadherin, α-SMA, and co1lA2. Optic microscopy was used to detect the morphological changes of HSC-T6 cells with high expression of ALK3.
Compared with control cells, ALK3 high expression restrained the growth of HSC-T6 cells, suppressed the expression of α-SMA and col1A2, promoted the expression of P-Smad1 and E-cadherin, but had no significant effect on Samd1.
BMP-7 competitively antagonizes TGF-β1 induced fibrosis by enhancing the phosphorylation of Samd1.
- Citation: Shi H, Liu CB, Xiao HJ. Stable expression of constitutively activated ALK3 suppresses rat hepatic stellate cell activation. Shijie Huaren Xiaohua Zazhi 2019; 27(13): 807-813
- URL: https://www.wjgnet.com/1009-3079/full/v27/i13/807.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i13.807
在肝纤维化发生发展过程中由于慢性炎症刺激肝星状细胞(hepatic stellate cells, HSCs)被活化, 由静止的储脂细胞转变成肌成纤维细胞(myofibroblast, MFB)并合成分泌大量纤维化相关因子和胶原蛋白[1]. TGF-β1在肝纤维化病理发展过程中发挥着极其重要的作用, BMP-7是TGF-β超家族成员之一, 许多研究表明BMP-7能够拮抗TGF-β的促纤维化作用, 在肝纤维化进展过程中, BMP-7表达水平被逐渐下调[2].
ALK3属于BMPs的持续活化Ⅰ型受体, 无需BMP-7与BMP-7Ⅱ受体结合, 磷酸化细胞内相关信号蛋白Smad1/5/8, 磷酸化Smad1/5/8进而结合Smad4转移至细胞核并诱导下游靶基因表达.本实验利用BMP-7Ⅰ型受体的持续性活化突变基因真核表达载体pcDNA3-HASL-ALK3(QD)转染大鼠HSCs株(HSC-T6), 建立稳定高表达持续活化型BMP-7Ⅰ型受体ALK3细胞株.无需BMP-7刺激, 持续活化型ALK3即可激活下游信号通路, 探讨持续活化型ALK3对HSC-T6的影响, 探讨活化BMP-7信号通路抗肝纤维化分子机制.
大鼠HSCs、DH5α大肠杆菌为三峡大学肝病研究所保存; 真核表达载体pcDNA3 -HASL-ALK3(QD)质粒由日本东京大学宫园浩平教授惠赠; 限制性核酸内切酶、Taq DNA聚合酶、dNTP、RevertAidTM M-MuLV逆转录试剂盒购自美国Fermentas公司; DNA纯化试剂盒为QIAGEN公司产品; LipofectamineTM 2000和Trizol试剂为美国Invitrogen公司产品; 小鼠Samd1单克隆抗体、兔抗山羊P-Smad1多克隆抗体、山羊抗兔E-cadherin多克隆抗体、兔抗山羊col1A2多克隆抗体均为 Santa Cruz Biotechnology公司产品; 小鼠α-SMA单克隆抗体为Sigma公司产品; 辣根过氧化物酶标记兔抗山羊、山羊抗兔、羊抗小鼠IgG购自北京中杉金桥公司; ECL化学发光检测试剂为GE Healthcare公司产品, MTT及培养基DMEM购自美国Sigma公司; 寡聚核苷酸引物由上海生工技术服务有限公司合成.
1.2.1 细胞培养及传代: 本实验所用的细胞株大鼠HSCsHSC-T6置于含10%小牛血清及1%青霉素/链霉素的培养液DMEM, 37 ℃ 5% CO2培养箱中培养. 细胞传代方法: 弃去旧的培养液, 用3 mL PBS洗2次后, 每瓶500 μL1%胰蛋白酶消化细胞1 min; 用3 mL细胞完全培养液终止消化并将细胞悬液转入15 mL离心管中, 800 rpm离心3 min, 弃上清液; 细胞用培养液重悬后, 以1:3的比例传代.
1.2.2 重组质粒鉴定: 用重组质粒pcDNA3-HASL-ALK3转化E.coli DH5α感受态细胞, 用含0.1 g/L氨苄青霉素的琼脂糖培养平板进行筛选, 挑取阳性单克隆菌落扩增培养, 提取质粒并用EcoRI/XhoI进行双酶切鉴定. 酶切鉴定正确的质粒纯化后送上海生工生物工程有限公司测序. 测序结果用DNAMAN与GenBank序列比对无误.
1.2.3 建立稳定高表达持续活化型ALK3受体的HSC-T6细胞株: 大鼠HSC-T6在转染前1 d传代, 长至细胞融合约80%, 转染前1 h换为无血清无双抗的DMEM培养液孵育.应用LipofectamineTM 2000试剂法用纯化的重组质粒pcDNA3-HASL-ALK3转染HSC-T6细胞, 同时转染空载质粒pcDNA3.1作为对照. 37 ℃ 5% CO2培养箱孵育4-6 h后更换为DMEM完全培养液培养, 培养24 h后换为浓度800 μg/mL Neomycin的完全培养液进行筛选, 2-3 d更换一次培养液, 待细胞克隆形成后, 挑取单克隆细胞进行扩大培养.
1.2.4 RT-PCR法筛选稳定表达持续活化型ALK3的HSC-T6细胞株: 分别收集稳定转染重组质粒pcDNA3-HASL-ALK3及空载质粒pcDNA3.1的HSC-T6细胞, 提取细胞总RNA, 经DU730紫外分光光度仪检测在260 nm处的吸光度值, A260nm/A280nm比值均介于1.8-2.0之间, RNA琼脂糖凝胶电泳28 S、18 S和5 S条带清晰可见, 表明抽提的RNA较完整, 未见明显降解.提取的总RNA经逆转录合成cDNA第一链, 并以合成的cDNA为模板进行PCR反应. col1A2上游引物: 5'-TGGTCTTACTGGGAACTTTG-3', 下游引物: 5'-CCGTTTGTCCGGGCTCACCA-3'; col3A1上游引物: 5'-GTTCTGTAATATGGAAACCGGAG-3', 下游引物: 5'-CAAGGACATCTTCAGGAAGATC-3', col4A2上游引物: 5'-CTGGACCCAAAGGACAACC-3', 下游引物: 5'-ACGGGTCCAGGGTCTCCT-3'; E-cadherin上游引物: 5'-CTCGTGGCTTTGTCAGCA-3', 下游引物: 5'-GACCCAGTCTCGTTTCTG-3', α-SMA上游引物: 5'-GTGTGAAGAGGAAGACAG-3'下游引物: 5'-TTGGCCTTAGGGTTCAGC-3', 以GAPDH为内参照, 上游引物: 5'-TGGCACCCAGCACAATGAA-3', 下游引物: 5'-CTAAGTCATAGTCCGCCTAGAAGCA-3', PCR循环条件: 94 ℃ 5 min, 94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 30 s, 30个循环后, 72 ℃ 5 min结束扩增. PCR产物于1%琼脂糖凝胶电泳鉴定并在凝胶扫描仪下观察记录结果. 获得稳定高表达持续活化型ALK3的细胞株命名为CA-ALK3-T6, 稳定转染空载体质粒细胞株命名为Vector-T6.
1.2.5 Western blotting法检测稳定表达持续活化型ALK3对HSC-T6细胞的影响: 收集并裂解细胞提取总蛋白, 用BCA试剂盒蛋白定量后进行SDS-PAGE分离蛋白, 采用湿转法将蛋白质转移至PVDF膜上, 1%脱脂奶粉封闭过夜后, 分别用小鼠Samd1单克隆抗体(1:800稀释)、兔抗山羊P-Smad1多克隆抗体(1:800稀释)、山羊抗兔E-cadherin多克隆抗体(1:1000稀释)、兔抗山羊col1A2多克隆抗体(1:800稀释); 小鼠α-SMA单克隆抗体(1:1000稀释)和小鼠抗大鼠β-actin单克隆抗体(1:4000稀释)孵育2 h, TBST洗膜10 min/次3次, 再分别用辣根过氧化物酶(HRP)标记的山羊抗兔IgG(1:4000稀释), 兔抗山羊IgG(1:8000稀释)和羊抗小鼠IgG(1:5000稀释)孵育1 h, TBST洗膜3次(10 min/次), 采用ECL增强化学发光法检测结果.
1.2.6 MTT法检测稳定表达持续活化型ALK3对HSC-T6细胞株增殖的影响: 以2×104个/ml的细胞密度, 接种于96孔板中, 100 μL/孔; 待细胞完全贴壁后, 加入MTT(200 μg/mL, 无血清DMEM培养基配制), 37 ℃继续孵育4 h, 去除培养基后每孔加入150 μL的DMSO, 室温摇床振荡充分溶解结晶, 全自动酶标仪570 nm波长测定各孔吸光度(OD)值, 并以此检测时间点为0 h. 用同样的方法测定细胞培养24、48、72 h各时间点的OD值, 以各时间点的OD值与0 h OD值的比值反映细胞增殖的速度.
统计学处理 应用SPSS 13.0进行分析, 数据以mean±SD表示, 样本均数比较采用t检验, 同一药物不同浓度组间采用单因素方差分析进行比较, P<0.05为差异有统计学意义.
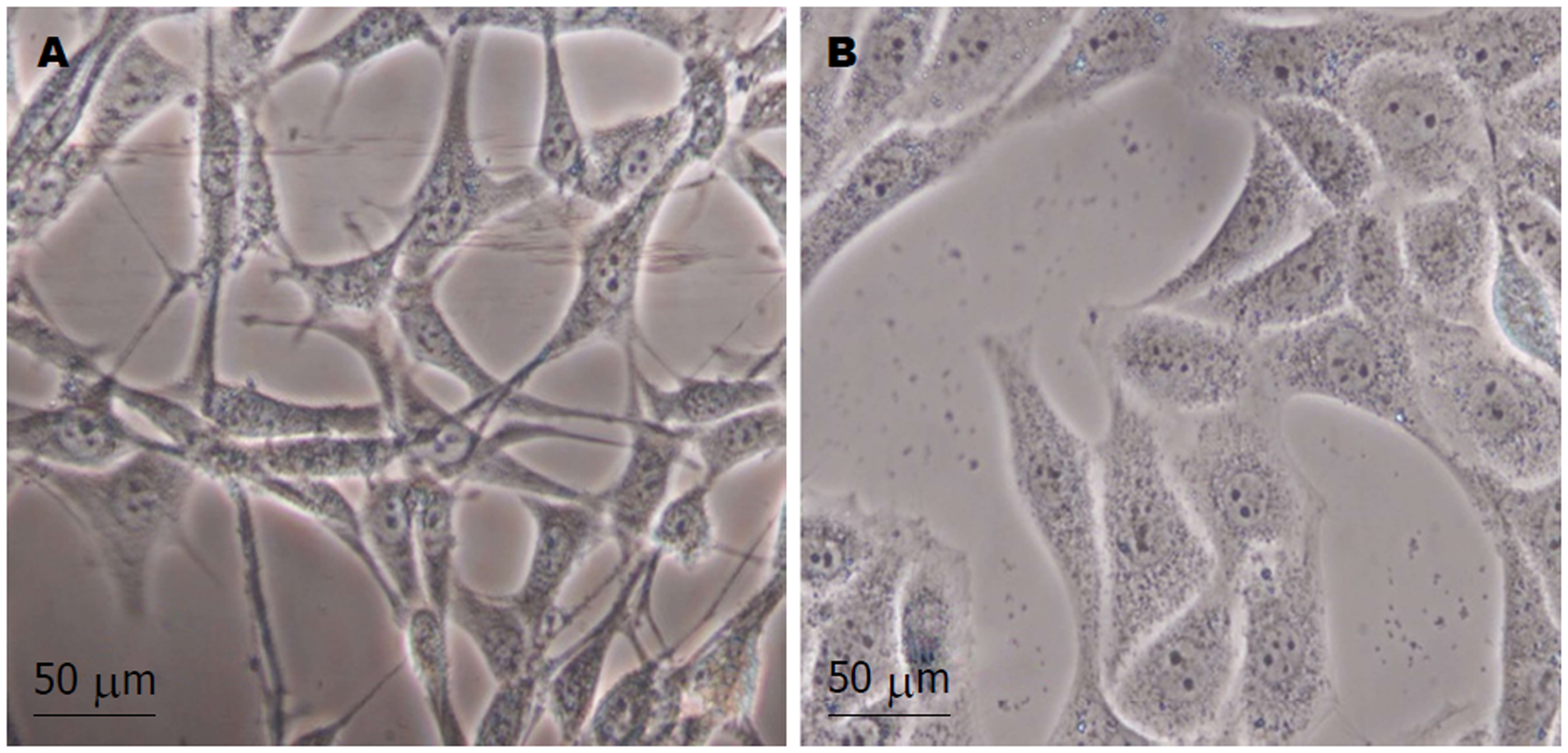
倒置相差显微镜下, 对照组Vector-T6细胞呈单层生长, 细胞间连接疏松, 细胞伪足多呈星形, 胞质薄而透明, 核椭圆; 而CA-ALK3-T6细胞连接紧密, 细胞成多角形或蝌蚪形, 胞质饱满, 核圆大(图1).
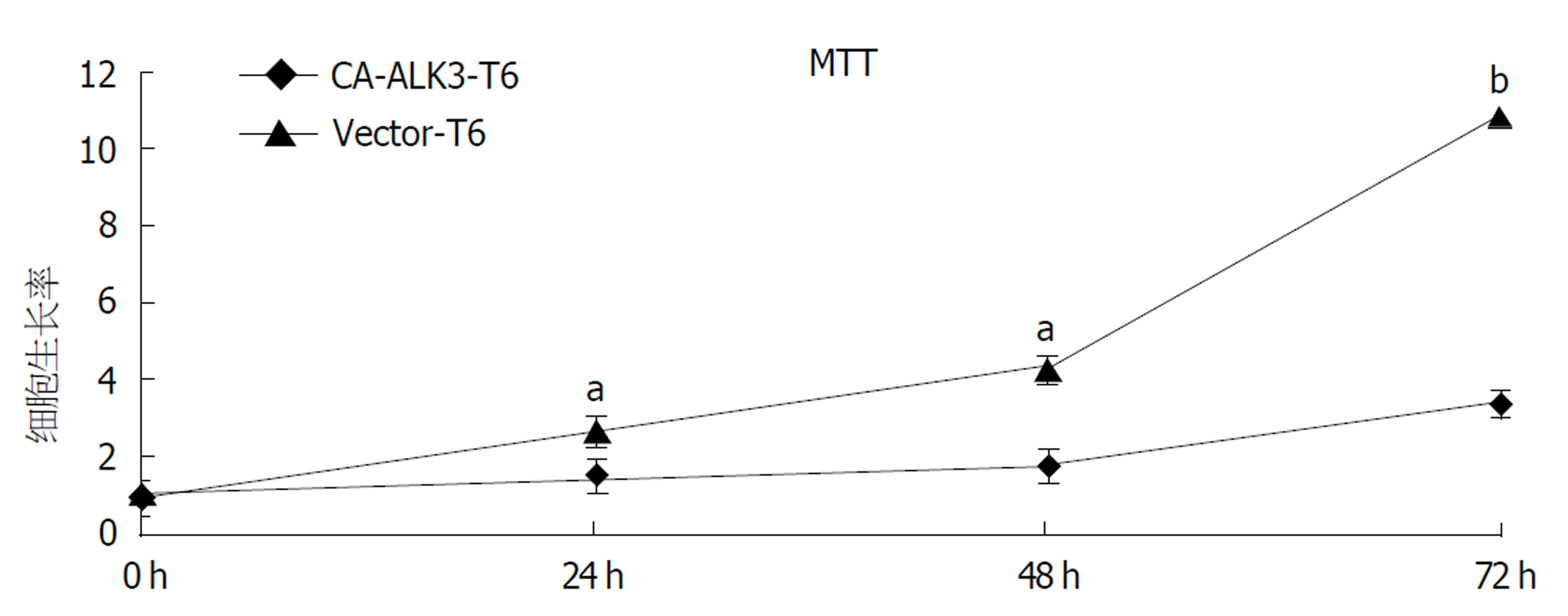
为观察稳定表达持续活化型ALK3受体后对HSC-T6细胞生长增殖的影响, 我们采用MTT法检测了稳定表达持续活化型ALK3对HSC-T6细胞增殖的影响(图2). 与0 h相比, 当培养24 h CA-ALK3-T6细胞和Vector-T6细胞增殖倍数分别为1.5和2.6倍; 当培养48 h, 对Vector-T6细胞增殖倍数为4.3倍, 而CA-ALK3-T6细胞为1.7倍(P<0.05); 随着时间的延长, CA-ALK3-T6细胞增殖速度较对照细胞要慢(P<0.05). 因此稳定表达持续活化型ALK3受体后可抑制HSC-T6细胞的活化增殖, 并且具有时间依赖性.
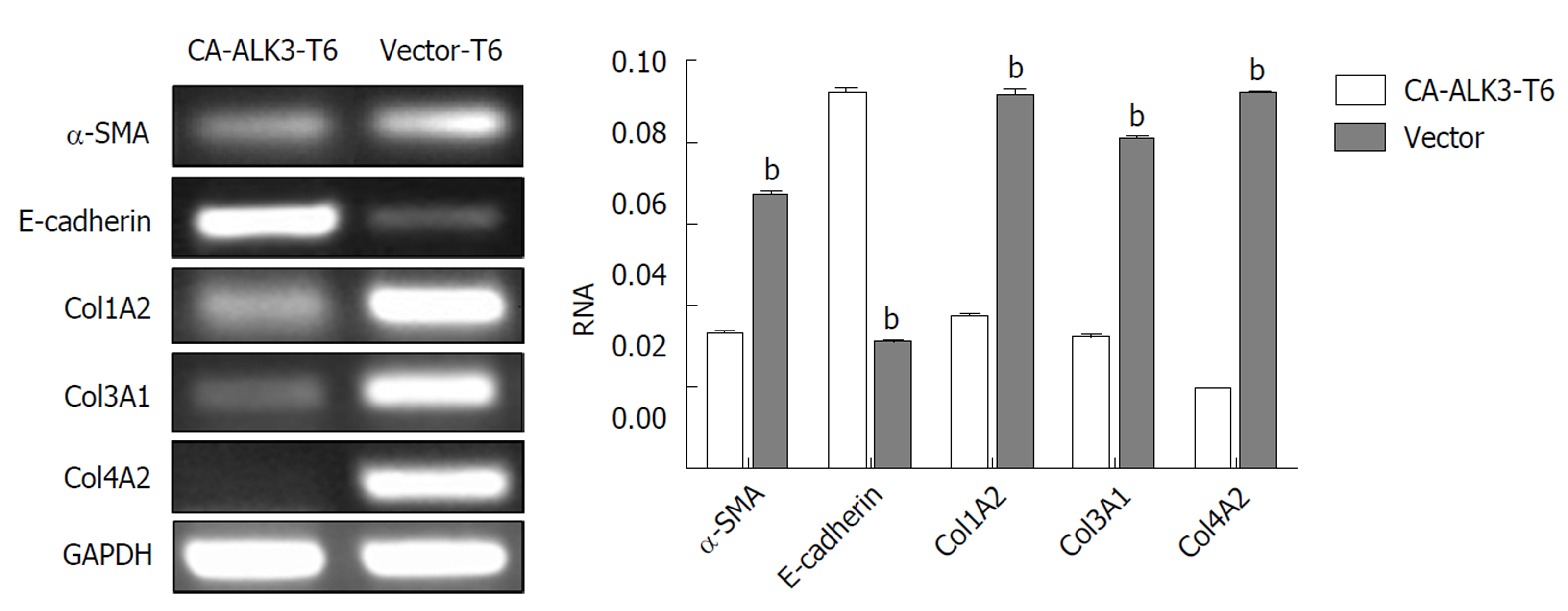
分别收集CA-ALK3-T6细胞和Vector-T6细胞, 提取总RNA, 经逆转录合成cDNA, 并以其作为模板进行RT-PCR反应. PCR产物经1%琼脂糖凝胶电泳后在凝胶成像仪下观察记录结果(图3). 电泳结果显示, 与阴性对照组Vector-T6细胞相比, CA-ALK3-T6细胞株α-SMA、col1A2、col3A1、col4A2 mRNA表达水平明显下调, 而E-cadherin水平上调.
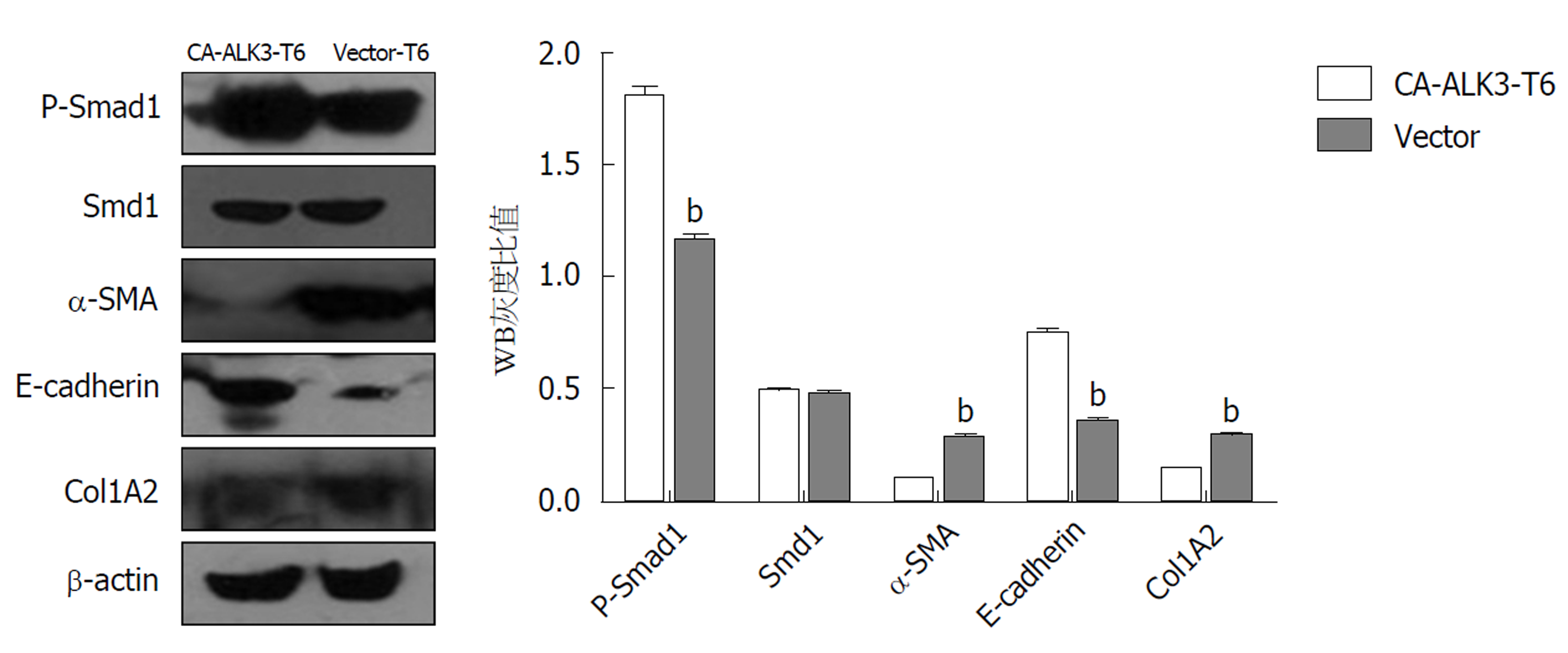
我们进一步检测了稳定表达持续活化型ALK3受体HSC-T6细胞BMP信号转导及纤维化相关蛋白表达, 培养CA-ALK3-T6细胞和Vector-T6细胞, 分别收集细胞并提取细胞总蛋白, 进行Western blotting分析. 与阴性对照细胞株Vector-T6相比, CA-ALK3-T6细胞P-Smad1磷酸化水平明显上升、E-cadherin表达水平上调, α-SMA, col1A2蛋白表达下降, Smad1蛋白水平未见明显改变. 以β-actin作为内参照, 凝胶成像系统成像(图4).
肝纤维化是各种慢性肝病发展至肝硬化的必经阶段, 是由各种致病因子引起肝脏损伤和炎症, 产生多种细胞因子刺激多种细胞发生上皮-间充质转化(epithelial to mesenchymal transition, EMT), 产生大量细胞外基质(extracellular matrix, ECM)并在肝脏沉积, 近年来, EMT参与肝纤维化被日渐提出, 但肝脏中EMT的发生机制尚不完全明确. 肝纤维化过程中发生EMT的最主要细胞为HSCs, HSCs活化增殖是肝纤维化发生发展的中心环节[3]. Yu等[4]也提出HSCs的激活是肝纤维化的一个关键事件, 被认为是EMT过程. EMT主要表现为细胞间粘附削弱, E-cadherin等上皮细胞分子标记表达下调, 间质细胞标志分子如a-SMA表达上调, 典型的细胞外基质成份如Ⅰ、Ⅲ、Ⅵ型胶原蛋白分泌增加[5]. 因此如何抑制上皮间质转化是治疗肝纤维化重要策略之一.
TGF-β参与HSCs发生EMT, 直接或间接引起肝肌成纤维细胞的增加[6]. BMP-7是一分子大小35KD的分泌性同源二聚体蛋白, 属于TGF-β超家族成员之一[7]. BMP-7受体是一种跨膜丝/苏氨酸激酶受体, BMP-7首先与Ⅱ型受体结合, Ⅱ型受体的蛋白激酶被激活, 再与Ⅰ型受体结合, 形成异源二聚体, 催化Ⅰ型受体GS区的丝氨酸和苏氨酸残基磷酸化. Ⅰ型受体被激活后, 作用于Smad1、Smad5或Smad8的C端SSXS模体, 使其磷酸化, 再与Smad4形成复合物, 进入核内与多种转录因子相互作用发挥基因调控作用[8]. BMP-7基因表达不足也是纤维化进展的重要原因之一[9]. Zeisberg等[7]在慢性肾纤维化小鼠模型中高表达BMP-7能有效拮抗TGF-β1诱导的上皮间质转化. 研究还显示, BMP-7通过影响TGF-β1信号通路的下游蛋白-Smads蛋白来阻断其信号转导[10].
本文运用真核表达载体pcDNA3-HASL-ALK3(QD)建立稳定表达持续活化型ALK3受体的大鼠HSCs株(CA-ALK3-T6). 实验结果显示, 持续活化型ALK3高表达可使大鼠HSCs形态趋向静止化, 抑制大鼠HSCs活化增殖, 进一步观察发现, BMP7信号通路下游信号分子Smad1磷酸化增加、上皮细胞标志分子E-Cadherin表达水平上调; 同时, 间质细胞标志物α-SMA以及Ⅰ型胶原mRNA及蛋白表达水平下降, Ⅲ、Ⅳ型胶原蛋白的mRNA水平下降. 说明在大鼠HSCs中BMP-7信号通路的持续活化可逆转HSCs活化, 抑制TGF-β1诱导的上皮间质转化和肌成纤维细胞增殖; 减少ECM的分泌, 从而改善肝纤维化. Yu等[4]研究发现, 在肝纤维化过程中, MEG3在体内和体外均有降低, MEG3过表达导致肝纤维化的抑制, 减少α-SMA和I型胶原蛋白. MEG3过表达通过EMT抑制HSC激活, 与上皮标记物增加和间充质标记物减少有关. 由此可见EMT是HSC激活致肝纤维化过程的关键环节. 王丽惠等[11]研究发现TGF-β1刺激HSC-T6后细胞形态发生变化, 伪足增多呈星形, 细胞间连接呈疏松状态, 呈现活化生物学特征. 本实验研究通过倒置显微镜观察发现, BMP-7信号通路持续活化导致大鼠HSCs的形态学失去活化形态特征而趋向静止化变化.
肝纤维化传统上被认为是一个不可逆转的过程, 但以上本研究显示了BMP-7信号转导可抑制TGF-β1信号通路的致纤维化效应, 为BMP-7成为治疗肝纤维化的关键靶点奠定基础. 有望以激活BMP-7信号转导为靶点来探索、开发抗肝纤维化药物并应用到临床.
虽然随着人们生活水平的提高及乙肝疫苗接种, 我国乙型肝炎发病率逐年降低, 但是酒精性及丙型肝炎引起的肝硬化却并不少见, 研究数据显示, 感染人员就诊者不足1/3, 简直是冰山一角, 长期不管理的结果便是肝硬化甚至迅速进展至肝癌, 肝硬化是各种慢性肝病的晚期阶段, 治疗效果差, 且耗费大量资源, 慢性乙型病毒性肝炎临床治愈(珠峰)工程项目、国家"十二五"传染病重大专项等课题对于肝硬化的研究及治疗有巨大的贡献, 但目前仍未研究出并适用临床的有效逆转肝硬化方法.
拟通过探讨肝硬化分子发生机制找到逆转的肝硬化关键靶点.
本实验观察到通过研究BMP7及下游信号通路抑制肝纤维化与肝星状细胞(hepatic stellate cells, HSCs)能逆转肝硬化核心细胞HSCs.
倒置相差显微镜、MTT、半定量PCR、western-blotting.
本文实验研究达到我们预期的结果, 印证了肝纤维化分子发生发展机制, 我们观察到持续活化的HSCs增殖受到抑制, 并且向未活化方向逆转, 探索了其中的分子机制, 磷酸化的smad1水平显著升高, α-SMA和Ⅰ型胶原蛋白表达下调, 而E-cadherin表达上调. 本研究提示BMP7有希望成为肝纤维化的分子治疗靶点.
本研究采用持续活化型ALK3的新方法, 进一步探索了肝纤维化分子发病机制, 观察到肝纤维化关键细胞HSCs活化有逆转, 进一步印证BMP7有望成为肝纤维化分子治疗靶点, 为将来肝纤维化的治疗提供新的契机.
本实验采取成熟的实验方法, 提出了我们的观点, 但通过评审专家的意见确实有些忽略之处, 会吸取经验教训, 使实验更加严谨, 本研究未来研究方向是动物模型的研究, 未来研究方法的最佳方法仍主要以分子生物学研究方法为主.
学科分类: 胃肠病学和肝病学
手稿来源地: 海南省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑:崔丽君 电编:刘继红
| 1. | Friedman SL. Molecular regulation of hepatic fibrosis, an integrated cellular response to tissue injury. J Biol Chem. 2000;275:2247-2250. [PubMed] [DOI] |
| 2. | Yue HY, Yin C, Hou JL, Zeng X, Chen YX, Zhong W, Hu PF, Deng X, Tan YX, Zhang JP, Ning BF, Shi J, Zhang X, Wang HY, Lin Y, Xie WF. Hepatocyte nuclear factor 4alpha attenuates hepatic fibrosis in rats. Gut. 2010;59:236-246. [PubMed] [DOI] |
| 3. | Gressner AM, Weiskirchen R. Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-beta as major players and therapeutic targets. J Cell Mol Med. 2006;10:76-99. [PubMed] [DOI] |
| 4. | Yu F, Geng W, Dong P, Huang Z, Zheng J. LncRNA-MEG3 inhibits activation of hepatic stellate cells through SMO protein and miR-212. Cell Death Dis. 2018;9:1014. [PubMed] [DOI] |
| 5. | Weiskirchen R, Meurer SK, Gressner OA, Herrmann J, Borkham-Kamphorst E, Gressner AM. BMP-7 as antagonist of organ fibrosis. Front Biosci (Landmark Ed). 2009;14:4992-5012. [PubMed] [DOI] |
| 6. | Fabregat I, Caballero-Diaz D. Transforming Growth Factor-β-Induced Cell Plasticity in Liver Fibrosis and Hepatocarcinogenesis. Front Oncol. 2018;8:357. [PubMed] [DOI] |
| 7. | Zeisberg M, Hanai J, Sugimoto H, Mammoto T, Charytan D, Strutz F, Kalluri R. BMP-7 counteracts TGF-beta1-induced epithelial-to-mesenchymal transition and reverses chronic renal injury. Nat Med. 2003;9:964-968. [PubMed] [DOI] |
| 8. | Wrana JL, Attisano L, Wieser R, Ventura F, Massague J. Mechanism of actinvation of the TGF-¦Â receptor. Nature. 1994;37:341-347. [PubMed] [DOI] |
| 9. | Zeisberg M. Bone morphogenic protein-7 and the kidney: current concepts and open questions. Nephrol Dial Transplant. 2006;21:568-573. [PubMed] [DOI] |
| 10. | Wang S, Hirschberg R. Bone morphogenetic protein-7 signals opposing transforming growth factor beta in mesangial cells. J Biol Chem. 2004;279:23200-23206. [PubMed] [DOI] |