修回日期: 2018-10-16
接受日期: 2018-10-29
在线出版日期: 2018-12-28
鞘脂是一系列新型的脂质生物调控分子, 在调控细胞生长、分化、增殖以及凋亡等方面具有重要的生物学作用. 鞘脂代谢紊乱可以诱发包括肝细胞癌(hepatocellular carcinoma, HCC)在内的多种疾病的发生. 随着脂质组学技术的发展, 越来越多的研究表明鞘脂在HCC发生、发展及转归中起到重要的作用. 研究表明鞘脂可以作为诊断HCC的新型标志物, 且调控鞘脂代谢通路可能成为治疗HCC的潜在靶点. 本文从鞘脂的分类、代谢通路, 鞘脂对肝细胞增殖与凋亡的影响, 鞘脂在HCC的发生发展中的作用, 以及鞘脂作为HCC诊断、治疗靶点的可能性等方面的研究现状做一综述.
核心提要: 鞘脂代谢紊乱可以诱发肝细胞癌(hepatocellu-lar carcinoma, HCC)的发生. 鞘脂可以作为诊断HCC的新型标志物, 调控鞘脂代谢通路可能成为治疗HCC的潜在靶点. 本文从鞘脂的分类、鞘脂在HCC的发生发展中的作用、鞘脂作为HCC诊断、治疗靶点的可能性等方面做一综述.
引文著录: 蒋莹莹, 郑素军. 肝细胞癌的鞘脂组学研究进展. 世界华人消化杂志 2018; 26(36): 2109-2114
Revised: October 16, 2018
Accepted: October 29, 2018
Published online: December 28, 2018
Sphingolipids are a class of novel lipid bioregulatory molecules that play important roles in regulating cell growth, differentiation, proliferation, and apoptosis. Sphingolipid metabolism disorders could induce the development of various diseases including hepatocellular carcinoma (HCC). With the development of lipidomics, it has been demonstrated that sphingolipids play an increasingly essential role in the occurrence, development, and outcome of HCC. Studies have shown that sphingolipids can be used as a new biomarker for the diagnosis of HCC, and regulation of the sphingolipid metabolism pathway may be a potential target for the treatment of HCC. This paper reviews the current progress in research of sphingolipids with regard to their classification, metabolic pathways, role in the development of HCC, and the possibility as a target for diagnosis and treatment of HCC.
- Citation: Jiang YY, Zheng SJ. Progress in research of sphingolipids in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2018; 26(36): 2109-2114
- URL: https://www.wjgnet.com/1009-3079/full/v26/i36/2109.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i36.2109
鞘脂广泛存在于动物、植物、真菌、原核动物和病毒中, 是十八碳氨基乙醇为基本骨架合成的、一系列新型的脂质生物调控分子. 鞘脂在细胞膜结构、能量提供和信号传导方面发挥着重要作用, 可调控细胞生长、分化、迁徙及凋亡过程, 其代谢失常会导致肿瘤、免疫性疾病、炎症、心血管等疾病的发生[1-5]. 从鞘脂组学角度研究疾病的发生发展规律, 寻找诊断、治疗靶点, 是目前的研究热点之一. 目前, 已有多种研究发现, 鞘脂与肝脏炎症性疾病、肝纤维化、肝细胞脂肪变性等肝脏疾病密切相关[6-9].
肝细胞癌(hepatocellular carcinoma, HCC)是世界上最常见的恶性肿瘤之一, 位于肿瘤相关死亡的第3位. 大约70%-90%的HCC患者由肝硬化进展而来[10-12]. 由于HCC早期缺乏典型症状或特异性生物标志物, 许多患者在确诊时已进入晚期阶段, 并且失去了治疗方案选择的最佳时机. 目前手术是HCC最有效的治疗方法, 但并不是所有的HCC患者均适合手术治疗[13]. 因此寻找HCC新型的诊断标志物及治疗药物十分重要. 近年来有研究发现鞘脂代谢参与了HCC的发生发展过程. 本文从鞘脂的分类、代谢通路, 鞘脂对肝细胞增殖与凋亡的影响, 鞘脂在HCC的发生发展中的作用, 以及鞘脂作为HCC诊断、治疗靶点的可能性等方面做一综述.
鞘脂是一类以鞘氨醇为骨架的较复杂的化合物, 鞘脂类化合物包括神经酰胺(ceramide, Cer)、二氢神经酰胺(dihydroceramide, DHcer)、1-磷酸神经酰胺(ceramide-1-phosphate, Cer-1P)、鞘氨醇(sphingosine, Sph)、二氢鞘氨醇(dihydrosphingosine, DHSph)和1-磷酸鞘氨醇(Sphingosine 1-phosphate, S1P)、糖鞘脂(glycosphingolipids, GlcSPL)、鞘磷脂等. 脂质结构的多样性决定了其具有不同的生理功能.
鞘脂组学(sphingolipidomics)是以鞘脂为靶向的脂质组学, 主要探究鞘脂化合物及其代谢通路的变化[14]. 利用鞘脂组学研究鞘脂与疾病之间的关系是目前研究的热点[15,16]. 随着鞘脂组学研究的发展, 其检测方法也取得了长足进展. 目前已经建立鞘脂的分离和分析技术主要包括: 薄层色谱, 高效液相色谱-质谱, 电喷雾电离质谱, 核磁共振等[8,9]. 鞘脂检测方法的快速发展, 为深入认识鞘脂的结构及其功能奠定了坚实的基础.
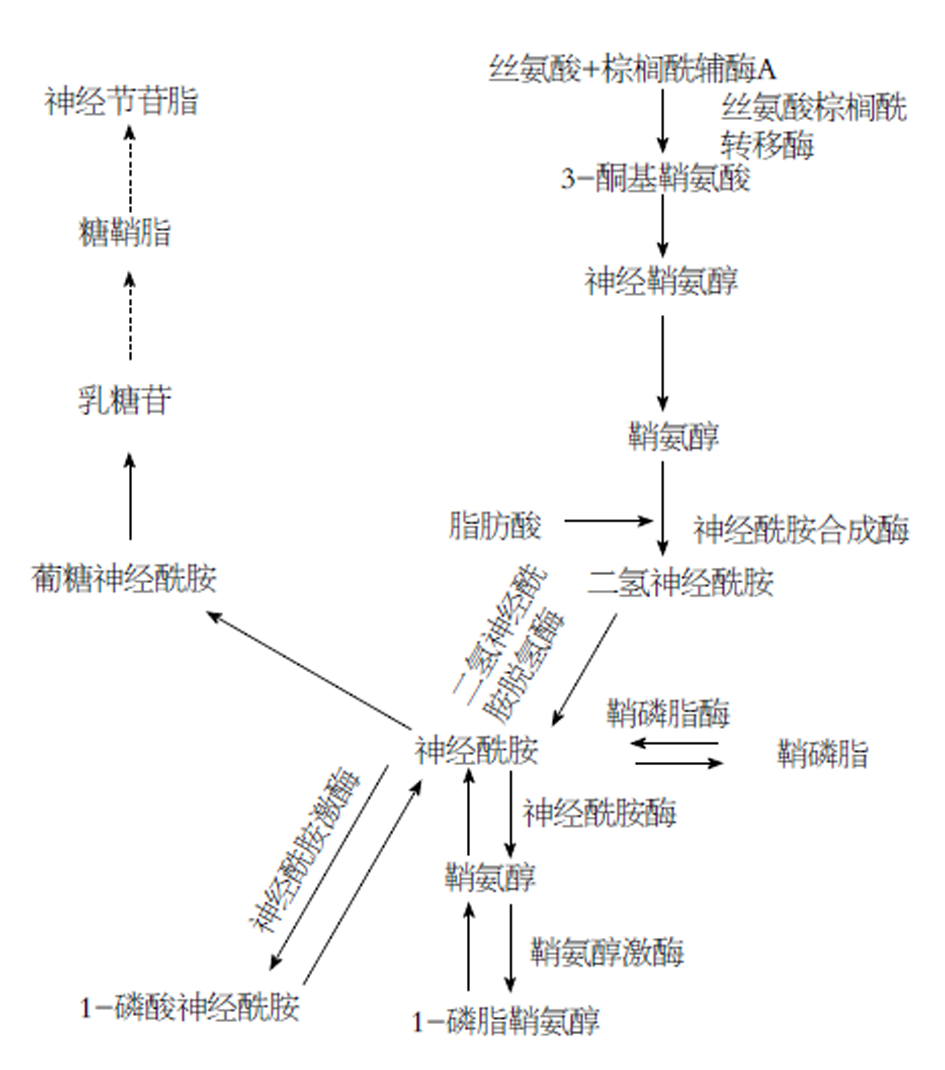
鞘脂的代谢较为复杂, 其中Cer处于鞘脂代谢网络中的核心位置(图1), 其合成包括主要发生在内质网的从头合成, 以及由鞘磷脂、糖鞘脂或者其他鞘脂类化合物转化而来的补救合成两条途径. 从头合成途径由L-丝氨酸和棕榈酰辅酶A通过丝氨酸棕榈酰转移酶(serine palmitoyltransferase, SPT)合成3-酮基二氢鞘氨醇, 然后被还原为DHSph, 在神经酰胺合成酶(ceramide synthase, CerS)的作用下生成DHcer, 并进一步生成Cer, 其中SPT是鞘脂从头合成途径的限速酶. 此外, 鞘磷脂通过鞘磷脂酶(phingomyelinase, SMase)、糖鞘脂通过葡糖苷酶(GCase)水解等补救合成途径也可以转化成Cer. 合成的Cer一方面可以通过神经酰胺激酶(ceramde kinase, CK)生成Cer-1P; 另一方面可以通过神经酰胺酶(ceramidase, CDase)生成鞘氨醇, 并进一步由鞘氨醇激酶(sphingosine kinase, SPHK)生成S1P[1].
近年来, 鞘脂代谢与肝脏疾病发生发展之间的关系引起了广泛的关注, 鞘脂介导的代谢通路参与调控肝细胞增殖与凋亡的过程.
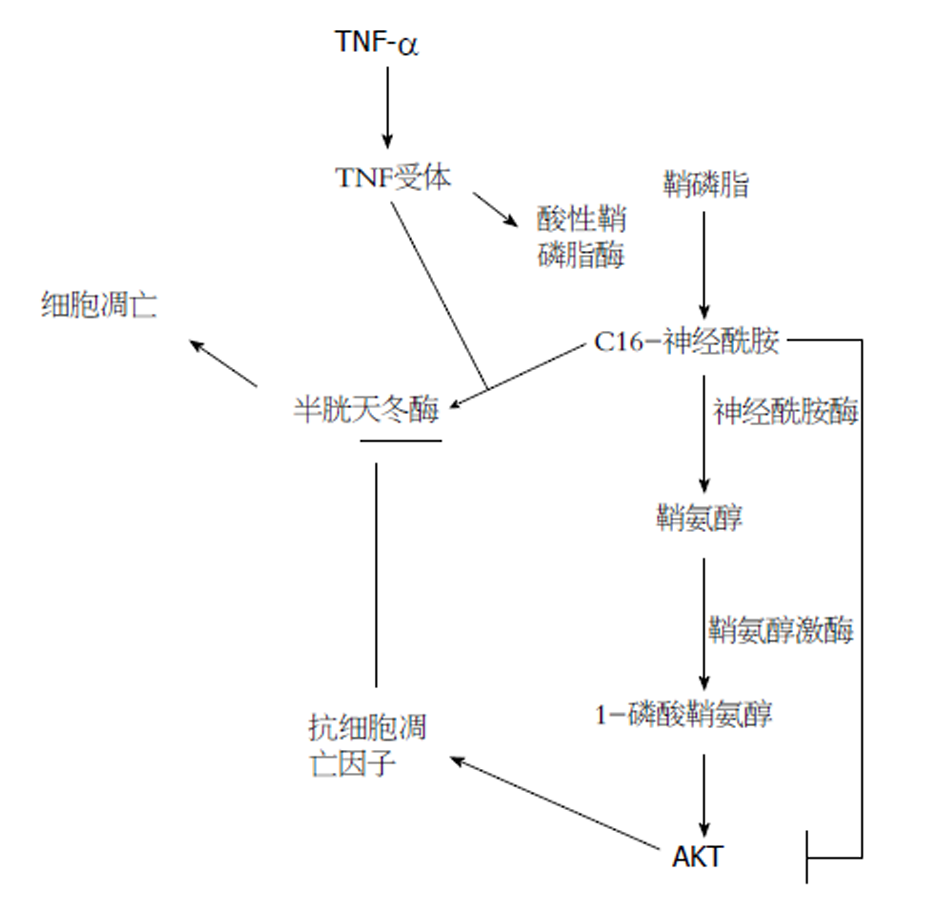
研究发现, Cer作为诱导细胞凋亡的介质能够同时触发内源性与外源性的细胞凋亡. Cer能通过内质网和线粒体途径, 参与肿瘤坏死因子(tumor necrosis factor, TNF)引起的凋亡通路[17]. TNF作为死亡配体之一, 其与肝脏病理损伤关系最为密切. SMase可以水解鞘磷脂生成Cer, 根据pH的不同, SMase可以分为酸性鞘磷脂酶(acid sphingomyelinase, ASMase)、碱性鞘磷脂酶(alkaline sphingomyelinase, ALKSMase)和中性鞘磷脂酶(neutral sphingomyelinase, NSMase). 在TNF介导的信号转导通路中, ASMase是介导肝脏损伤的关键酶, 抑制ASMase的活性可以减弱细胞凋亡反应[18]. 此外, 鞘脂中的酰基链长度和组成在调节TNF-α受体1(TNFR1)的内化和肝细胞凋亡信号传导中具有至关重要的作用[19]. 同时, 一些鞘脂类化合物也能促进肝细胞的增殖. 研究发现S1P具有促进细胞增殖和抗凋亡的作用. S1P可以通过促进人肝窦内皮细胞中IL-6和血管内皮生长因子的产生, 从而促进肝细胞的增殖. 用S1P刺激肝细胞后DNA的合成能力比没有S1P刺激的合成能力更强[20]. 任何原因引起的鞘脂类化合物动态平衡的改变均可影响肝细胞的生存与凋亡(图2).
近年来, 鞘脂在癌细胞相关功能以及预防癌症的发生发展等方面的作用备受关注. 既往研究显示, 鞘脂代谢紊乱参与了HCC的发病过程[21,22]. 一般认为, Cer、鞘氨醇促进肝癌细胞凋亡[23,24], 与之相拮抗, Cer-1P、S1P可促进肿瘤增殖、迁移、转化、血管生成[25,26]. HCC的体内、体外模型显示, C6纳米脂质体神经酰胺发挥抗血管生成和抗肿瘤作用, C6纳米脂质体Cer的全身给药可以减少血管生成, 同时可以诱导肿瘤细胞的凋亡[24]. 细胞凋亡研究发现, 在肝癌组织中鞘氨醇激酶的mRNA水平比临近的非肝癌组织中含量高, 且肝癌患者血清中S1P水平高于正常人[27,28]. Cheng等[29]研究结果显示, S1P可以作为Hippo途径的上游阻遏物, 从而诱发HCC细胞中YAP的活化, 导致了HCC的发生. 此外, 用淫羊藿素抑制HCC细胞中鞘氨醇激酶的活化, 能够促进肝癌细胞的凋亡[30]. 各种病因引起的鞘脂代谢网络紊乱, 包括神经酰胺的生成减少或降解增多, 或Cer-1P、S1P生成增多, 它们间的代谢失衡导致的肝细胞增殖失控, 均会促进HCC的发生、生长、侵袭和转移[2,3].
鞘脂在肝癌诊断中的作用成为目前研究的热点之一. Grammatikos等[31]检测了不同碳链长度[包括长链(C16-C20)和非常长链(≥C22)]的Cer及其相关代谢产物, 目的是鉴别肝癌与肝硬化患者. 研究发现, C16- Cer和S1P可以作为肝癌的诊断标志物. 我们曾经对血清鞘脂在乙肝相关性甲胎蛋白阴性的HCC的诊断价值方面进行过相关研究[32], 本研究检测了包括Cer、Cer-1P、鞘氨醇、S1P等61种鞘脂. 与Grammatikos等[31]研究相比, 我们研究中检测的鞘脂种类更全面, 不仅包含长链和非常长链Cer, 同时也对短链[C8-C14]Cer进行了检测. 结果发现上调的Cer(d18: 1/8: 0)-1-P有助于鉴别乙肝相关性甲胎蛋白阴性HCC, 其灵敏度为81.6%, 特异度为86.7%. 我们下一步将探讨其对各种病因所致肝癌中的诊断价值.
有研究发现几乎所有的癌症均伴随异常糖基化的发生[33], 杜昊骐等[34]认为岩藻糖基化是癌症发生的早期现象. Zhu等[35]研究在HCC组织中发现了岩藻糖基化糖鞘脂的异常高表达, 末端含有Fucα2Gal-结构的糖鞘脂可以作为HCC诊断标志物及其治疗的靶点. 目前糖鞘脂与甲胎蛋白用于HCC诊断价值效能高低的报道较为少见. 有研究者对癌症相关碳水化合物抗原作为诊断HCC的特异性标志物进行了比较, 结果发现抗二硫糖基半乳糖苷, 抗岩藻糖基GM1和抗Gb2有助于鉴别乙肝相关性HCC, 且比甲胎蛋白具有更好的预测灵敏度[36].
目前越来越多的研究发现鞘脂可以作为肝癌治疗的靶点, 其中Cer在肝癌诊断中的作用引起了广泛的关注. 有研究发现, 多种(潜在)具有抗HCC作用的药物/试剂, 其机制是通过模拟Cer活性或影响Cer水平来发挥抗癌作用. Li等[7]发现纳米脂质体C6-Cer(LipC6)可以增加小鼠的抗肿瘤免疫应答并减缓肝肿瘤的生长. 在患有肝肿瘤的小鼠中, 注射LipC6可以减少肿瘤相关巨噬细胞(tumor associated macrophages, TAM)的数量和TAM抑制抗肿瘤免疫应答的能力. 同时, LipC6还增加肿瘤抗原特异性(tumor antigen-specific, TAS)的CD8 + T细胞的抗肿瘤作用. 既往研究显示雷帕霉素(mTOR)在促进HCC的发生、发展及药物抗性中发挥重要作用[37]. Liu等[38]发现AZD-8055作为一种新型mTOR抑制剂, 具有抗HCC的作用, 而短链Cer(C6)能够显著增强AZD-8055诱导HCC细胞凋亡的能力. 这种诱导抗存活及促凋亡的协同作用仅发生在原代培养人的HCC细胞中, 而在正常细胞中未见该现象. 也有研究报道[39], Cer可以作为调节自噬的重要效应分子发挥抗癌作用: 褪黑素可以诱导细胞自噬, 并且可以刺激从头合成途径、增强酸性鞘磷脂酶(ASMase)活性进而使Cer水平升高, 诱导肝癌细胞凋亡. 而抑制丝氨酸棕榈酰转移酶可以阻止褪黑素诱导的自噬和细胞凋亡. 此外, 华蟾素可以通过抑制鞘氨醇激酶1的活性和诱导Cer的产生, 进而诱导培养的HCC细胞的生长抑制和凋亡[40].
研究证明亚硒酸钠是肝癌细胞系有效的细胞毒性剂[41]. Chatzakos等[42]研究提出亚硒酸盐和鞘氨醇激酶1抑制剂的联合应用可用于治疗肝癌, 而对正常肝细胞没有影响. 本研究发现抑制鞘氨醇激酶1的活性能够提高神经酰及活性氧的水平, 进而诱导肝癌细胞的凋亡. Ji等[43]发现马齿苋脑苷A(portulacerebroside A)可以通过调节相关mRNA和蛋白质的表达, 从而抑制人HCCLM3肝癌细胞的侵袭和转移. 这是一项揭示马齿苋脑苷A在肝癌抗转移治疗中的潜在治疗应用的研究.
以上研究结果显示, 鞘脂在今后肝癌的治疗中具有潜在的价值. 但是目前这些试剂/药物在人肝癌患者中的应用鲜有报道, 治疗疗效也尚待评估. 因此, 应深入研究鞘脂在其中所起到的关键作用, 扩展在生物模型中的应用, 充分发挥鞘脂作为治疗肝癌的潜在靶点的优势, 为肝癌治疗药物的研发提供新希望.
生物标志物的最终目标是提供改善疾病的诊断或预后的新方法. 鞘脂作为代谢网络中重要的信使分子及其调节HCC细胞增殖与凋亡的功能, 使鞘脂作为HCC的新型诊断标志物与治疗药物成为可能. 尽管鞘脂代谢及代谢通路中相关酶的研究虽已有长足进展, 但是鞘脂组学在HCC生物学作用以及其作为新兴治疗靶标的相关研究, 目前正处于由结构探究和病理/细胞表型分析向具体生物学作用机制及信号通路研究的转变, 鞘脂在HCC发展中的作用机制及具体信号通路尚未完全明确. 鞘脂对HCC的预防、诊断、治疗及机制仍需要进一步的研究.
学科分类: 胃肠病学和肝病学
手稿来源地: 北京市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B, B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑:崔丽君 电编:张砚梁
| 1. | Musso G, Cassader M, Paschetta E, Gambino R. Bioactive Lipid Species and Metabolic Pathways in Progression and Resolution of Nonalcoholic Steatohepatitis. Gastroenterology. 2018;155:282-302.e8. [PubMed] [DOI] |
| 2. | Pralhada Rao R, Vaidyanathan N, Rengasamy M, Mammen Oommen A, Somaiya N, Jagannath MR. Sphingolipid metabolic pathway: an overview of major roles played in human diseases. J Lipids. 2013;2013:178910. [PubMed] [DOI] |
| 3. | Morales A, Mari M, Garcia-Ruiz C, Colell A, Fernandez-Checa JC. Hepatocarcinogenesis and ceramide/cholesterol metabolism. Anticancer Agents Med Chem. 2012;12:364-375. [PubMed] |
| 4. | Podbielska M, Szulc ZM, Kurowska E, Hogan EL, Bielawski J, Bielawska A, Bhat NR. Cytokine-induced release of ceramide-enriched exosomes as a mediator of cell death signaling in an oligodendroglioma cell line. J Lipid Res. 2016;57:2028-2039. [PubMed] [DOI] |
| 5. | Knupp J, Martinez-Montañés F, Van Den Bergh F, Cottier S, Schneiter R, Beard D, Chang A. Sphingolipid accumulation causes mitochondrial dysregulation and cell death. Cell Death Differ. 2017;24:2044-2053. [PubMed] [DOI] |
| 6. | Norris GH, Blesso CN. Dietary sphingolipids: potential for management of dyslipidemia and nonalcoholic fatty liver disease. Nutr Rev. 2017;75:274-285. [PubMed] [DOI] |
| 7. | Krautbauer S, Wiest R, Liebisch G, Buechler C. Associations of systemic sphingolipids with measures of hepatic function in liver cirrhosis are related to cholesterol. Prostaglandins Other Lipid Mediat. 2017;131:25-32. [PubMed] [DOI] |
| 8. | Li JF, Qu F, Zheng SJ, Ren F, Wu HL, Liu M, Ren JY, Chen Y, Duan ZP, Zhang JL. Plasma sphingolipids: potential biomarkers for severe hepatic fibrosis in chronic hepatitis C. Mol Med Rep. 2015;12:323-330. [PubMed] [DOI] |
| 9. | Qu F, Zheng SJ, Liu S, Wu CS, Duan ZP, Zhang JL. Serum sphingolipids reflect the severity of chronic HBV infection and predict the mortality of HBV-acute-on-chronic liver failure. PLoS One. 2014;9:e104988. [PubMed] [DOI] |
| 10. | European Association For The Study Of The Liver; European Organisation For Research And Treatment Of Cancer. EASL-EORTC clinical practice guidelines: management of hepatocellular carcinoma. J Hepatol. 2012;56:908-943. [PubMed] [DOI] |
| 11. | Fujiwara N, Nakagawa H, Kudo Y, Tateishi R, Taguri M, Watadani T, Nakagomi R, Kondo M, Nakatsuka T, Minami T. Sarcopenia, intramuscular fat deposition, and visceral adiposity independently predict the outcomes of hepatocellular carcinoma. J Hepatol. 2015;63:131-140. [PubMed] [DOI] |
| 12. | Xu G, Wang Y, Li W, Cao Y, Xu J, Hu Z, Hao Y, Hu L, Sun Y. COX-2 Forms Regulatory Loop with YAP to Promote Proliferation and Tumorigenesis of Hepatocellular Carcinoma Cells. Neoplasia. 2018;20:324-334. [PubMed] [DOI] |
| 13. | Kapitanov T, Neumann UP, Schmeding M. Hepatocellular Carcinoma in Liver Cirrhosis: Surgical Resection versus Transarterial Chemoembolization-A Meta-Analysis. Gastroenterol Res Pract. 2015;2015:696120. [PubMed] [DOI] |
| 14. | Haynes CA, Allegood JC, Park H, Sullards MC. Sphingolipidomics: methods for the comprehensive analysis of sphingolipids. J Chromatogr B Analyt Technol Biomed Life Sci. 2009;877:2696-2708. [PubMed] [DOI] |
| 15. | Montefusco DJ, Allegood JC, Spiegel S, Cowart LA. Non-alcoholic fatty liver disease: Insights from sphingolipidomics. Biochem Biophys Res Commun. 2018;504:608-616. [PubMed] [DOI] |
| 16. | Qu L, Qu F, Jia Z, Wang C, Wu C, Zhang J. Integrated targeted sphingolipidomics and transcriptomics reveal abnormal sphingolipid metabolism as a novel mechanism of the hepatotoxicity and nephrotoxicity of triptolide. J Ethnopharmacol. 2015;170:28-38. [PubMed] [DOI] |
| 17. | Jain A, Beutel O, Ebell K, Korneev S, Holthuis JC. Diverting CERT-mediated ceramide transport to mitochondria triggers Bax-dependent apoptosis. J Cell Sci. 2017;130:360-371. [PubMed] [DOI] |
| 18. | Nojima H, Freeman CM, Gulbins E, Lentsch AB. Sphingolipids in liver injury, repair and regeneration. Biol Chem. 2015;396:633-643. [PubMed] [DOI] |
| 19. | Ali M, Fritsch J, Zigdon H, Pewzner-Jung Y, Schütze S, Futerman AH. Altering the sphingolipid acyl chain composition prevents LPS/GLN-mediated hepatic failure in mice by disrupting TNFR1 internalization. Cell Death Dis. 2013;4:e929. [PubMed] [DOI] |
| 20. | Nowatari T, Murata S, Nakayama K, Sano N, Maruyama T, Nozaki R, Ikeda N, Fukunaga K, Ohkohchi N. Sphingosine 1-phosphate has anti-apoptotic effect on liver sinusoidal endothelial cells and proliferative effect on hepatocytes in a paracrine manner in human. Hepatol Res. 2015;45:1136-1145. [PubMed] [DOI] |
| 21. | Canals D, Perry DM, Jenkins RW, Hannun YA. Drug targeting of sphingolipid metabolism: sphingomyelinases and ceramidases. Br J Pharmacol. 2011;163:694-712. [PubMed] [DOI] |
| 22. | Li G, Liu D, Kimchi ET, Kaifi JT, Qi X, Manjunath Y, Liu X, Deering T, Avella DM, Fox T. Nanoliposome C6-Ceramide Increases the Anti-tumor Immune Response and Slows Growth of Liver Tumors in Mice. Gastroenterology. 2018;154:1024-1036.e9. [PubMed] [DOI] |
| 23. | Ullio C, Casas J, Brunk UT, Sala G, Fabriàs G, Ghidoni R, Bonelli G, Baccino FM, Autelli R. Sphingosine mediates TNFα-induced lysosomal membrane permeabilization and ensuing programmed cell death in hepatoma cells. J Lipid Res. 2012;53:1134-1143. [PubMed] [DOI] |
| 24. | Tagaram HR, Divittore NA, Barth BM, Kaiser JM, Avella D, Kimchi ET, Jiang Y, Isom HC, Kester M, Staveley-O'Carroll KF. Nanoliposomal ceramide prevents in vivo growth of hepatocellular carcinoma. Gut. 2011;60:695-701. [PubMed] |
| 25. | Kolter T, Sandhoff K. Principles of lysosomal membrane digestion: stimulation of sphingolipid degradation by sphingolipid activator proteins and anionic lysosomal lipids. Annu Rev Cell Dev Biol. 2005;21:81-103. [PubMed] |
| 26. | Yin Y, Xu M, Gao J, Li M. Alkaline ceramidase 3 promotes growth of hepatocellular carcinoma cells via regulating S1P/S1PR2/PI3K/AKT signaling. Pathol Res Pract. 2018;214:1381-1387. [PubMed] [DOI] |
| 27. | Bao M, Chen Z, Xu Y, Zhao Y, Zha R, Huang S, Liu L, Chen T, Li J, Tu H. Sphingosine kinase 1 promotes tumour cell migration and invasion via the S1P/EDG1 axis in hepatocellular carcinoma. Liver Int. 2012;32:331-338. [PubMed] [DOI] |
| 28. | Jin J, Liao W, Yao W, Zhu R, Li Y, He S. Aldo-keto Reductase Family 1 Member B 10 Mediates Liver Cancer Cell Proliferation through Sphingosine-1-Phosphate. Sci Rep. 2016;6:22746. [PubMed] [DOI] |
| 29. | Cheng JC, Wang EY, Yi Y, Thakur A, Tsai SH, Hoodless PA. S1P Stimulates Proliferation by Upregulating CTGF Expression through S1PR2-Mediated YAP Activation. Mol Cancer Res. 2018;16:1543-1555. [PubMed] [DOI] |
| 30. | Lu PH, Chen MB, Liu YY, Wu MH, Li WT, Wei MX, Liu CY, Qin SK. Identification of sphingosine kinase 1 (SphK1) as a primary target of icaritin in hepatocellular carcinoma cells. Oncotarget. 2017;8:22800-22810. [PubMed] [DOI] |
| 31. | Grammatikos G, Schoell N, Ferreirós N, Bon D, Herrmann E, Farnik H, Köberle V, Piiper A, Zeuzem S, Kronenberger B. Serum sphingolipidomic analyses reveal an upregulation of C16-ceramide and sphingosine-1-phosphate in hepatocellular carcinoma. Oncotarget. 2016;7:18095-18105. [PubMed] [DOI] |
| 32. | 蒋 莹莹, 铁 偲, 王 扬. 血清鞘脂用于乙肝相关甲胎蛋白阴性肝细胞癌的诊断价值研究. 胃肠病学和肝病学杂志. 2018;27:563-568. [DOI] |
| 33. | Pinho SS, Carvalho S, Marcos-Pinto R, Magalhães A, Oliveira C, Gu J, Dinis-Ribeiro M, Carneiro F, Seruca R, Reis CA. Gastric cancer: adding glycosylation to the equation. Trends Mol Med. 2013;19:664-676. [PubMed] [DOI] |
| 34. | 杜 昊骐, 于 汉杰, 贾 丽苑. 糖鞘脂分析技术及相关疾病研究进展. 生物化学与生物物理进展. 2016;43:14-27. [DOI] |
| 35. | Zhu J, Wang Y, Yu Y, Wang Z, Zhu T, Xu X, Liu H, Hawke D, Zhou D, Li Y. Aberrant fucosylation of glycosphingolipids in human hepatocellular carcinoma tissues. Liver Int. 2014;34:147-160. [PubMed] [DOI] |
| 36. | Wu CS, Yen CJ, Chou RH, Li ST, Huang WC, Ren CT, Wu CY, Yu YL. Cancer-associated carbohydrate antigens as potential biomarkers for hepatocellular carcinoma. PLoS One. 2012;7:e39466. [PubMed] [DOI] |
| 37. | Chen BW, Chen W, Liang H, Liu H, Liang C, Zhi X, Hu LQ, Yu XZ, Wei T, Ma T. Inhibition of mTORC2 Induces Cell-Cycle Arrest and Enhances the Cytotoxicity of Doxorubicin by Suppressing MDR1 Expression in HCC Cells. Mol Cancer Ther. 2015;14:1805-1815. [PubMed] [DOI] |
| 38. | Liu M, Gu P, Guo W, Fan X. C6 ceramide sensitizes the anti-hepatocellular carcinoma (HCC) activity by AZD-8055, a novel mTORC1/2 dual inhibitor. Tumour Biol. 2016;37:11039-11048. [PubMed] [DOI] |
| 39. | Ordoñez R, Fernández A, Prieto-Domínguez N, Martínez L, García-Ruiz C, Fernández-Checa JC, Mauriz JL, González-Gallego J. Ceramide metabolism regulates autophagy and apoptotic cell death induced by melatonin in liver cancer cells. J Pineal Res. 2015;59:178-189. [PubMed] [DOI] |
| 40. | Cheng L, Chen YZ, Peng Y, Yi N, Gu XS, Jin Y, Bai XM. Ceramide production mediates cinobufotalin-induced growth inhibition and apoptosis in cultured hepatocellular carcinoma cells. Tumour Biol. 2015;36:5763-5771. [PubMed] [DOI] |
| 41. | Erkhembayar S, Mollbrink A, Eriksson LC. The effect of sodium selenite on liver growth and thioredoxin reductase expression in regenerative and neoplastic liver cell proliferation. Biochem Pharmacol. 2012;83:687-693. [PubMed] [DOI] |
| 42. | Chatzakos V, Rundlöf AK, Ahmed D, de Verdier PJ, Flygare J. Inhibition of sphingosine kinase 1 enhances cytotoxicity, ceramide levels and ROS formation in liver cancer cells treated with selenite. Biochem Pharmacol. 2012;84:712-721. [PubMed] [DOI] |
| 43. | Ji Q, Zheng GY, Xia W, Chen JY, Meng XY, Zhang H, Rahman K, Xin HL. Inhibition of invasion and metastasis of human liver cancer HCCLM3 cells by portulacerebroside A. Pharm Biol. 2015;53:773-780. [PubMed] [DOI] |
| 44. | Marí M, Fernández-Checa J. Sphingolipid signalling and liver diseases. Liver Int. 2007;27:440-450. [PubMed] [DOI] |
| 45. | Osawa Y, Uchinami H, Bielawski J, Schwabe RF, Hannun YA, Brenner DA. Roles for C16-ceramide and sphingosine 1-phosphate in regulating hepatocyte apoptosis in response to tumor necrosis factor-alpha. J Biol Chem. 2005;280:27879-27887. [PubMed] [DOI] |