修回日期: 2018-05-22
接受日期: 2018-05-28
在线出版日期: 2018-07-28
从形态学和血流动力学的角度观察大鼠胆汁性肝硬化模型的特点.
采用胆总管结扎(common bile duct ligation, CBDL)的方法, 制作胆汁性肝硬化模型. 计算模型的肝、脾系数; Masson染色, 观察纤维组织再生的情况; 门静脉和股动脉插管测定大鼠的门静脉压力(portal pressure, PP)和平均动脉压力(mean arterial pressure, MAP).
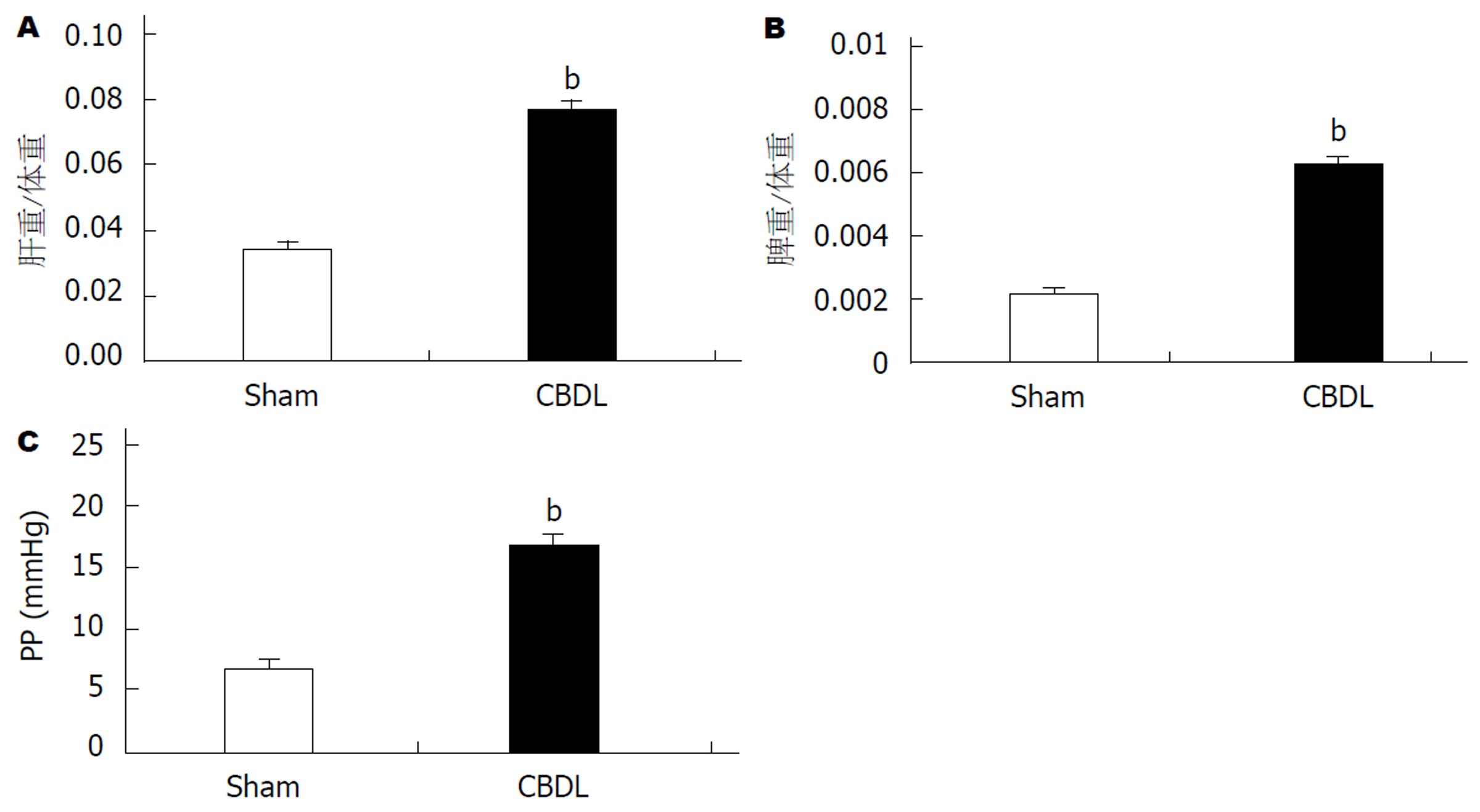
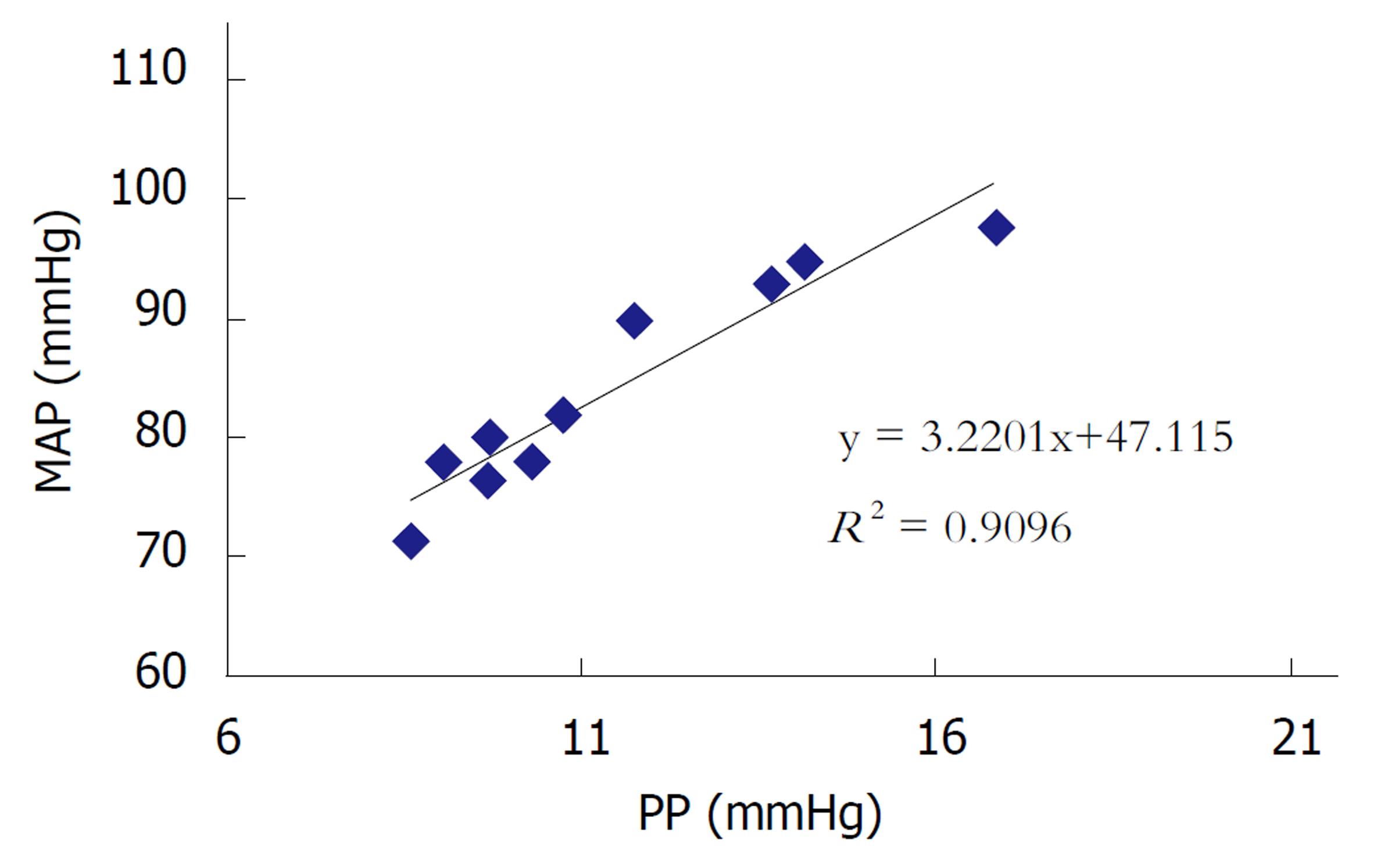
CBDL 4 wk以后, 肝脏体积增大, 颜色呈黄绿色, 部分肝脏表面有均匀的结节. Masson染色显示, 模型大鼠肝组织大量纤维组织增生, 形成假小叶. 血流动力学结果显示, 模型大鼠PP显著升高, MAP显著下降, PP与MAP呈现显著的正相关(R2 = 0.9096). 严重腹水大鼠PP显著低于轻度腹水大鼠.
大鼠CBDL 4 wk以后, 肝硬化形成. 门静脉压力受大鼠平均动脉压力和腹水程度的影响.
核心提要: 与既往研究不同的是, 本研究显示, 4 wk胆汁性肝硬化模型门静脉压力并不一定持续升高, 而是受到肝硬化程度、体循环平均动脉压力和腹水严重程度等多种因素的影响, 旨在为该模型应用提供参考.
引文著录: 杜庆红, 徐雅, 刘芳, 李姝玉, 汤轶波. 大鼠胆汁性肝硬化模型的血流动力学特点. 世界华人消化杂志 2018; 26(21): 1295-1300
Revised: May 22, 2018
Accepted: May 28, 2018
Published online: July 28, 2018
To elucidate the hemodynamic characteristics of biliary cirrhosis in common bile duct ligated rats.
Biliary cirrhosis was induced in rats by common bile duct ligation (CBDL). Rats were divided into a sham group and a CBDL group. At the end of 4 weeks, portal pressure (PP) and mean arterial pressure (MAP) were measured directly via catheters. Liver or spleen coefficient was the ratio of liver weight or spleen weight to body weight. Proliferation of fibrous tissue was evaluated by Masson staining.
At the end of 4 wk, the liver of CBDL rats was yellow in color and enlarged. The surface of some livers was scattered with numerous nodules. Masson staining indicated extensive proliferation of fibrous tissue and pseudolobule. PP of CBDL rats was increased and MAP was decreased compared with sham rats. There was a significant positive correlation between PP and MAP (R2 = 0.9096). PP of rats with severe ascites was lower than that of rats with mild or no ascites.
After 4 wk of CBDL, liver cirrhosis and portal hyper-tension develop. PP is determined by the degree of ascites and MAP.
- Citation: Du QH, Xu Y, Liu F, Li SY, Tang YB. Hemodynamic characteristics of biliary cirrhosis in rats. Shijie Huaren Xiaohua Zazhi 2018; 26(21): 1295-1300
- URL: https://www.wjgnet.com/1009-3079/full/v26/i21/1295.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i21.1295
胆汁性肝硬化又名胆汁淤积性肝损伤或者胆汁淤积性肝硬化. 该模型是胆总管结扎(common bile duct ligation, CBDL)导致胆汁淤积在肝内, 从而引起肝硬化的一种方法[1]. 由于该模型导致肝硬化时间短(4-6 wk), 病变广泛, 对术者本身不会造成损伤, 所以是研究肝纤维化或者肝硬化的经典模型之一[1-3]. 对于这种广泛应用的动物模型, 有多篇文章描述此模型的制作过程[4-7], 但是鲜有文章对此模型与肝硬化相关的指标参数进行综合分析. 因此, 本文从形态学和血流动力学的角度观察该模型的特点, 旨在为该模型的应用提供参考.
雄性SD大鼠30只, 清洁级, 体重250 g±10 g, 购于北京维通利华实验动物公司. 动物许可证号: 北京市动管第SCXK(京)2002-0003号. 笼具用过氧乙酸溶液消毒. 大鼠饲养和实验均在清洁级动物实验室内进行, 合格证号: SYXK(京)2006-0012.
1.2.1 模型制作以及分组: 采用10%水合氯醛腹腔内注射(4 mL/kg)麻醉大鼠. 手术组大鼠分离胆总管, 分别用1.0丝线结扎两道, 然后在两个结扎线之间剪断[8,9]. 假手术组大鼠只暴露胆总管. 术后肌注青霉素预防感染. 手术过程严格按照无菌操作的要求.
大鼠适应性喂养1 wk后, 根据体重随机分为假手术组和模型组.
1.2.2 腹水: 大鼠麻醉打开腹腔, 用注射器抽取腹水, 并记录腹水体积.
1.2.3 血流动力学指标的测定: 大鼠称重, 在10%水合氯醛麻醉下打开腹腔. 回肠静脉末端插入充满肝素生理盐水的PE50导管, 缓慢进入门静脉主干, 测定门静脉压力(portal pressure, PP). 股动脉插管测定平均动脉压力(mean arterial pressure, MAP). 本研究测压仪器为BL-420E生物机能实验系统(成都泰盟科技有限公司). 持续测定压力30 min, 以最后10 min的平均压力作为PP和MAP的观察数据, 在测定压力过程中时刻注意大鼠的呼吸状态.
统计学处理 以"mean±SD"表示各组动物的指标计量数据, 应用SPSS11.5中的One-Way ANOVA比较计量资料的组间差别, 以P<0.05表示统计学上有统计学差异, P<0.01为统计学上有显著性差异.
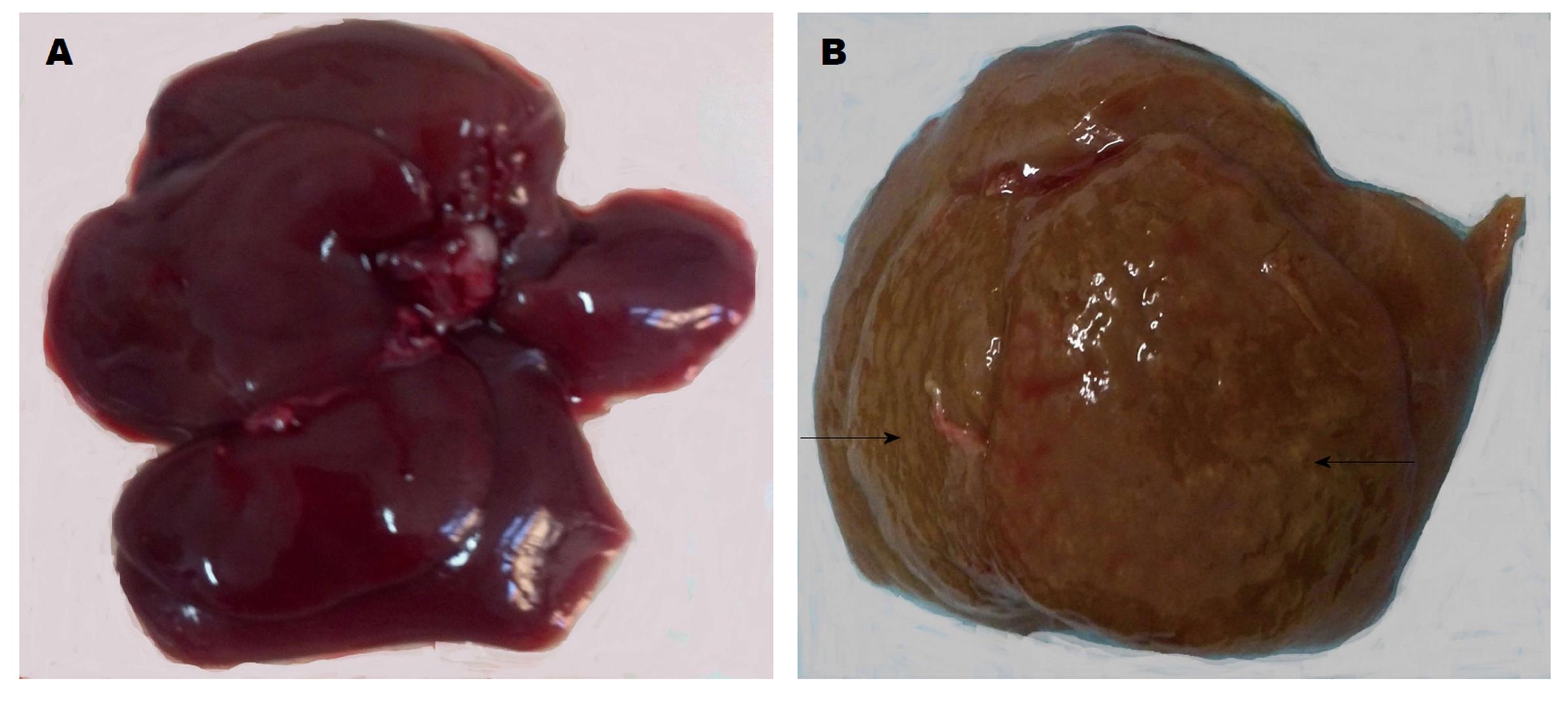
不同于人肝脏, 大鼠肝脏分为6叶. 正常肝脏暗红色, 边缘锐利. CBDL 4 wk以后, 肝脏各叶之间有黏连, 体积明显增大, 颜色呈现黄绿色, 部分肝脏表面可见到大小不等的结节(图1).
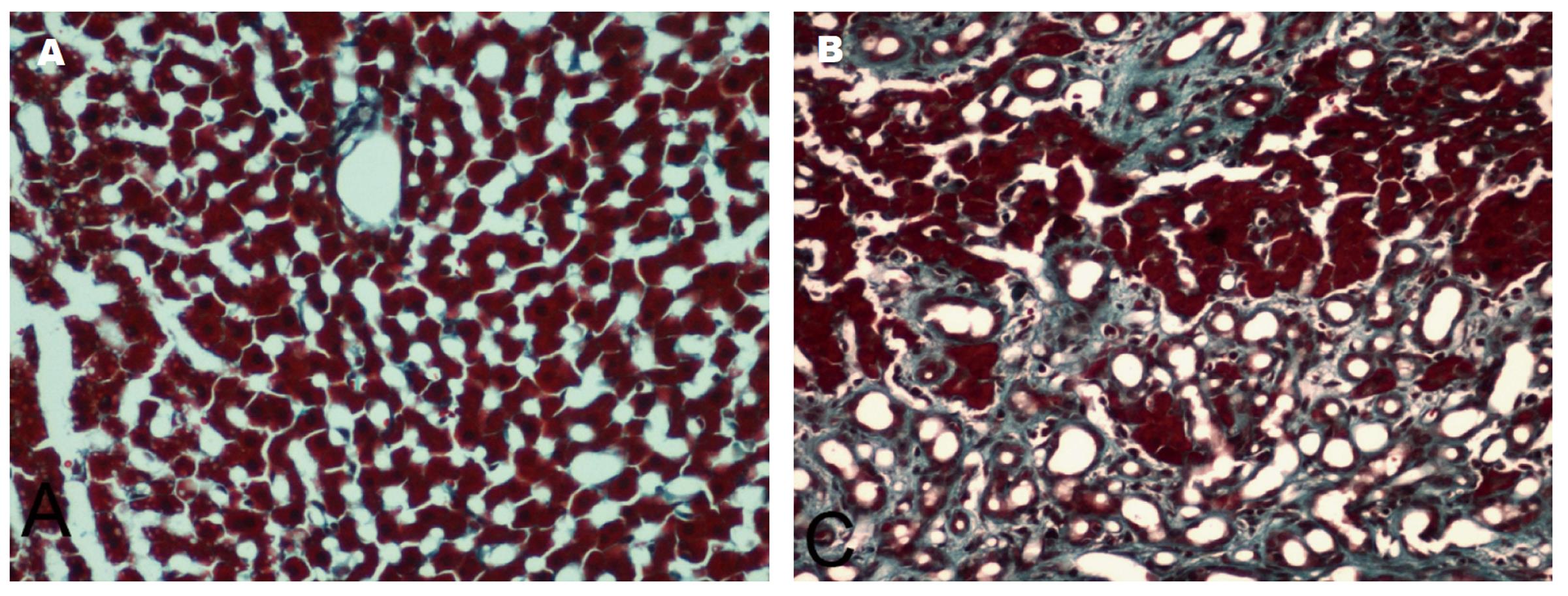
结果显示, 假手术组, 仅在中央静脉和汇管区周围有少量纤维结缔组织. CBDL 4 wk以后, 纤维结缔组织大量增生, 并且相互连接, 将正常肝组织重新分隔, 包绕, 形成假小叶(图2).
CBDL 4 wk以后, CBDL大鼠门静脉压力明显升高, 与假手术组比较有显著统计学差异(P<0.01). 相关性分析显示, PP与MAP呈现显著的正相关(R2 = 0.9096)(图3C和图4).
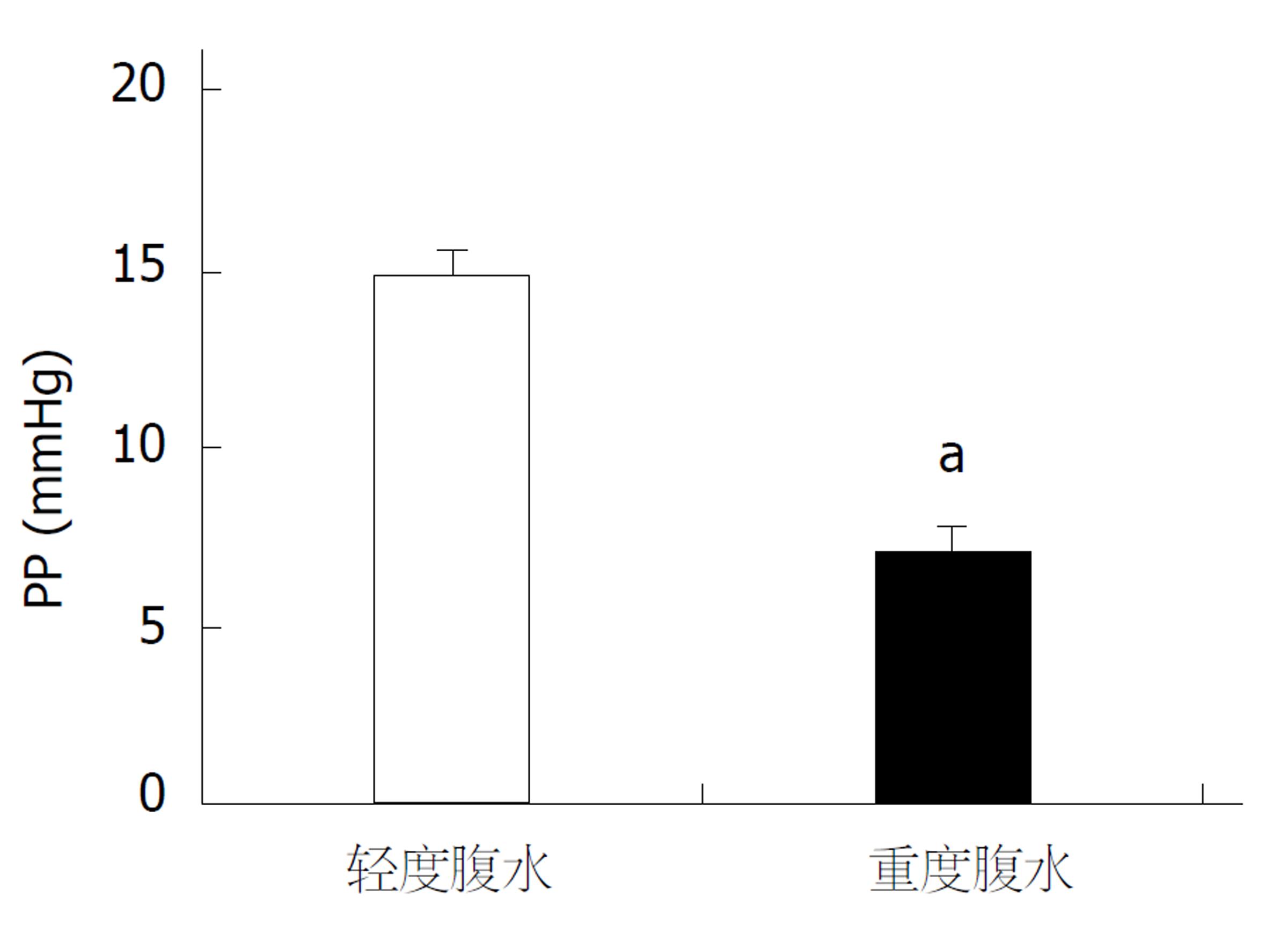
以腹水量少于5 mL为少量腹水, 腹水量大于5 mL为大量腹水. 严重腹水大鼠整体消瘦, 门静脉压力低于轻度腹水大鼠, 有统计学差异(P<0.05)(图5).
胆汁性肝硬化模型是研究肝硬化的常用动物模型之一. 既往研究显示, CBDL4 wk以后, 随着胆汁淤积加重, 肝细胞大片坏死, 纤维结缔组织广泛增生, 并形成肝硬化的特征性病变-假小叶[10-12]. 因此, 本文选取4 wk的时间点, 从形态学和血流动力学的角度对该模型的特点进行综合分析.
CBDL组共有大鼠12只, 期中11只出现腹水, 并且6只大鼠腹水量超过5 mL. 形态学观察显示, 与正常肝脏比较, CBDL大鼠肝脏呈现黄绿色, 质地变硬, 部分肝脏表面有均匀的结节. 与之相对应, Masson染色显示, CBDL肝组织内有广泛的纤维结缔组织增生. 增生的结缔组织相互连接, 重新分割肝组织, 形成假小叶. CBDL大鼠肝脏和脾脏体积明显增大, 重量增加, 肝脏系数和脾脏系数升高, 与假手术组比较有显著统计学差异.
除了形态学的结果, 我们还观察了CBDL大鼠在肝硬化阶段PP和MAP的变化. 结果显示, CBDL大鼠PP显著升高, MAP显著下降, 并且PP与MAP呈现显著正相关(R2 = 0.9096). 并且, 腹水量超过5 mL的大鼠, 门静脉压力普遍低于腹水量少于5 mL的大鼠, 由此推断腹水程度是影响门静脉压力高低的因素之一. 因此, 此文中以腹水量大于5 mL界定为严重腹水, 低于5 mL为轻度腹水. 严重腹水的大鼠, 导致血容量下降, 因此体循环MAP下降. 当血容量下降的影响超过引起PP升高的因素(肝内血管阻力)时, 此时门静脉压力不升反降[13-16].
临床上直接测定门静脉压力会对患者造成创伤, 并且大部分肝硬化病人有出血倾向, 因此以测定肝静脉压力梯度值(hepatic venous pressure gradient, HVPG)代替门静脉压力. HVPG是经颈静脉插管测定肝静脉锲入压与游离压, 两者之差即为HVPG, 反映门静脉压力的大小[17]. 研究认为, HVPG值与静脉曲张程度、出血风险以及肝功能有良好的相关性. HVPG值越大, 患者静脉曲张程度越重, 出血风险越大, 肝功能越差, 病情越严重[18-23]. 那么, 在肝纤维化发展至肝硬化, 肝硬化由轻到重的过程中, 门静脉压力是持续升高的吗?结合本次实验结果, 我们发现, 肝硬化发展过程中, 门静脉压力受到包括整体动脉压力和腹水在内的多种因素的影响. 从纤维化到肝硬化阶段, 门静脉压力持续升高. 但是随着肝硬化加重, 整体状况恶化, 伴随大量腹水, 此时门静脉压力下降. 在CBDL模型的发现是否能反映到肝硬化患者, 目前还没有报道.
虽然CBDL模型能够复制肝硬化的病变特点, 但是在应用过程中也发现该模型存在一定的局限性. CBDL模型不稳定, 大鼠之间的病变不均一, 还受到操作者熟练程度的影响[5]. 本文所显示的CBDL大鼠是较为典型的病变, 还有一少部分大鼠, 肝脏呈现淡黄色, 镜下结缔组织增生, 但是肝脏表面没有结节. 甚至少量CBDL大鼠, 肝脏完全恢复正常, 推测原因为胆管再通所致[24-26].
总之, CBDL模型作为研究肝硬化的经典模型, 能够反映肝硬化的典型病变特点, 该模型门静脉压力受到MAP和腹水量的影响. 但是, 由于模型稳定性差, 并且受操作者熟练程度的影响, 在应用时要慎重考虑.
胆汁性肝硬化模型是研究肝纤维化或者肝硬化的经典模型之一. 对于这种广泛应用的动物模型, 鲜有文章对此模型与肝硬化相关的指标参数进行综合分析.
本篇论文是从形态学和血流动力学的角度观察胆汁性肝硬化模型的特点, 旨在为该模型的应用, 尤其是在研究肝硬化门脉高压症血流动力学的变化时提供参考.
本项研究的主要目标是分析胆汁性肝硬化模型4 wk血流动力学指标的变化, 尤其是门静脉压力的改变. 研究发现4 wk模型门静脉压力并不一定持续升高, 而是受到肝硬化程度、体循环平均动脉压力和腹水严重程度等多种因素的影响.
本项研究采用了形态学观察, 包括大体观察和Masson染色; 应用门静脉和颈动脉插管观察门静脉压力和平均动脉压力的变化. 应用统计学方法, 进行不同指标之间的相关性分析. 通过运用不同方法, 在多层次、多角度探索该模型的特点.
胆总管结扎(common bile duct ligation, CBDL) 4 wk以后, 肝脏体积增大,部分肝脏表面有均匀的结节. Masson染色显示, 模型大鼠肝组织大量纤维组织增生并形成肝硬化的特征病变-假小叶. 血流动力学结果显示, 模型大鼠门静脉压力(portal pressure, PP)显著升高, 平均动脉压力(mean arterial pressure, MAP)显著下降, PP与MAP呈现显著的正相关. 严重腹水大鼠PP显著低于轻度腹水大鼠.
大鼠CBDL 4 wk以后, 肝硬化形成. 门静脉压力不仅和肝内血管阻力有关,还受到体循环平均动脉压力和腹水程度的影响.
CBDL模型作为研究肝硬化的经典模型, 能够反映肝硬化的典型病变特点. 但是, 由于模型稳定性差, 并且受操作者熟练程度的影响, 在应用时要慎重考虑.
学科分类: 胃肠病学和肝病学
手稿来源地: 北京市
同行评议报告分类
A级 (优秀): A
B级 (非常好): B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑:马亚娟 电编:张砚梁
| 1. | Zhao G, Hatting M, Nevzorova YA, Peng J, Hu W, Boekschoten MV, Roskams T, Muller M, Gassler N, Liedtke C. Jnk1 in murine hepatic stellate cells is a crucial mediator of liver fibrogenesis. Gut. 2014;63:1159-1172. [PubMed] [DOI] |
| 2. | Hsu SJ, Lin TY, Wang SS, Chuang CL, Lee FY, Huang HC, Hsin IF, Lee JY, Lin HC, Lee SD. Endothelin receptor blockers reduce shunting and angiogenesis in cirrhotic rats. Eur J Clin Invest. 2016;46:572-580. [PubMed] [DOI] |
| 3. | Wu KC, Huang HC, Chang T, Lee WS, Chuang CL, Hsin IF, Hsu SJ, Lee FY, Chang CC, Lee SD. Effect of sirolimus on liver cirrhosis and hepatic encephalopathy of common bile duct-ligated rats. Eur J Pharmacol. 2018;824:133-139. [PubMed] [DOI] |
| 4. | Tag CG, Sauer-Lehnen S, Weiskirchen S, Borkham-Kamphorst E, Tolba RH, Tacke F, Weiskirchen R. Bile duct ligation in mice: induction of inflammatory liver injury and fibrosis by obstructive cholestasis. J Vis Exp. 2015;96:e52438-e52438. [PubMed] [DOI] |
| 5. | Tag CG, Weiskirchen S, Hittatiya K, Tacke F, Tolba RH, Weiskirchen R. Induction of experimental obstructive cholestasis in mice. Lab Anim. 2015;49:70-80. [PubMed] [DOI] |
| 6. | Rahimi N, Hassanipour M, Allahabadi NS, Sabbaghziarani F, Yazdanparast M, Dehpour A. Cirrhosis induced by bile duct ligation alleviates acetic acid intestinal damages in rats: Involvements of nitrergic and opioidergic systems. Pharmacol Rep. 2017;70:426-433. [PubMed] [DOI] |
| 8. | Ho HL, Huo TI, Chang T, Lee WS, Hsin IF, Lee FY, Huang HC, Hou MC, Lee SD. Ascorbate lacks significant influence in rats with bile duct ligation-induced liver injury. J Chin Med Assoc. 2017;80:539-550. [PubMed] [DOI] |
| 9. | Gall JA, Bhathal PS. A quantitative analysis of the liver following ligation of the common bile duct. Liver. 1990;10:116-125. [PubMed] |
| 10. | Lee BS, Kim NJ, Jeong HY, Lee HY, Kang DY, Noh SM. Changes in serum cytokine concentration: a morphological study of liver cirrhosis induced by common bile duct ligation in rats. Korean J Intern Med. 2003;18:6-12. [PubMed] |
| 11. | 杜 庆红, 韩 琳, 姜 俊杰, 李 澎涛, 王 新月, 贾 旭. 肝络通对门静脉高压症大鼠肝组织纤维化的影响. 世界科学技术-中医药现代化. 2012;149:1631-1635. |
| 12. | Eguchi A, Koyama Y, Wree A, Johnson CD, Nakamura R, Povero D, Kneiber D, Tameda M, Contreras P, Spada A. Emricasan, a pan-caspase inhibitor, improves survival and portal hypertension in a murine model of common bile-duct ligation. J Mol Med (Berl). 1996;6:575-583. [PubMed] [DOI] |
| 13. | Heneghan MA, Harrison PM. Pathogenesis of ascites in cirrhosis and portal hypertension. Med Sci Monit. 2000;6:807-816. [PubMed] |
| 14. | Kayacetin E, Efe D, Doğan C. Portal and splenic hemodynamics in cirrhotic patients: relationship between esophageal variceal bleeding and the severity of hepatic failure. J Gastroenterol. 2004;39:661-667. [PubMed] |
| 15. | Olteanu D, Lupu D. The kidney in cirrhosis with portal hypertension. J Med Life. 2010;3:175-177. [PubMed] |
| 16. | A Erdogan M, R Benli A, B Acmali S, Koroglu M, Atayan Y, Danalioglu A, Kayhan B. Predictive Value of Mean Platelet Volume in Variceal Bleeding due to Cirrhotic Portal Hypertension. Euroasian J Hepatogastroenterol. 2017;7:6-10. [PubMed] [DOI] |
| 17. | Buechter M, Manka P, Theysohn JM, Reinboldt M, Canbay A, Kahraman A. Spleen stiffness is positively correlated with HVPG and decreases significantly after TIPS implantation. Dig Liver Dis. 2018;50:54-60. [PubMed] [DOI] |
| 18. | Albillos A, Bañares R, González M, Catalina MV, Pastor O, Gonzalez R, Ripoll C, Bosch J. The extent of the collateral circulation influences the postprandial increase in portal pressure in patients with cirrhosis. Gut. 2007;56:259-264. [PubMed] [DOI] |
| 19. | Vincent JK, Stark C, Shields JT, Bhave AD, Morris CS. Hepatic venous pressure gradient correlates with advanced hepatic fibrosis: a retrospective review. Abdom Radiol (NY). 2017;42:2609-2614. [PubMed] [DOI] |
| 20. | Sourianarayanane A, Talluri J, Humar A, McCullough AJ. Stage of fibrosis and portal pressure correlation in nonalcoholic steatohepatitis. Eur J Gastroenterol Hepatol. 2017;29:516-523. [PubMed] [DOI] |
| 21. | Ramanathan S, Khandelwal N, Kalra N, Bhatia A, Dhiman RK, Duseja AK, Chawla YK. Correlation of HVPG level with ctp score, MELD Score, ascites, size of varices, and etiology in cirrhotic patients. Saudi J Gastroenterol. 2016;22:109-115. [PubMed] [DOI] |
| 22. | Wadhawan M, Dubey S, Sharma BC, Sarin SK, Sarin SK. Hepatic venous pressure gradient in cirrhosis: correlation with the size of varices, bleeding, ascites, and child's status. Dig Dis Sci. 2006;51:2264-2269. [PubMed] |
| 23. | Ripoll C, Groszmann R, Garcia-Tsao G, Grace N, Burroughs A, Planas R, Escorsell A, Garcia-Pagan JC, Makuch R, Patch D. Hepatic venous pressure gradient predicts clinical decompensation in patients with compensated cirrhosis. Gastroenterology. 2007;133:481-488. [PubMed] [DOI] |
| 24. | De Aro Braz MJ, Corbi LE, Tannuri ACA, Coelho MCM, Gonçalves JO, Serafini S, Tannuri U. Analysis of the reversibility of biliary cirrhosis in young rats submitted to biliary obstruction. J Pediatr Surg. 2017;7:1408-1413. [PubMed] [DOI] |
| 25. | Aronson DC, Chamuleau RA, Frederiks WM, Gooszen HG, Heijmans HS, James J. Reversibility of cholestatic changes following experimental common bile duct obstruction: fact or fantasy? J Hepatol. 1993;18:85-95. [PubMed] |
| 26. | Abdel-Aziz G, Lebeau G, Rescan PY, Clément B, Rissel M, Deugnier Y, Campion JP, Guillouzo A. Reversibility of hepatic fibrosis in experimentally induced cholestasis in rat. Am J Pathol. 1990;137:1333-1342. [PubMed] |