修回日期: 2017-03-22
接受日期: 2017-04-11
在线出版日期: 2017-06-18
观察电针干预后, 对功能性消化不良(func-tional dyspepsia, FD)大鼠胃窦ghrelin、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)、磷酸化mTOR(phosphorylation mTOR, p-mTOR)表达的影响.
将36只大鼠按随机数字表随机分为空白组及造模组, 其中空白组10只, 雌雄各半. 将除空白组外的26只大鼠进行造模, 将造模成功的20只大鼠再随机分为模型组和电针组, 每组各10只, 雌雄各半. 造模方法均采用夹尾刺激法(每天2次, 14 d)配合不规则饮食(每逢周一、三、五禁食, 余日正常饮食)制备FD大鼠模型. 造模成功后, 电针组给予电针足三里进行干预, 1次/d, 共10 d. 干预结束后对3组大鼠进行解剖取胃部组织, 用Western blot分别检测各组大鼠胃窦ghrelin、mTOR、p-mTOR的表达水平.
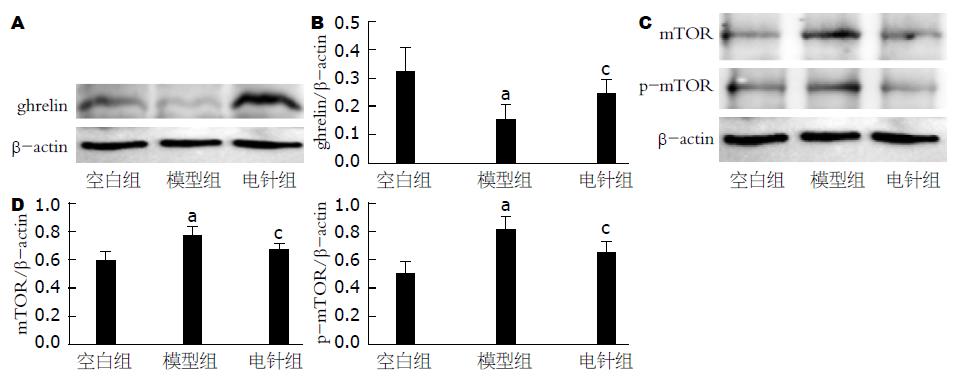
与空白组相比, 模型组大鼠胃窦ghrelin水平显著降低(0.15450±0.050145 vs 0.31550±0.83885, P<0.01), 电针干预后, FD大鼠胃窦组织中ghrelin水平明显升高(与模型组相比, 0.23930±0.53918 vs 0.15450±0.050145, P<0.05). 与空白组相比, 模型组大鼠mTOR、p-mTOR蛋白表达水平显著升高(mTOR/β-actin: 0.77190±0.070404 vs 0.59520±0.064768; p-mTOR/β-actin: 0.792±0.098164 vs 0.48620±0.101248, 均P<0.01); 与模型组相比, 电针干预组胃窦mTOR、p-mTOR表达水平明降低(mTOR/β-actin: 0.669±0.043726 vs 0.77190±0.070404; p-mTOR/β-actin: 0.6346±0.073699 vs 0.77190±0.070404, 均P<0.05).
电针干预后, 能够显著增加FD大鼠胃窦ghrelin表达水平, 以改善胃肠动力, 同时对mTOR、p-mTOR表达水平同样存在着显著影响, 提示mTOR及其磷酸化可能在电针促进ghrelin的分泌的过程中起重要的作用, 从而调节胃肠道的活动.
核心提要: 本文通过观察电针后对功能性消化不良(functional dyspepsia, FD)大鼠胃窦ghrelin、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)、磷酸化mTOR表达的影响, 以明确电针治疗FD的可能机制, 为电针治疗FD的机制提供新的线索.
引文著录: 康朝霞, 张红星, 徐派的, 王计雨, 韩永丽. 电针对功能性消化不良大鼠胃窦ghrelin及mTOR的影响. 世界华人消化杂志 2017; 25(17): 1553-1557
Revised: March 22, 2017
Accepted: April 11, 2017
Published online: June 18, 2017
To observe the effect of electro-acupuncture (EA) on the expression of ghrelin, mammalian target of rapamycin (mTOR) and phosphorylated mTOR (p-mTOR) in the gastric antrum of rats with functional dyspepsia (FD).
Thirty rats were randomly divided into a blank group (n = 10), a model group (n = 10), and an EA group (n = 10). Experimental FD was induced in rats of the model group and EA group by tail clamp stimulation twice a day for 14 d and giving an irregular diet (fasting every other day, with free access to water). After successful induction of FD, the EA group was given electro-acupuncture at Zusanli once a day for 10 d. The expression of ghrelin, mTOR and p-mTOR in the gastric antrum was detected by Western blot.
Compared with the blank group, the level of ghrelin in the gastric antrum was significantly decreased in the model group (0.15450 ± 0.050145 vs 0.31550 ± 0.83885, P < 0.01), but EA intervention significantly reduced the level of ghrelin in the gastric antrum of rats with FD compared with the model group (0.23930 ± 0.53918 vs 0.15450 ± 0.050145, P < 0.05). Compared with the blank group, the relative expression levels of mTOR and p-mTOR in the model group were increased (0.77190 ± 0.070404 vs 0.59520 ± 0.064768, 0.792 ± 0.098164 vs 0.48620 ± 0.101248, P < 0.05 for both). Compared with the model group, the relative expression levels of mTOR and p-mTOR in the antrum group were significantly lower in the EA group (0.669 ± 0.043726 vs 0.77190 ± 0.070404, 0.6346 ± 0.073699 vs 0.77190 ± 0.070404, P < 0.05 for both).
EA intervention can increase the expression of ghrelin in gastric antrum of FD rats, suggesting that EA intervention may increase the gastrointestinal motility. EA intervention can also decrease the expression of mTOR and p-mTOR, suggesting that mTOR and its phosphorylation may play an important role in the process that EA promotes the secretion of ghrelin, thereby regulating gastrointestinal activity.
- Citation: Kang ZX, Zhang HX, Xu PD, Wang JY, Han YL. Influence of electro-acupuncture on ghrelin and mTOR expression in the gastric antrum of rats with functional dyspepsia. Shijie Huaren Xiaohua Zazhi 2017; 25(17): 1553-1557
- URL: https://www.wjgnet.com/1009-3079/full/v25/i17/1553.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i17.1553
功能性消化不良(functional dyspepsia, FD)是消化系常见症候群, 其症状主要包括上腹痛、上腹烧灼感、餐后饱胀、早饱、恶心、呕吐等, 但无器质性病变[1]. 由于FD发病机制尚未有确切统一的定论, 且患者临床症状复杂多变, 药物治疗往往难以取得满意的疗效. 近年来, 应用针刺、电针等非药物疗法治疗FD, 经临床及动物实验证实[2-5], 疗效显著, 且具有经济、无不良反应等优势. Ghrelin是一种重要的胃肠激素, 与胃动素表现出许多相同的作用, 又被称为胃动素相关肽. Ghrelin有多种相关的调节因子, 其中哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)的研究备受关注. 本课题采用临床常用的电针疗法, 以FD大鼠为受试对象, 观察电针对FD大鼠ghrelin及mTOR表达的影响, 初步探讨电针治疗FD的机制, 为针灸治疗FD提供全新的研究资料及线索.
选用SPF级Sprague Dawley大鼠36只, 雌雄各半, 体质量(200 g士20 g), 由湖北实验动物研究中心提供, 许可证号: SCXK(鄂2011-0012). 经湖北中医药大学实验动物福利委员会许可, 饲养于SPF动物房, 室温22 ℃, 相对湿度50%-70%. 每5只单笼饲养, 适应性喂养1 wk后开始实验, 适应性喂养期间自由饮水、摄食. Rabbit anti-mTOR antibody(购自CST公司#2983); Rabbit anti-p-mTOR(SER2448) antibody(购自CST公司#5536); Rabbit anti-GHRL antibody(购自PTG公司#13309); Goat Anti Rabbit IgG/辣根过氧化物酶(horseradish peroxidase, HRP)(天津三箭, Catalog#LK2001); 泳电源DYY-6C型电源由北京六一仪器厂生产; 迷你电泳槽(北京六一Catalog #DYZC-24DN); 转膜芯(北京六一Catalog #DYZC-40D); PVDF膜Millipore(CAT.NO.IPVH00010); 滤纸(Whatman, 3MM CHR); 华佗牌32号25 mm(1寸), 无菌针灸针(苏州医疗用品有限公司), HANS-200A韩式穴位神经刺激仪(南京济生医疗科技有限公司).
1.2.1 动物分组及造模: 将36只大鼠按随机数字表随机分为空白组及造模组, 其中空白组10只, 雌雄各半. 将除空白组外的26只大鼠进行造模, 将造模成功的20只大鼠再随机分为模型组和电针组, 每组各10只, 雌雄各半. 造模方法参考相关文献采用夹尾刺激配合不规则饮食制备FD大鼠模型[6]. 将每组同笼大鼠用长海绵摄子钳夹大鼠尾巴末端1/3处, 以令其尖叫挣扎但不破皮为度(如有抓伤破皮, 则用0.5%碘伏消毒受伤部位, 以防感染), 使其暴怒并和其他大鼠厮打, 每次持续30 min, 每天2次(分别在9:00, 16:00), 连续刺激14 d; 同时每逢周一、三、五禁食, 余日给予220 g饲料, 正常饮水, 每日每笼给予400 mL水. 造模大鼠出现毛发枯燥无光泽、变黄, 饮食及饮水明显减少, 情绪低落, 活动减少, 扎堆甚至倦卧, 伴易怒或抑郁状态, 提示造模成功.
1.2.2 电针干预方法: 电针组大鼠造模成功后, 给予电针干预. 将电针组大鼠用自制鼠衣束缚后, 悬挂于自制悬挂装置上, 选取大鼠"足三里"穴, 定位参照《大鼠穴位图谱的研制》[7]. 用1寸毫针(规格: 32号, 25 mm)针刺大鼠双侧"足三里"穴0.3-0.5寸, 进针得气后, 接韩式电针仪, 电针参数: 疏密波, 频率2 Hz/100 Hz, 强度2 mA, 每次30 min, 1次/d, 共10 d. 在电针组进行电针干预的同时, 将空白组与模型组大鼠与电针组一样束缚固定, 但不进行针刺及电针干预.
1.2.3 取材: 胃组织取材: 电针干预10 d后, 将3组大鼠禁食24 h, 正常饮水. 予以7%水合氯醛以0.5 mL/100 g的剂量进行腹腔注射麻醉, 大鼠麻醉后固定于自制鼠板上, 结扎胃贲门和幽门, 然后沿胃大弯剪开胃体, 洗去胃内容物后拭干, 剪取胃窦部分放于冻存管中, 并立即置于液氮中迅速冻存, 放置-80 ℃冰箱中待测.
1.2.4 指标检测: 用Western blot检测胃组织中ghrelin及mTOR、p-mTOR蛋白表达水平. 方法: 取100 mg组织, 匀浆, 离心(9000 rpm, 10 min)后, 取适量上清置于离心管中, -80 ℃保存. 采用BCA法测蛋白浓度, 电泳完成后进行转膜: 将PAGE凝胶中的蛋白质电转移至硝酸纤维素膜上, 电转完毕后, 将电转膜置于5%的脱脂奶粉(TBST配制)中封闭, 磷酸化指标用5%的BSA(TBST配制)封闭, 37 ℃ 1 h. 封闭的膜用TBST漂洗2次. 采用一抗(1:1000的稀释比)孵育4 ℃过夜, 弃去一抗, 经TBST洗涤5 min×4次后, 加入1:10000稀释的HRP标记的羊抗兔IgG室温于摇床孵育2 h, 弃去二抗, TBST洗涤5 min×4次. 将膜放入荧光化学发光凝胶成像系统, 将ELC均匀加到膜的表面, 成像得到图片.
统计学处理 采用SPSS17.0软件进行统计学分析. 全部数据用mean±SD表示. 首先进行正态性、方差齐性检验, 经分析符合正态分布及方差齐性, 采用单因素方差分析进行多组间比较分析, 进一步的组间两两比较用LSD检验, P<0.05为差异有统计学意义.
如图1A和1B所示, 与空白组相比, 模型组大鼠ghrelin蛋白表达水平显著下降(P<0.01), 说明造模后大鼠胃窦中ghrelin表达水平降低; 与模型组相比, 电针干预组胃窦ghrelin表达水平明显升高(P<0.05), 说明电针干预后, 能够升高FD大鼠的ghrelin的表达水平, 从而改善胃肠道动力.
如图1C、1D所示: 与空白组相比, 模型组大鼠mTOR、p-mTOR蛋白表达水平显著升高(P<0.01); 与模型组相比, 电针干预组胃窦mTOR、p-mTOR表达水平降低(P<0.05), 说明电针干预后, 能够减少FD大鼠的mTOR的表达水平, 并且能够减少其磷酸化水平.
FD属于临床常见病、慢性病, FD症状反复而持久, 影响着患者的生活质量, 已逐渐成为严重危害人类健康的常见疾病. 流行病学资料显示, 世界范围内人群消化不良的发病率达10%-30%[8]. 特别是近年来, FD的发病率在中国日益升高, 危害更是不容忽视. FD的发病机制目前尚不明确, 目前比较公认的一种说法, 即FD是胃动力障碍、内脏高敏感性及心理异常等多种因素综合作用的结果[9]. 目前临床对FD的治疗, 主要采用促胃肠动力、内脏感觉调节、抗焦虑和抑郁等药物治疗[10]. 目前, 药物的治疗由于药物自身的局限性及明显的不良反应, 并没有取得满意疗效. 课题组长期从事针灸防治功能性胃肠病的研究, 在以往的临床研究中, 我们发现, 针刺治疗FD, 在综合疗效及症状疗效指数方面, 明显优于西药, 针刺能够有效的缓解患者临床症状[11]. 并且我们在大量动物实验中发现, 用电针干预FD大鼠, 电针在改善FD大鼠胃排空、小肠推进率方面明显优于模型组[12-14]. 基于电针对FD的有效治疗作用, 有关电针治疗FD的研究受到广泛关注, 尤其有关电针对脑肠肽的调节作用及其机制成为关注的焦点. 本研究在以往研究的基础上, 观察电针对FD大鼠胃窦组织ghrelin及mTOR表达的影响, 为电针治疗FD的机制提供新的线索.
Ghrelin作为近10年新发现的脑肠肽, 以其独特的分子结构与生物学功能, 在机体的重要生命功能的生理活动和代谢平衡中发挥着不可或缺的作用. Ghrelin是一种重要的胃肠激素, 是目前唯一的生长激素释放激素受体(growth hormone secretagogue receptor, GHSR)的内源性配体, 具有控制食欲、刺激生长激素的释放、促进胃排空、增强胃动力等作用[15,16]. 胃黏膜内分泌细胞(主要为X/A样细胞)可以分泌ghrelin, ghrelin广泛分布于人体各个组织中, ghrelin mRNA在人的胃底部表达水平最高[17]. 在酰基化和去酰基化2种ghrelin形式中, 酰基化ghrelin是其主要的活性形式. 只有酰基化ghrelin通过结合其受体GHSR-1a后活化信号传导通路以发挥其生物学作用. 其酰基化过程由ghrelin酰基转移酶(ghrelin O-Acyltrasferase, GOAT)来完成. GOAT广泛分布于胃肠道, 在胃黏膜的表达有着高度特异性[18,19]. 关于ghrelin在胃肠动力学中的调节机制, 一直是研究FD方面的热点.
Ghrelin有多种相关的调节因子, 其中mTOR的研究备受关注. mTOR是一种高度保守的丝氨酸/苏氨酸蛋白激酶, 能通过感知能量稳态的变化来调节细胞周期进程和细胞生长, 调控细胞内多种蛋白的合成、自噬、增殖等过程[20]. 研究[21]发现在大鼠胃黏膜组织中mTOR信号途径的相关蛋白与ghrelin有着共定位现象, 影响着中枢神经系统调节食物摄取.
在此项实验中, 电针干预组的ghrelin表达水平明显高于模型组, 说明电针干预后可以提高ghrelin的表达水平, 从而改促进胃动力. 同时模型组大鼠中mTOR、p-mTOR的水平明显高于空白组及电针干预组, 表明在FD大鼠细胞中存在异常磷酸化的mTOR. 经过电针干预后, 大鼠胃窦mTOR、p-mTOR明显降低, 同时ghrelin水平明显升高. 本研究结果表明, 电针对FD的干预作用与ghrelin表达的变化有着密切的关联, 电针干预通过上调ghrelin的表达改善胃动力; 另一方面, ghrelin表达的变化可能与mTOR的密切相关, mTOR及磷酸化mTOR可能在电针促进ghrelin分泌的过程中发挥重要的作用, 但具体的机制还有待进一步研究.
功能性消化不良(functional dyspepsia, FD)属于临床常见病, 在人群中的发病率较高, 给患者、家庭和社会带来较重的精神、生活和经济负担, 目前西医无特效药, 疗效不理想, 而针刺治疗FD历史悠久, 疗效显著, 在临床上的运用已经较为成熟.
目前有关针灸治疗FD的研究多是临床疗效观察, 对其治疗机制的研究较少. Ghrelin作为新发现的脑肠肽, 成为目前研究的热点, 但是目前有关FD的发病机制及电针治疗FD的具体机制, 至今尚未阐明, 是亟待研究的问题.
关于ghrelin在胃肠动力学中的调节机制, 一直是研究FD方面的热点. Ghrelin有多种相关的调节因子, 其中哺乳动物雷帕霉素靶蛋白(mammaliantarget of rapamycin, mTOR)的研究备受关注. Xu等发现在大鼠胃黏膜组织中mTOR信号途径的相关蛋白与ghrelin有着共定位现象, 影响着中枢神经系统调节食物摄取.
本研究以ghrelin、mTOR为研究切入点, 观察电针后胃窦组织的ghrelin、mTOR及磷酸化mTOR (phosphorylation mTOR, p-mTOR)表达的影响, 以探讨电针治疗FD的可能的机制, 为电针治疗FD的机制提供全新的线索.
电针干预, 能够增加胃窦组织中ghrelin的水平, 同时降低胃窦mTOR及p-mTOR的表达, 为电针治疗FD的临床疗效提供更多的实验依据, 同时也为电针治疗FD的机制提供了新的数据.
Ghrelin: 是1999年Kojima等发现的生长激素促分泌激素受体的内源性配体, 是由28个氨基酸组成的一种脑肠肽, 他 在体内主要由胃X/A样细胞分泌. 除了可以刺激生长激素释放以外, ghrelin与胃肠道功能、能量代谢、免疫因子、心血管系统, 甚至肿瘤等密切关系.
陈卫昌, 教授, 苏州大学附属第一医院消化内科; 严兴科, 教授, 甘肃中医药大学针灸推拿学院, 甘肃省针灸推拿临床医学中心; 张红杰, 教授, 主任医师, 南京医科大学第一附属医院(江苏省人民医院)消化科
FD临床常见疾病之一, 穴位性刺激可改善FD症状, 机制尚不清楚, 该研究初步探讨了针刺后对FD样鼠症状, 及调控胃动力的相关胃肠肽ghrelin及mTOR影响, 发现穴位电针刺激可改善模型鼠症状、升高ghrelin, 减低mTOR表达, 为进一步探讨针刺治疗FD机制提供一定依据.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
编辑:马亚娟 电编:李瑞芳
| 1. | Tack J, Talley NJ, Camilleri M, Holtmann G, Hu P, Malagelada JR, Stanghellini V. Functional gastroduodenal disorders. Gastroenterology. 2006;130:1466-1479. [PubMed] [DOI] |
| 7. | 林 文注, 王 佩. 实验针灸学. 第1版. 上海: 上海科学技术出版社 1999; 88-89. |
| 8. | Voiosu TA, Giurcan R, Voiosu AM, Voiosu MR. Functional dyspepsia today. Maedica (Buchar). 2013;8:68-74. [PubMed] |
| 10. | Brun R, Kuo B. Functional dyspepsia. Therap Adv Gastroenterol. 2010;3:145-164. [PubMed] [DOI] |
| 15. | Ohno T, Mochiki E, Kuwano H. The roles of motilin and ghrelin in gastrointestinal motility. Int J Pept. 2010;2010:pii 820794. [PubMed] [DOI] |
| 16. | Yagi T, Asakawa A, Ueda H, Miyawaki S, Inui A. The role of ghrelin in patients with functional dyspepsia and its potential clinical relevance (Review). Int J Mol Med. 2013;32:523-531. [PubMed] [DOI] |
| 18. | Ohgusu H, Takahashi T, Kojima M. Enzymatic characterization of GOAT, ghrelin O-acyltransferase. Methods Enzymol. 2012;514:147-163. [PubMed] [DOI] |
| 19. | Lim CT, Kola B, Korbonits M. The ghrelin/GOAT/GHS-R system and energy metabolism. Rev Endocr Metab Disord. 2011;12:173-186. [PubMed] [DOI] |
| 20. | Laplante M, Sabatini DM. mTOR signaling in growth control and disease. Cell. 2012;149:274-293. [PubMed] [DOI] |
| 21. | Xu G, Li Y, An W, Li S, Guan Y, Wang N, Tang C, Wang X, Zhu Y, Li X. Gastric mammalian target of rapamycin signaling regulates ghrelin production and food intake. Endocrinology. 2009;150:3637-3644. [PubMed] [DOI] |