修回日期: 2015-11-03
接受日期: 2015-11-09
在线出版日期: 2015-12-08
目的: 分析45例胰腺癌及其配对癌旁正常石蜡包埋组织中miR216a的表达情况, 检测miR216a的作用靶基因JAK2、CSK的蛋白表达水平, 并分析miR216a及JAK2、CSK蛋白表达水平与临床病理特征的关系, 及其相关性.
方法: 锁定核酸原位杂交法测定胰腺癌及癌旁正常组织中miR216a的表达, 免疫组织化学法测定JAK2、CSK蛋白的表达, 并分析miR-216a与JAK2、CSK之间的相关性, 及其与胰腺癌临床病理指标的关系.
结果: 锁定核酸原位杂交法测定的miR216a在胰腺癌组织中的阳性表达率为37.8%(17/45), 癌旁正常组织的阳性表达率为71.1%(32/45), 差异具有统计学意义(χ2 = 10.080, P<0.05); 免疫组织化学法测定胰腺癌组织中JAK2蛋白的阳性表达率为60%(27/45), 癌旁正常组织为35.6%(16/45), 差异具有统计学意义(χ2 = 5.388, P<0.05); CSK在胰腺癌中的阳性表达率为17.8%(8/45), 癌旁正常组织为73.3%(33/45), 差异具有统计学意义(χ2 = 27.999, P<0.05). miR216a的表达水平与胰腺癌的TNM分期有关, 而与患者年龄、性别、肿瘤分化程度, 局部淋巴结转移、远处转移无关(P>0.05); JAK2、CSK的表达均与胰腺癌的分化程度有关, 而与患者年龄、性别、TNM分期, 局部淋巴结转移、远处转移无关(P>0.05).
结论: miR216a在胰腺癌组织中表达下调, JAK2在胰腺癌组织中表达上调, CSK在胰腺癌组织中表达下调, miR216a可能通过靶向调节JAK2、CSK的表达, 对胰腺癌的发病起到抑制作用.
核心提示: 胰腺癌组织中miR-216a表达显著下调, 导致胰腺癌中JAK2蛋白明显高表达, CSK蛋白低表达, miR216a的表达水平与胰腺癌的TNM分期有关. 提示miR216a在胰腺癌的发病过程中可能影响癌细胞的恶性生物学行为, 我们可以通过上调或下调JAK2、CSK基因, 干扰蛋白质的合成, 从而通过靶向治疗来改善胰腺癌的预后.
引文著录: 赵银瑞, 张连峰, 赵萍, 周琳. miR216a及其靶基因JAK2、CSK在胰腺癌中的表达及临床意义. 世界华人消化杂志 2015; 23(34): 5458-5464
Revised: November 3, 2015
Accepted: November 9, 2015
Published online: December 8, 2015
AIM: To detect the expression of miR216a and the protein expression of its target genes JAK2 and CSK in pancreatic cancer, and to analyze their correlation with clinicopathological factors.
METHODS: The expression of miR216a in pancreatic cancer and paracancerous tissues was measured by the locked nucleic acid in situ hybridization. The protein expression of its target genes JAK2 and CSK was determined by immunohistochemistry. The correlations between miR216a and JAK2/CSK expression, and their relationship with clinicopathological parameters of pancreatic cancer were analyzed.
RESULTS: The positive expression rate of miR216a in pancreatic cancer was 37.8%, significantly lower than that in the adjacent tissues 71.1% (χ2 = 10.080, P < 0.05). The positive expression rate of JAK2 was significantly higher (60% vs 35.6%, χ2 = 5.388, P < 0.05), but that of CSK was significantly lower (17.3% vs 73.3%, χ2 = 27.999, P < 0.05) in pancreatic cancer than in tumor adjacent tissues. The expression of miR216a in pancreatic cancer was significantly related to TNM stage (P < 0.05), but not to age, sex, tumor differentiation, lymph node metastasis or distant metastasis (P > 0.05). The expression of CSK and JAK2 was related to tumor differentiation (P < 0.05), but not to age, sex, TNM stage, lymph node metastasis or distant metastasis (P > 0.05).
CONCLUSION: The expression of miR216a is reduced in pancreatic cancer. The protein expression of JAK2 is increased, but that of CSK is reduced in pancreatic cancer. miR216a may suppress the development of pancreatic cancer by regulating the expression of CSK and JAK2.
- Citation: Zhao YR, Zhang LF, Zhao P, Zhou L. Clinical significance of expression of miR216a, CSK and JAK2 in pancreatic cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(34): 5458-5464
- URL: https://www.wjgnet.com/1009-3079/full/v23/i34/5458.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i34.5458
胰腺癌是一种恶性程度很高的消化系肿瘤, 中位生存期约为2-8 mo[1], 5年死亡率高达97%-98%, 近年来在中国的发病率呈上升趋势, 患者发现时大部分已处于中晚期, 预后极差[2-5]. 越来越多的研究证实, 靶向治疗对于战胜胰腺癌具有重要意义. MicroRNA(miRNA)是一种小的非编码性RNA, 通常由19-25个核苷酸片段组成, 具有癌基因和抑癌基因的双向作用, 其机制为: 完全或部分结合到信使RNA的3'非编码区, 抑制mRNA的翻译活动, 从而抑制蛋白的表达或者起到促使RNA降解的作用[6,7]. miR216a定位于基因组2p16.1, 有研究[8]发现JAK2、CSK为其靶基因, miR216a通过调控JAK2、CSK的表达参与一些肿瘤的发生、发展, 但在胰腺癌中鲜有报道. 为探讨miR216a、JAK2、CSK在胰腺癌发病中的作用, 本研究采用锁定核酸原位杂交法检测胰腺癌组织中miR216a的表达, 采用免疫组织化学方法检测JAK2、CSK蛋白的表达, 并分析其与胰腺癌临床病理特征的关系.
收集郑州大学第一附属医院2011-03/2014-11因胰腺癌行手术切除的石蜡包埋组织及癌旁正常组织各45例. 切片厚度3 μm, HE染色, 病理组织学诊断均为胰腺导管腺癌, 所有病例术前均未接受放、化疗. 45例胰腺癌患者中男31例, 女14例, 年龄43-81岁, 中位年龄62岁. 胰头癌29例, 胰体癌13例, 胰尾癌3例; 组织学分级: 高分化5例, 中分化29例, 低分化11例; 无淋巴结转移6例, 有淋巴结转移39例; 神经浸润: 无神经浸润3例, 有神经浸润42例. 根据国际抗癌联合会的肿瘤分类法TNM分期: Ⅰ期6例, Ⅱ期17例, Ⅲ期20例, Ⅳ期2例. 试剂采用兔抗人JAK2、CSK多克隆抗体, DAB显色试剂盒、NBT/BCIP显色剂、SP免疫组织化学试剂盒(PV-9000), 购自博奥森生物技术有限公司, 原位杂交miR216a探针购自丹麦EXIQON公司.
1.2.1 核酸锁定原位杂交法: 石蜡切片脱蜡水化、热修复(预杂交、杂交、杂交后处理、免疫组织化学检测及显色), 以细胞胞浆呈蓝色颗粒为阳性细胞的判断标准, 每张切片随机选取10个200倍视野, 每个视野计数100个细胞, 取其平均值. 按照阳性细胞的百分数, 阴性: 阳性细胞<1%; 弱阳性: 阳性细胞介于1%-5%; 强阳性: 阳性细胞>5%.
1.2.2 免疫组织化学染色法: 采用免疫组织化学超敏两步法(SP法)染色, 一抗均采用工作液(JAK2、CSK均以1:200稀释), 用PBS代替一抗作对照, 在同一条件下进行SP染色. 所有标本按照既定步骤进行脱蜡水化、高压修复、SP染色、DAB显色、苏木素复染、脱水、透明、封片后在显微镜下观察, 结果判断以细胞胞浆呈淡黄色、棕黄色到棕褐色的颗粒为阳性细胞. 判定标准均按照公认有效免疫组织化学图像统计[9-11]的方法. 每个视野100个细胞, 综合阳性染色的强度及数量, 无阳性细胞为0分, 阳性细胞≤25%为1分, 26%-50%为2分, 51%-75%为3分, >75%为4分. 着色强度无色为0分, 淡黄色为1分. 棕黄色为2分, 棕褐色为3分. 着色强度积分与数量积分相加: 0分为(-), 2-3分为(±), 4-5分为(+), 6-7分为(++), 其中(+)(++)均为阳性.
统计学处理 采用SPSS17.0进行统计分析, JAK2、CSK蛋白阳性率的比较采用χ2检验; miR216a、JAK2、CSK之间的相关性采用Spearman相关分析, 检验水准α = 0.05, P<0.05为差异具有统计学意义.
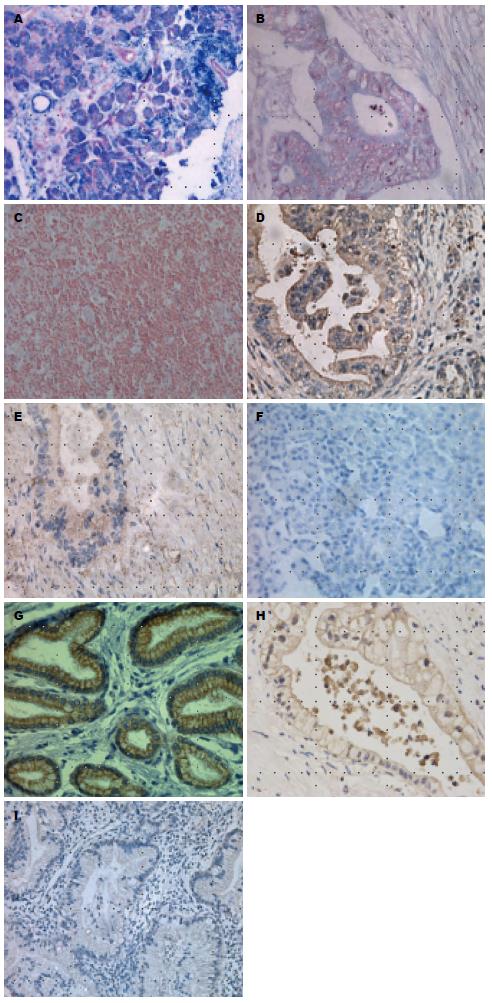
miR216a染色定位于细胞浆或细胞核, 呈蓝色, 在胰腺癌组织中多为弱阳性, 在癌旁正常组织中多为阳性或强阳性(图1A-C), miR216a在胰腺癌及癌旁正常组织中的阳性表达率分别为37.8%、71.1%(表1), 差异具有统计学意义(P<0.05). JAK2蛋白染色定位于胞浆, 阳性染色呈棕黄色或棕褐色(图1D-F), CSK蛋白染色定位于胞浆, 阳性染色为呈棕黄色或棕褐色(图1G-I). JAK2在胰腺癌及癌旁正常组织中的阳性表达率分别为60.0%、35.6%, 差异具有统计学意义(P<0.05); CSK在胰腺癌及癌旁正常组织中的阳性表达率分别为17.8%、73.3%, 差异具有统计学意义(P<0.05)(表1).
miR216a在TNMⅠ-Ⅱ期胰腺癌中的阳性表达率为34.8%(8/23)(表2), 在TNMⅢ-Ⅳ期的阳性表达率为9.1%(2/22), 差异有统计学意义(P<0.05); miR216a的表达与患者的性别、年龄、分化程度、门静脉或腹腔神经侵犯、有无淋巴结转移无关. JAK2在高、中、低分化胰腺癌细胞中的阳性表达率分别为20%(1/5)、68.9%(20/29)、81.8%(9/11)(表2); CSK在高、中、低分化胰腺癌细胞中的阳性表达率分别为80.0%(4/5)、20.7%(6/29)、27.2%(3/11), 差异均具有统计学意义(均P<0.05). JAK2、CSK与胰腺癌患者的性别、年龄、TNM分期、门静脉或腹腔神经侵犯、有无淋巴结转移无关(表2).
| 分组 | n | miR216a | χ2值 | P值 | JAK2 | χ2值 | P值 | CSK | χ2值 | P值 | |||
| + | - | + | - | + | - | ||||||||
| 性别 | 0.010 | 0.920 | 0.433 | 0.511 | 1.855 | 0.173 | |||||||
| 男 | 31 | 15 | 16 | 12 | 19 | 20 | 11 | ||||||
| 女 | 14 | 7 | 7 | 4 | 10 | 6 | 8 | ||||||
| 年龄(岁) | 3.602 | 0.580 | 2.186 | 0.139 | 2.409 | 0.121 | |||||||
| ≤60 | 26 | 11 | 15 | 8 | 18 | 17 | 9 | ||||||
| >60 | 19 | 3 | 16 | 10 | 9 | 8 | 11 | ||||||
| 肿瘤直径(cm) | 1.074 | 0.300 | 0.192 | 0.661 | 2.702 | 0.100 | |||||||
| <3 | 22 | 10 | 12 | 11 | 11 | 8 | 14 | ||||||
| ≥3 | 23 | 14 | 9 | 13 | 10 | 14 | 9 | ||||||
| 分化程度 | 1.194 | 0.551 | 6.1051 | 0.047 | 7.3211 | 0.026 | |||||||
| 高 | 5 | 3 | 2 | 1 | 4 | 4 | 1 | ||||||
| 中 | 29 | 10 | 19 | 20 | 9 | 6 | 23 | ||||||
| 低 | 11 | 4 | 7 | 9 | 2 | 3 | 8 | ||||||
| TNM分期 | 4.294 | 0.0381 | 0.982 | 0.322 | 3.513 | 0.061 | |||||||
| Ⅰ-Ⅱ期 | 23 | 8 | 15 | 18 | 15 | 19 | 14 | ||||||
| Ⅲ-Ⅳ期 | 22 | 2 | 20 | 9 | 13 | 7 | 15 | ||||||
| 门静脉或腹腔 神经侵犯 | 0.230 | 0.632 | 0.787 | 0.375 | 0.517 | 0.472 | |||||||
| 无 | 42 | 22 | 20 | 17 | 25 | 19 | 23 | ||||||
| 有 | 3 | 2 | 1 | 2 | 1 | 2 | 1 | ||||||
| 淋巴结转移 | 0.440 | 0.507 | 3.740 | 0.053 | 0.288 | 0.591 | |||||||
| 无 | 6 | 3 | 3 | 5 | 1 | 3 | 3 | ||||||
| 有 | 39 | 25 | 14 | 16 | 23 | 15 | 24 | ||||||
采用Spearman相关性分析, miR216a在胰腺癌组织中的表达水平与JAK2呈负相关(r = -0.436, P<0.05), 与CSK呈正相关(r = -0.223, P<0.05), JAK2与CSK在胰腺癌组织中的表达呈正相关(r = 0.443, P<0.05).
胰腺癌的发生、发展是一个多阶段、由多个基因调控的过程, 包括抑癌基因的失活或相关基因的表达失常等, 如kras基因的突变、抑癌基因p53的失活. miRNA参与调控个体发育、细胞凋亡和细胞分化等生命活动, 及包括肿瘤在内的多种疾病的进展, 近年来成为逐渐成为肿瘤研究的热点. 研究报道, miRNA在胰腺癌的发病过程中扮演重要角色, 涉及到细胞的增殖、凋亡、转移和耐药等.
miR216a属于miR216家族的一员, 其作用涉及到许多物种. 动物研究[12]显示miR216a在胰腺炎大鼠的血清中高表达; 在乳腺癌、胃癌、胶质瘤等恶性肿瘤中表达下调[13-15]; miR216a通过转化生长因子β诱导磷酸酶和张力蛋白同源酶致使AKT活化, 作用于肾小球系膜细胞导致肾脏疾病[16]; miR216a调控目标蛋白YB-1, 介导转化生长因子-β诱导基因-22转录后, 在糖尿病肾病的发病机制中具有重要意义[17]. 通过调控3'-UTR CD44, 抑制血管生成和肿瘤的生长[18]. 因此miR216a在不同的条件下的各种生物中具有不同的生物效应. 有研究[19]提示miR216a在胰腺癌的发展中可能起到抑癌基因的作用, 但miR216a及其主要靶基因对胰腺癌发病的影响及临床意义研究较少. 锁定核苷酸的寡核苷酸监测miRNA敏感性较高[20,21], miRNA分子比mRNA短, 因此更能耐受核糖核酸酶的降解, 且石蜡包埋组织中的miRNA材料可靠. 本研究采用锁定核酸原位杂交方法结合NBT/BCIP显色系统, 分析了miR216a在胰腺癌组织及癌旁组织中的定位表达情况, 发现阳性信号主要位于细胞浆. 结果显示: miR216a在胰腺癌组织中的表达率明显低于癌旁组织; 进一步结合临床资料研究发现, miR216a的表达水平与胰腺癌的TNM分期有关, 胰腺癌TNM分期越高, miR216a表达越低. 我们因此推测miR216a在胰腺癌中的表达下调及功能缺失导致下游的靶基因表达异常, 进而影响胰腺癌细胞的恶性生物学行为, 促进胰腺癌的进展与转移.
JAK2属于非受体型JAK酪氨酸激酶家族, 具有酪氨酸激酶活性, 许多研究表明, JAK2-Stat3信号通路的异常活化与肿瘤的发生发展有关, 如乳腺癌、肺癌、结肠癌、淋巴瘤、白血病、多发性骨髓瘤等. 有研究显示在肝癌、乳腺癌、肺癌等恶性肿瘤中JAK2为miR216a的靶基因, miR216a显著干扰JAK2/Stats信号通路; JAK2/Stats信号通路的激活, 被公认为显著涉及到肿瘤的发生[22-25]. 有报道[26]提示JAK2可能为miR216a的靶基因, 为进一步探讨JAK2-Stat3信号通路是否参与胰腺癌的发病, 本研究采用免疫组织化学方法, 检测了胰腺癌组织中JAK2蛋白的表达, 发现其主要表达于细胞浆中, 且在胰腺癌组织中表达水平明显高于癌旁正常组织. 通过与临床病理特征分析, 发现JAK2与胰腺癌的分化程度有关, 胰腺癌的分化程度越低, JAK2蛋白表达水平越高, 恶性程度越高, 因此我们推测JAK2在胰腺癌的发病过程中可能通过影响癌细胞的恶性生物学行为, 进而起了促进胰腺癌发展的作用.
CSK是SRC的天然抑制剂, 又被称为C-SRC激酶, 包括CSK及CHK, 三者都可以使致癌性的SRC激酶磷酸化并失活. SRC是非受体蛋白酪氨酸激酶家族成员之一, 属于原癌基因, 他的主要表型是C-SRC, C-SRC的表达失常往往会引起乳腺癌、结肠癌、前列腺癌等某些肿瘤的发展[27-31], 但在胰腺癌中鲜有报道. 有研究提示CSK在胰腺癌中可能为miR216a的靶基因, 因此我们进一步采用免疫组织化学方法检测了CSK蛋白. 结果显示, CSK在胰腺癌组织中表达低于癌旁正常组织, 并与胰腺癌的分化程度有关, CSK蛋白表达越低, 胰腺癌的分化程度越低. 我们推测miR216a在胰腺癌中表达下调, 致使CSK表达下调, 进而减少了CSK对C-SRC的抑制, 致使C-SRC高表达, 从而促进胰腺癌的发展.
miR216a与JAK2、CSK的相关性研究结果提示, miR216a与JAK2蛋白呈负相关, 而与CSK呈正相关. 研究结果提示, 胰腺癌组织中miR-216a表达显著下调, 对JAK2 mRNA翻译的抑制作用减弱, 导致胰腺癌中JAK2蛋白明显高表达, 促进胰腺癌的发展. miR216a与CSK蛋白呈正相关, 胰腺癌中miR216a的低表达, 引起CSK的低表达, 进而促进胰腺癌的发展. 上述结果提示我们可以通过上调或下调JAK2、CSK基因, 从而干扰蛋白质的合成, 从而通过靶向治疗来改善胰腺癌的预后.
由于胰腺癌发现时大多处于中晚期, 本研究搜集的标本均为进展期胰腺癌组织, 至于miR216a在早期胰腺癌中的作用以及miR216a是否参与了癌前病变到癌的转变, 还需进一步的探索. 由于胰腺癌发病时多处于中晚期, 合适的动物模型的构建对进一步的研究是十分必要的.
胰腺癌是一种恶性程度很高的消化系统肿瘤, 发病率与病死率相当. microRNA近年来逐渐成为肿瘤研究的热点, miR216a通过调控JAK2、CSK的表达参与一些肿瘤的发生、发展, 但在胰腺癌中鲜有报道.
李淑德, 教授, 中国人民解放军第二军医大学长海医院消化内科; 夏时海, 教授, 主任医师, 行政主任, 武警后勤学院附属医院肝胆胰脾科(中心)
大量研究提示miR216a与胰腺癌的病情发展有关, 但miR216a及其靶基因JAK2、CSK在胰腺癌中的表达, 三者在胰腺癌发展中的关系及三者与胰腺癌临床病理特征的关系需要进一步探究.
目前已有研究报道miR216a与胃癌、乳腺癌、肝癌、肺癌等恶性肿瘤密切相关, 而miR216a及其靶基因在胰腺癌中的研究报道较少.
本文采用锁定核酸原位杂交法测定胰腺癌及癌旁正常组织中miR216a的表达, 免疫组织化学法测定JAK2、CSK蛋白的表达, 并分析miR-216a与JAK2、CSK之间的相关性, 及其与胰腺癌临床病理指标的关系.
miR216a与JAK2蛋白呈负相关, 而与CSK呈正相关. 提示可以通过上调或下调JAK2、CSK基因, 干扰蛋白质的合成, 从而通过靶向治疗来改善胰腺癌的预后.
免疫组织化学: 是应用免疫学基本原理-抗原抗体反应, 即抗原与抗体特异性结合的原理, 通过化学反应使标记抗体的显色剂(荧光素、酶、金属离子、同位素)显色来确定组织细胞内抗原(多肽和蛋白质), 对其进行定位、定性及定量的研究, 称为免疫组织化学技术.
本文探讨miR216a及其靶基因JAK2、CSK表达与胰腺癌临床生物学行为之间的关系, 有一定临床指导意义.
编辑: 于明茜 电编: 闫晋利
| 1. | Lin QJ, Yang F, Jin C, Fu DL. Current status and progress of pancreatic cancer in China. World J Gastroenterol. 2015;21:7988-8003. [PubMed] [DOI] |
| 2. | Wolfgang CL, Herman JM, Laheru DA, Klein AP, Erdek MA, Fishman EK, Hruban RH. Recent progress in pancreatic cancer. CA Cancer J Clin. 2013;63:318-348. [PubMed] [DOI] |
| 3. | Vincent A, Herman J, Schulick R, Hruban RH, Goggins M. Pancreatic cancer. Lancet. 2011;378:607-620. [PubMed] [DOI] |
| 4. | Xu Z, Pothula SP, Wilson JS, Apte MV. Pancreatic cancer and its stroma: a conspiracy theory. World J Gastroenterol. 2014;20:11216-11229. [PubMed] [DOI] |
| 9. | 薄 立华, 杨 绍娟, 郭 志良, 张 玉成, 张 桂珍. 免疫组化图像计算机定量分析中若干问题的探讨. 中国体视学与图像分析. 2012;17:180-184. |
| 13. | 张 雁磊, 张 吉强. 微RNA在乳腺癌发生发展中的作用. 中华乳腺病杂志(电子版). 2012;6:668-674. |
| 16. | Wang S, Chen X, Tang M. MicroRNA-216a inhibits pancreatic cancer by directly targeting Janus kinase 2. Oncol Rep. 2014;32:2824-2830. [PubMed] [DOI] |
| 17. | Weinberg DV, Kolodny NH, Kohler SJ, Burr TA, Celi A, D'Amico DJ, Gragoudas ES. Dynamic sodium chemical shift imaging for the study of aqueous humor flow. Invest Ophthalmol Vis Sci. 1991;32:2212-2218. [PubMed] [DOI] |
| 18. | Jeyapalan Z, Deng Z, Shatseva T, Fang L, He C, Yang BB. Expression of CD44 3'-untranslated region regulates endogenous microRNA functions in tumorigenesis and angiogenesis. Nucleic Acids Res. 2011;39:3026-3041. [PubMed] [DOI] |
| 19. | 李 少杰, 侯 宝华, 区 金锐. miRNA-216a与胰腺癌的研究进展. 胃肠病学和肝病学杂志. 2014;23:625-628. |
| 20. | Denys B, El Housni H, Nollet F, Verhasselt B, Philippé J. A real-time polymerase chain reaction assay for rapid, sensitive, and specific quantification of the JAK2V617F mutation using a locked nucleic acid-modified oligonucleotide. J Mol Diagn. 2010;12:512-519. [PubMed] [DOI] |
| 21. | Yamamoto T, Fujii N, Yasuhara H, Wada S, Wada F, Shigesada N, Harada-Shiba M, Obika S. Evaluation of multiple-turnover capability of locked nucleic acid antisense oligonucleotides in cell-free RNase H-mediated antisense reaction and in mice. Nucleic Acid Ther. 2014;24:283-290. [PubMed] [DOI] |
| 22. | 蒋 树龙, 花 宝金. JAK2/STAT3/SOCS3信号通路与肿瘤转移[J]. 中国肿瘤生物治疗杂志. 2014;21:698-702. |
| 24. | 张 斌, 钟 德玝, 王 群伟, 苗 雄鹰, 戴 卫东, 刘 春, 潘 凯华. JAK/STAT信号通路与肝细胞性肝癌的肿瘤进展和预后的相关性研究. 细胞与分子免疫学杂志. 2010;26:368-370 373. |
| 26. | Wang X, Qiu W, Zhang G, Xu S, Gao Q, Yang Z. MicroRNA-204 targets JAK2 in breast cancer and induces cell apoptosis through the STAT3/BCl-2/survivin pathway. Int J Clin Exp Pathol. 2015;8:5017-5025. [PubMed] |
| 27. | 瞿 紫微, 王 晓燕, 魏 欣, 曾 红玲, 吴 彪, 黄 洋, 李 晓辉, 肖 新波. SRC激酶抑制剂对前列腺癌细胞侵袭与增殖的影响. 现代肿瘤医学. 2011;19:2178-2180. |
| 28. | 王 永辉, 陈 敬, 沈 朋, 毛 卫波, 周 月芬. 胃癌组织中Src激酶激活和HER2、Ki-67的表达及相关性研究. 中国组织化学与细胞化学杂志. 2012;21:389-395. |
| 30. | Chellappa K, Jankova L, Schnabl JM, Pan S, Brelivet Y, Fung CL, Chan C, Dent OF, Clarke SJ, Robertson GR. Src tyrosine kinase phosphorylation of nuclear receptor HNF4α correlates with isoform-specific loss of HNF4α in human colon cancer. Proc Natl Acad Sci U S A. 2012;109:2302-2307. [PubMed] [DOI] |