修回日期: 2015-10-31
接受日期: 2015-11-09
在线出版日期: 2015-12-08
目的: 探讨甲醛对小鼠肝脏miRNA122及其下游解离素-金属蛋白酶10(a disintegrin and metalloproteinase 10, ADAM10)和血清应答因子(serum response factor, SRF)的影响.
方法: 将40只♀昆明小鼠随机分为3个甲醛染毒组(低浓度组、中浓度组和高浓度组)和1个对照组, 每组10只. 染毒组每日上午9:00腹腔注射不同浓度的甲醛溶液, 对照组注射等量的生理盐水. 30 d后, 实时定量PCR检测(real-time quantitative PCR, qRT-PCR)法检测4组小鼠肝脏组织miRNA122的表达情况; 免疫组织化学法检测4组小鼠肝脏组织ADAM10和SRF的表达情况.
结果: 对照组、低浓度组、中浓度组、高浓度组小鼠肝脏miRNA122的相对表达量分别是0.99±0.005、0.94±0.074、0.72±0.062和0.38±0.091, 各组之间有明显差异(F = 22.988, P<0.01). 与对照组相比, 甲醛可明显降低肝脏中miRNA122的表达, 且呈浓度依赖关系; 染毒组中ADAM10和SRF的表达均明显高于对照组(H = 21.484, P = 0.000; H = 31.566, P = 0.000). miRNA122相对表达量与ADAM10及SRF阳性表达率均呈负相关(r = -0.975, P = 0.025; r = -0.799, P = 0.02).
结论: 甲醛染毒可以明显降低肝脏中miRNA122的表达, 且呈浓度依赖关系; 并可能通过增加ADAM10、SRF蛋白的异常表达进而诱发肝癌.
核心提示: 一定浓度的甲醛可以抑制肝脏中miRNA122的表达, 随着甲醛浓度增高, 这一抑制作用越发明显; 作为一种重要的抑癌基因, miRNA122的降低可导致下游解离素-金属蛋白酶10(a disintegrin and metalloproteinase 10)和血清应答因子(serum response factor)蛋白过量表达, 最终可能导致肝癌发生.
引文著录: 顾鹏, 刘福国, 孙学国, 陈力, 李玲, 刘希双. 甲醛对肝脏miRNA122及其下游解离素-金属蛋白酶10和血清应答因子的影响. 世界华人消化杂志 2015; 23(34): 5435-5442
Revised: October 31, 2015
Accepted: November 9, 2015
Published online: December 8, 2015
AIM: To investigate the effect of formaldehyde on miRNA122 and its downstream molecules a disintegrin and metalloproteinase 10 (ADAM10) and serum response factor (SRF) in the liver of mice.
METHODS: Forty female Kunming mice were randomly divided into three formaldehyde groups (low-, medium- and high-concentration groups) and a control group. The three formaldehyde groups were intraperitoneally injected with different concentrations of formaldehyde at 9:00 am daily. The control group was injected with equal volume of normal saline. After 30 d, the expression of miRNA122 in the liver was examined by real-time quantitative PCR (qRT-PCR). Immunohistochemistry was performed to observe the expression of ADAM10 and SRF in the liver.
RESULTS: The relative expression levels of miRNA122 in the control group, low-, medium-, and high-concentration groups were 0.99 ± 0.005, 0.94 ± 0.074, 0.72 ± 0.062, and 0.38 ± 0.091, respectively. There were significant differences between different groups (F = 22.988, P < 0.01). Formaldehyde significantly reduced the expression of miRNA122 in a dose-dependent manner. The expression of ADAM10 and SRF was significantly higher in the three formaldehyde groups than in the control group (H = 21.484, P = 0.000; H = 31.566, P = 0.000, respectively). The relative expression of miRNA122 showed a negative association with ADAM10, as well as SRF (r = -0.975, P = 0.025; r = -0.799, P = 0.02, respectively).
CONCLUSION: Formaldehyde can significantly reduce the expression of miRNA122 in the liver in a dose-dependent manner. Formaldehyde may induce hepatocellular carcinoma by increasing the expression of ADAM10 and SRF.
- Citation: Gu P, Liu FG, Sun XG, Chen L, Li L, Liu XS. Effect of formaldehyde on miRNA122 and its downstream molecules a disintegrin and metalloproteinase 10 and serum response factor in the liver of mice. Shijie Huaren Xiaohua Zazhi 2015; 23(34): 5435-5442
- URL: https://www.wjgnet.com/1009-3079/full/v23/i34/5435.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i34.5435
甲醛作为一种高挥发性有机化合物, 被广泛应用于室内装修及工业产品制造, 以海产品为代表的某些食品中也含有不同含量的甲醛, 近年来一些不法商贩甚至直接在食品中添加甲醛以延长食品保质期[1,2]. 甲醛对人体的伤害主要集中于呼吸道、肝脏、肾脏、神经系统及免疫系统[3]. 其中, 由于甲醛进入人体后需要经肝脏代谢, 其与肝癌发生的关系受到了广泛的关注[4]. miRNA122是一种肝脏高表达的miRNA, 占肝脏中所有miRNA的70%以上[5], 具有肝脏特异性, 在肝癌细胞中呈低表达状态. 已有研究[6]显示, 肝癌及某些肝脏疾病的发生和发展与miRNA122关系密切. miRNA122的下调可以激活下游基因[7], 促进其下游靶蛋白如解离素-金属蛋白酶10(a disintegrin and metalloproteinase 10, ADAM10), 血清应答因子(serum response factor, SRF)表达. ADAM10、SRF在肝癌组织中呈高表达状态[8,9], 均可促进肿瘤发生[10], 这一系列改变最终可能导致肝癌发生. 虽然已有多方面文献分别从病理学层面及生物化学层面观察并解释了甲醛对肝脏损害的机制, 但甲醛对miRNA122及下游基因蛋白的影响尚未见文献报道. 腹腔注射能准确把握甲醛剂量, 客观评判甲醛量与肝损伤的关系. 因此本实验采用腹腔注射的方法染毒, qRT-PCR检测肝脏miRNA122, 免疫组织化学法检测肝脏组织miRNA122下游蛋白ADAM10、SRF, 探讨甲醛对miRNA122表达量的影响, 在miRNA及蛋白水平上解释甲醛对肝脏的致癌作用.
♀昆明小鼠40只, 2周龄, 体质量20-25 g, 购自青岛派特福德白鼠养殖合作社. 试验期间小鼠自由进食进水. TRIzol试剂(青岛云山生物科技有限公司); miRcute miRNA First-strand cDNA Synthesis Kit、miRcute miRNA qRT-PCR Detection Kit(SYBR Green)(TIANGEN公司); miRNA122上游引物、内参U6引物(GeneCopoeia公司); 兔抗鼠ADAM10多克隆抗体、兔抗鼠SRF多克隆抗体(北京博奥森生物技术有限公司); PV6001免疫组织化学试剂盒、DAB显色液(北京中杉金桥生物技术有限公司). 主要仪器: 荧光PCR仪(Eppendorf公司); 低温高速离心机(Eppendorf公司); 切片机、电热恒温水温箱.
1.2.1 分组染毒: 分组试验前观察试验小鼠1 wk, 然后随机将体质量为25 g的♀昆明鼠分为对照组和3个染毒组, 每组10只, 染毒组甲醛染毒浓度分别为低浓度组20 mg/kg、中浓度组40 mg/kg、高浓度组80 mg/kg, 设置9 g/L生理盐水阴性对照组. 在无菌条件下, 临用时配制甲醛溶液. 采用腹腔注射的方式, 试验组注射不同浓度的溶液, 每天上午9:00注射1次, 每次注射0.1 mL/10 g. 对照组腹腔注射等体积的生理盐水. 注射30 d后处死小鼠. 小鼠肝脏取出后取100 mg用于提取总RNA, 剩余组织经40 g/L甲醛固定、常规石蜡包埋、切片.
1.2.2 肝组织总RNA的提取: 取小鼠肝脏组织100 mg置于玻璃研磨器中, 加1 mL TRIzol液于冰上充分研磨, 氯仿抽提, 离心(12000 r/min, 15 min, 4 ℃); 吸取上清液加等体积异丙醇, 30 ℃温箱孵育5 min, 离心(12000 r/min, 10 min, 4 ℃); 弃上清, 加预冷的750 mL/L乙醇(DEPC水配置)1 mL洗涤, 离心(7500 r/min, 5 min, 4 ℃); 弃上清, 空气干燥5-10 min, 将RNA溶于DEPC水中至20 µL. 测吸光度值定浓度. 10 g/L琼脂糖电泳验证总RNA质量.
1.2.3 miRNA的逆转录及实时荧光定量PCR: 本实验采用对RNA加poly(A)尾, 再使用Oligo(dt)-universai tag通用逆转录引物进行逆转录反应, 最终生成miRNA对应的cDNA第一链. 此次试验以U6 snRNA为内参, 扩增反应体系则参照miRcute miRNA qRT-PCR Detection Kit(SYBR Green) (TIANGEN公司)说明书进行. 小鼠肝脏组织20 µL反转录体系包括加poly(A)尾RNA 2 µL, 10×RT Primer 2 µL, 10×RT Buffer 2 µL, Super Pure dNTPs 1 µL, RNasin (40 U/µL)1 µL, Quant RTase 0.5 µL, RNase-Free ddH2O 11.5 µL. 混匀, 短暂离心后37 ℃反应60 min. 合成的cDNA用于qRT-PCR, 20 µL体系包括2×miRcute miRNA Premix(with SYBR)10 µL, Forward Primer 2 µL(自备), Reverse Primer(10 µmol/L)0.4 µL, miRNA第一链cDNA 2 µL, ddH2O 5.6 µL. 其中Reverse Primer由miRcute miRNA qRT-PCR Detection Kit试剂盒提供, miRNA122及内参U6上游引物购自GeneCopoeia公司, miRNA122上游引物序列为5'-GGGTGGAGTGTGACAATGG-3', U6上游引物序列为5'-GCTTCGGCAGCACATATACTAAAAT-3'. 反应条件: 起始模板变性94 ℃ 2 min, 变性和退火、延伸94 ℃ 20 s, 60 ℃ 34 s, 45个循环. 所得结果采用2-△△Ct法进行结果分析, 将不同样本的2-△△Ct进行比较. △Ct = Ctmi122-Ctu6, △△Ct = Ct实验组-Ct对照组.
1.2.4 免疫组织化学检测: 采用免疫组织化学PV6001两步法. 结果判断: ADAM10以细胞质出现棕黄色颗粒为阳性; SRF以细胞核和/或细胞质出现棕黄色颗粒为阳性. 在400倍显微镜下选择染色最强的5个视野, 每个视野计数100个细胞, 高倍镜下计数阳性细胞比例, 以>20%为阳性表达.
统计学处理 采用SPSS19.0软件程序进行统计学分析, 其定量资料以mean±SD形式表示, 两样本均数用t检验, 多样本均数比较采用单因素方差分析(One-way ANOVA), 采用单因素方差分析法中的LSD法对多组样本均数间的两两比较进行分析, 有序多分类资料采用秩和检验, 相关性分析采用Pearson法, 处理结果以P<0.05为差异有统计学意义.
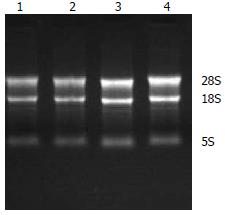
总RNA经紫外分光光度计测定A260/280的比值, 选择A260/280值于1.8-2.0的RNA样品进行逆转录. 用琼脂糖凝胶电泳鉴定RNA质量, 琼脂凝胶电泳显示28S、18S条带清晰可见(图1), 说明总RNA无明显降解, 完整性好.
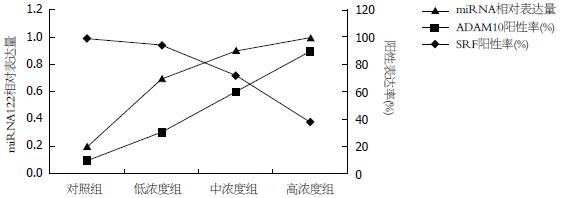
对照组、低浓度组、中浓度组、高浓度组中的miRNA122相对表达量分别是0.99±0.005、0.94±0.074、0.72±0.062、0.38±0.091, 组间有明显差异(F = 22.988, P<0.01). 其中, LSD法研究各组间miRNA122表达差异可发现高浓度组与中浓度组、低浓度组、对照组相比, miRNA122均明显下降, 有统计学意义(P = 0.001, P = 0.000, P = 0.000); 中浓度组与低浓度组、对照组比较, miRNA122明显下降, 有统计学意义(P = 0.013, P = 0.006); 低浓度组与对照组比较, miRNA122表达无统计学差异(P = 0.511). 与对照组相比, 低浓度组miRNA122表达量有轻微下调趋势, 统计学分析显示这种下调并无统计学意义, 然而随着染毒浓度的增加, 中浓度组、高浓度组miRNA122在肝细胞中的表达呈明显阶梯状下降趋势, 表达差异有统计学意义.
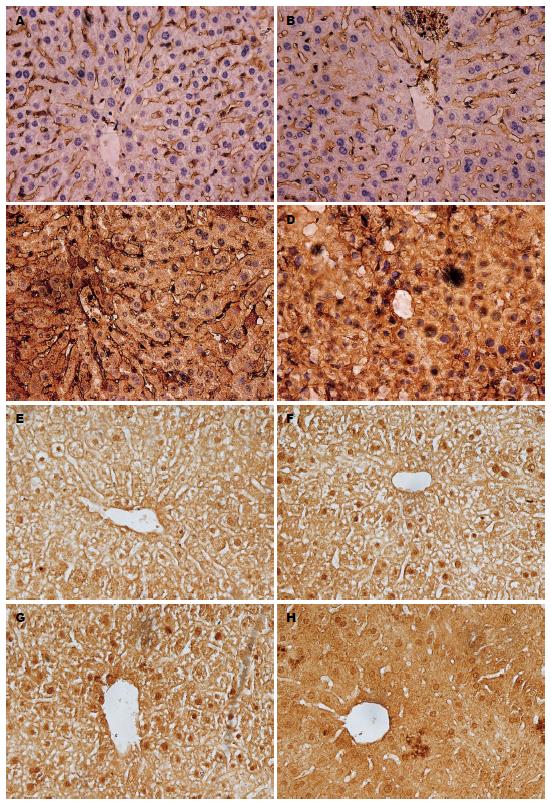
如图2所示, ADAM10主要在细胞质表达, 阳性染色表现为细胞质中出现棕黄色颗粒; 随着染毒浓度的增加, 阳性表现逐渐增强, 中浓度组、高浓度组与对照组相比阳性表现尤为明显, 并且高浓度组肝脏细胞出现排列紊乱, 异型性增加的现象. SRF主要在细胞核与细胞质中表达, 以细胞核为主, 阳性染色表现为细胞核及胞质中出现棕黄色颗粒; 随着染毒浓度的增加, 阳性细胞核数量逐渐增多, 染色逐渐增强, 并且高浓度组肝脏细胞出现排列紊乱, 胞膜消失的现象. 染毒组中ADAM10和SRF的表达均明显高于对照组, ADAM10和SRF的阳性表达率在对照组、低浓度组、中浓度组、高浓度组间差异均有统计学意义(H = 21.484, P = 0.000; H = 31.566, P = 0.000)(表1).
| 分组 | ADAM10阳性率 | SRF阳性率 |
| 对照组 | 1(10) | 2(20) |
| 低浓度组 | 3(30) | 7(70) |
| 中浓度组 | 6(60) | 9(90) |
| 高浓度组 | 9(90) | 10(100) |
| H值 | 21.484 | 31.566 |
| P值 | 0.000 | 0.000 |
随着染毒浓度的增加, miRNA122相对表达量与ADAM10阳性表达率呈负相关(r = -0.975, P = 0.025), 与SRF阳性表达率亦呈负相关(r = -0.799, P = 0.02)(图3).
甲醛作为一种常见的化学性室内空气污染物, 对人体呼吸系统、消化系统及神经内分泌系统均有损害作用, 世界卫生组织已将甲醛列为人类致癌物[11]. 其中, 甲醛对人类呼吸系统的危害是最早被发现和研究的[12,13], 在研究甲醛对呼吸系统损伤的各种机制中, 人们已将目光重点放在甲醛对呼吸系统miRNA的扰乱作用上, 并取得了丰硕的成果[14]. 例如, 有人曾将灵长类动物暴露于不同浓度的甲醛气体中, 取实验动物鼻黏膜上皮细胞提取miRNA, 通过qRT-PCR检测其表达量. 结果发现在中浓度和高浓度染毒组中, 分别有3种和13种miRNA表达紊乱. 人类肺细胞暴露于1×10-6甲醛气体中4 h后, 提取miRNA并收集相关蛋白, 发现在气态甲醛的影响下, 人类肺细胞中miRNA的表达受到了影响[15,16]. 基于以上研究, 甲醛对呼吸道miRNA干扰作用的研究成果为其对肝脏miRNA的干扰的研究提供了依据和参考. 目前, 已有多方面文献从生物化学及病理学角度证明了甲醛对肝脏确实存在损害作用, 并有提高肝癌发生率的可能. 如有专家用不同浓度甲醛持续灌胃5 d后检测肝细胞超氧化物歧化酶性能及丙二醛量来研究甲醛对肝脏的影响. 结果发现高浓度组小鼠肝细胞中超氧化物歧化酶明显低于对照组; 而丙二醛量则明显高于对照组; 高浓度组的肝脏系数也高于对照组, 说明一定量的甲醛可以破坏小鼠脂质过氧化的平衡状态, 明显减弱其抗氧化的能力, 引起肝脏代偿性肥大. 另一部分专家则采用了腹腔注射的方法来研究甲醛对小鼠肝脏的毒性作用, 获得了与上述实验相同的结果. 同时, 在甲醛染毒组中, 还能观察到细胞染色质变性、线粒体膜损害以及线粒体嵴的消失等毒性损害[17,18]. 尽管如此, 甲醛对肝脏中miRNA的影响尚未见到相关文献报道. 本研究着眼于肝脏miRNA水平, 旨在通过研究肝脏miRNA及相关下游蛋白的扰乱, 在新的层次上阐释甲醛对肝脏的损害及可能诱发肝癌的机制.
大量研究表明, miRNA122是一种肝脏特异性的miRNA, 在肝脏中高度表达, 在肝癌细胞中表达量明显下降[19], 在肝细胞生长、应激反应、脂质代谢、病毒感染、细胞增殖、基因表达、肝细胞表型维持以及肝细胞肝癌等多种生物学过程方面起调控作用[20-23], 是肝脏重要的调控因子之一, 与肝癌和多种急慢性肝脏疾病关系密切[24,25]. 目前已发现miRNA122致癌机制与ADAM10、SRF、IGF-1R、cyclin D1等多种因子关系密切[26]. ADAM10是一种跨膜金属蛋白, 通过调节Notch、上皮细胞型钙黏蛋白、表皮生长因子、表皮生长因子受体2和炎性细胞因子, 参与肿瘤的形成和炎性疾病的发病. 研究[27]表明, ADAM10在肝癌组织中高表达, 并在肿瘤的形成过程中起重要作用, 可能是肿瘤和炎性疾病的一个潜在治疗靶点[28]. SRF是一个重要的转录因子, 涉及调控细胞增殖、迁移、分化、血管发生和凋亡多种基因的表达, 在肝细胞癌的发生发展中起重要作用[29].
ADAM10与SRF均是miRNA122的靶蛋白, 被miRNA122所抑制, 在肝癌组织中, 由于miRNA122的下调, ADAM10与SRF会有上调的表现, 可以促进肿瘤的生长. 本研究首先采用qRT-PCR技术检测对照组和不同浓度染毒(甲醛)组小鼠肝脏miRNA122的表达量, 结果显示低浓度组与对照组相比, 表达量略有下降, 但并无统计学差异, 说明低浓度组与对照组相比miRNA122表达量并无明显变化. 然而, 随着染毒浓度增加, 中浓度组与高浓度组miRNA122量与对照组相比出现了明显的下降趋势, 且染毒浓度越高, 下降趋势越明显, 在高浓度给药的情况下, miRNA122的表达量只有对照组的0.38倍. 这说明甲醛确实可以干扰肝脏miRNA122的表达, 使其表达量下降, 并且其下降程度与甲醛浓度有关. 这一点与甲醛对呼吸道miRNA的扰乱情况也是相符合的. miRNA122表达量的下降无疑会造成其抑癌机制的减弱, 导致肿瘤的发生[30,31]. 在随后的研究中, 用免疫组织化学的方法测定小鼠肝脏组织中相关蛋白的表达. 发现ADAM10在对照组、低浓度组、中浓度组、高浓度组的胞质中阳性率呈逐渐上升的趋势, 染色程度也逐渐强化, 其中在中浓度组、高浓度组尤为明显. SRF在胞核与胞质中显色, 在由低到高4个组中阳性率也呈上升趋势, 而且, 在高倍镜下观察均可发现高浓度组组织出现了细胞膜消失, 细胞正常结构形态发生改变的现象. ADAM10与SRF蛋白在4个实验组组织中表达率的逐渐升高与miRNA122在4组中表达量的逐步减低能较好的相对应, 说明甲醛扰乱了肝脏miRNA122这一关键抑癌因子的表达, 同时增加了ADAM10、SRF两种miRNA122下游致癌因子的表达, 进一步证实了miRNA122的抑癌作用, 也从miRNA水平上阐释了甲醛导致肝癌发生的可能机制, 在一定程度上证实了甲醛可导致肝细胞肝癌的假说.
甲醛作为一种常见的化学性污染物, 已被列为人类致癌物. 但其对肝脏的致癌作用尚未明确. miRNA122作为重要的肝脏调控因子, 与肝癌的发生关系密切. 本文以甲醛对肝脏miRNA122及其下游蛋白的影响为研究方向, 讨论甲醛诱发肝癌的可能性.
刘正稳, 教授, 西安交通大学医学院第一附属医院
目前普遍认为miRNA122的下调及其下游因子的表达紊乱是导致肝癌的重要原因, miRNA122与肝癌的关系已成为当今研究热点. 外部化学物质能否影响miRNA122的表达需要进一步研究.
Rager等的研究发现甲醛可以使人类细胞中miRNA的表达受到影响. 通过分析这些发生改变miRNA的下游靶基因可以发现, miRNA的改变最终可与癌症发生关联. 即甲醛可能会通过影响miRNA而致癌.
本研究通过观察甲醛对小鼠肝脏miRNA122的影响来探讨甲醛导致肝癌的可能性, 并进一步检测了与肝癌相关的两种蛋白: 解离素-金属蛋白酶10(a disintegrin and metalloproteinase 10, ADAM10)和血清应答因子(serum response factor, SRF), 在多个层次上探讨甲醛导致肝癌的可能机制.
本研究证实甲醛扰乱了肝脏miRNA122这一关键抑癌因子的表达, 同时增加了下游致癌基因的表达, 证实了miRNA122的抑癌作用, 也进一步验证了甲醛可导致肝细胞肝癌的假说. 对避免接触过量甲醛, 预防肝癌提供了理论依据.
甲醛对健康的影响是需要极为关注的卫生问题, 本文探讨了甲醛对小鼠肝脏miRNA122 及其下游蛋白ADAM10和SRF 的影响, 发现甲醛可以降低肝细胞中miRNA122 的表达, 同时甲醛可以增加ADAM10和SRF 蛋白的表达. 该研究有助于理解甲醛对肝脏的损伤机制.
编辑: 郭鹏 电编: 闫晋利
| 3. | 李 玲, 姜 虹, 栗 学军, 张 黎明, 李 铁骥, 于 光艳, 范 洪学. 甲醛对小鼠血清和肝脏丙二醛及超氧化物歧化酶的影响. 吉林大学学报(医学版). 2004;30:733-735. |
| 4. | Ye X, Ji Z, Wei C, McHale CM, Ding S, Thomas R, Yang X, Zhang L. Inhaled formaldehyde induces DNA-protein crosslinks and oxidative stress in bone marrow and other distant organs of exposed mice. Environ Mol Mutagen. 2013;54:705-718. [PubMed] [DOI] |
| 5. | 骆 明勇, 杨 戎, 张 亮, 王 应雄. MicroRNA 122对肝癌细胞基因表达谱的影响. 中国生物化学与分子生物学报. 2007;23:644-651. |
| 6. | Köberle V, Kronenberger B, Pleli T, Trojan J, Imelmann E, Peveling-Oberhag J, Welker MW, Elhendawy M, Zeuzem S, Piiper A. Serum microRNA-1 and microRNA-122 are prognostic markers in patients with hepatocellular carcinoma. Eur J Cancer. 2013;49:3442-3449. [PubMed] [DOI] |
| 8. | Yuan S, Lei S, Wu S. ADAM10 is overexpressed in human hepatocellular carcinoma and contributes to the proliferation, invasion and migration of HepG2 cells. Oncol Rep. 2013;30:1715-1722. [PubMed] [DOI] |
| 9. | Kwon CY, Kim KR, Choi HN, Chung MJ, Noh SJ, Kim DG, Kang MJ, Lee DG, Moon WS. The role of serum response factor in hepatocellular carcinoma: implications for disease progression. Int J Oncol. 2010;37:837-844. [PubMed] |
| 10. | Nakao K, Miyaaki H, Ichikawa T. Antitumor function of microRNA-122 against hepatocellular carcinoma. J Gastroenterol. 2014;49:589-593. [PubMed] [DOI] |
| 12. | Wang W, Yan Y, Li CW, Xia HM, Chao SS, Wang de Y, Wang ZP. Live human nasal epithelial cells (hNECs) on chip for in vitro testing of gaseous formaldehyde toxicity via airway delivery. Lab Chip. 2014;14:677-680. [PubMed] [DOI] |
| 13. | Lino-dos-Santos-Franco A, Gimenes-Júnior JA, Ligeiro-de-Oliveira AP, Breithaupt-Faloppa AC, Acceturi BG, Vitoretti LB, Machado ID, Oliveira-Filho RM, Farsky SH, Moriya HT. Formaldehyde inhalation reduces respiratory mechanics in a rat model with allergic lung inflammation by altering the nitric oxide/cyclooxygenase-derived products relationship. Food Chem Toxicol. 2013;59:731-738. [PubMed] [DOI] |
| 14. | Rager JE, Moeller BC, Miller SK, Kracko D, Doyle-Eisele M, Swenberg JA, Fry RC. Formaldehyde-associated changes in microRNAs: tissue and temporal specificity in the rat nose, white blood cells, and bone marrow. Toxicol Sci. 2014;138:36-46. [PubMed] [DOI] |
| 15. | Rager JE, Smeester L, Jaspers I, Sexton KG, Fry RC. Epigenetic changes induced by air toxics: formaldehyde exposure alters miRNA expression profiles in human lung cells. Environ Health Perspect. 2011;119:494-500. [PubMed] [DOI] |
| 16. | Rager JE, Moeller BC, Doyle-Eisele M, Kracko D, Swenberg JA, Fry RC. Formaldehyde and epigenetic alterations: microRNA changes in the nasal epithelium of nonhuman primates. Environ Health Perspect. 2013;121:339-344. [PubMed] [DOI] |
| 17. | Liu Y, Xu Q, Ma Y. [Effects of intragastric administration of formaldehyde on superoxide dismutase activities and malondialdehyde contents in liver of mice]. Zhonghua Lao Dong Wei Sheng Zhi Ye Bing Za Zhi. 2014;32:376-377. [PubMed] |
| 18. | Bakar E, Ulucam E, Cerkezkayabekir A. Investigation of the protective effects of proanthocyanidin and vitamin E against the toxic effect caused by formaldehyde on the liver tissue. Environ Toxicol. 2014; Jun 13. [Epub ahead of print]. [PubMed] [DOI] |
| 19. | Jin JC, Zhang X, Jin XL, Qian CS, Jiang H, Ruan Y. MicroRNA122 regulation of the morphology and cytoarchitecture of hepatoma carcinoma cells. Mol Med Rep. 2014;9:1376-1380. [PubMed] [DOI] |
| 20. | El-Garem H, Ammer A, Shehab H, Shaker O, Anwer M, El-Akel W, Omar H. Circulating microRNA, miR-122 and miR-221 signature in Egyptian patients with chronic hepatitis C related hepatocellular carcinoma. World J Hepatol. 2014;6:818-824. [PubMed] [DOI] |
| 21. | Kishikawa T, Otsuka M, Tan PS, Ohno M, Sun X, Yoshikawa T, Shibata C, Takata A, Kojima K, Takehana K. Decreased miR122 in hepatocellular carcinoma leads to chemoresistance with increased arginine. Oncotarget. 2015;6:8339-8352. [PubMed] [DOI] |
| 22. | Yoshikawa T, Takata A, Otsuka M, Kishikawa T, Kojima K, Yoshida H, Koike K. Silencing of microRNA-122 enhances interferon-α signaling in the liver through regulating SOCS3 promoter methylation. Sci Rep. 2012;2:637. [PubMed] [DOI] |
| 23. | Hsu SH, Wang B, Kota J, Yu J, Costinean S, Kutay H, Yu L, Bai S, La Perle K, Chivukula RR. Essential metabolic, anti-inflammatory, and anti-tumorigenic functions of miR-122 in liver. J Clin Invest. 2012;122:2871-2883. [PubMed] [DOI] |
| 24. | Tsai WC, Hsu SD, Hsu CS, Lai TC, Chen SJ, Shen R, Huang Y, Chen HC, Lee CH, Tsai TF. MicroRNA-122 plays a critical role in liver homeostasis and hepatocarcinogenesis. J Clin Invest. 2012;122:2884-2897. [PubMed] [DOI] |
| 25. | Shah N, Nelson JE, Kowdley KV. MicroRNAs in Liver Disease: Bench to Bedside. J Clin Exp Hepatol. 2013;3:231-242. [PubMed] [DOI] |
| 26. | Chu R, Mo G, Duan Z, Huang M, Chang J, Li X, Liu P. miRNAs affect the development of hepatocellular carcinoma via dysregulation of their biogenesis and expression. Cell Commun Signal. 2014;12:45. [PubMed] [DOI] |
| 30. | Wang L, Zhang Z, Wang FS. The efficacy of miRNA122, a novel therapeutic target, for predicting the progression of hepatocellular carcinoma (HCC). Cell Mol Immunol. 2012;9:103-104. [PubMed] [DOI] |
| 31. | Wang B, Hsu SH, Wang X, Kutay H, Bid HK, Yu J, Ganju RK, Jacob ST, Yuneva M, Ghoshal K. Reciprocal regulation of microRNA-122 and c-Myc in hepatocellular cancer: role of E2F1 and transcription factor dimerization partner 2. Hepatology. 2014;59:555-566. [PubMed] [DOI] |