修回日期: 2014-03-19
接受日期: 2014-03-28
在线出版日期: 2014-05-08
目的: 探讨不同浓度的二十二碳六烯酸(docosahexaenoic acid, DHA)对人肝癌细胞HepG2生长增殖抑制及促进凋亡的作用及其机制, 为其应用于肝癌的药物预防和治疗提供实验及理论依据.
方法: 以DHA浓度0 μg/mL为阴性对照, 设置浓度为15、30、45、60、75 μg/mL的实验组. 采用CCK-8和流式细胞术检测不同浓度DHA对HepG2细胞生长的相对抑制率及凋亡情况, 并运用荧光定量PCR及Western blot分别从基因和蛋白质水平分析不同浓度DHA作用前后β-连环蛋白(β-catenin)及C-myc表达量的变化.
结果: CCK-8实验表明DHA在体外能抑制HepG2细胞生长, 在DHA作用浓度为0-45 μg/mL, 作用时间24 h时, 实验组与对照组细胞吸光度(A)值差异有显著的统计学意义(P<0.01), 实验组内两两比较差异有统计学意义(P<0.01), 细胞生长抑制率最高达90.7%. 继续增加药物浓度或作用时间, 差异无统计学意义. 流式细胞术发现DHA可促进HepG2细胞凋亡, 实验组与对照组细胞凋亡率差异有显著的统计学意义(P<0.01), 实验组内两两比较差异有统计学意义(P<0.01). 荧光定量PCR显示DHA可下调HepG2细胞中C-myc基因表达水平, 实验组与对照组C-myc基因相对表达量的差异有显著的统计学意义(P<0.01), 实验组内两两比较差异有统计学意义(P<0.01); 实验组与对照组及各实验者组之间β-catenin基因的相对表达量差异无统计学意义. Western blot显示DHA可降低HepG2细胞β-catenin、C-myc蛋白质的表达量.
结论: DHA对人肝癌HepG2细胞有明显的生长增殖抑制及促进凋亡的作用, 与其降低β-catenin蛋白质水平进而下调C-myc基因表达水平有关.
核心提示: 二十二碳六烯酸对体外培养的人肝癌HepG2细胞有明显的生长增殖抑制及促进凋亡的作用, 与其降低β-catenin蛋白质水平进而下调C-myc基因表达水平有关.
引文著录: 李衍彦, 范友杰, 邹浩, 姜海涛, 李洁旭, 孙良金, 曹景玉. 二十二碳六烯酸对人肝癌细胞HepG2的作用与调控β-catenin及C-myc表达的关系. 世界华人消化杂志 2014; 22(13): 1834-1840
Revised: March 19, 2014
Accepted: March 28, 2014
Published online: May 8, 2014
AIM: To investigate the effects of docosahexaenoic acid (DHA) of different concentrations on the proliferation and apoptosis of human hepatocelluar carcinoma HepG2 cells, and to explore the possible molecular mechanisms involved.
METHODS: HepG2 cells were cultured in vitro and treated with different concentrations of DHA (15, 30, 45, 60, 75 μg/mL) for different durations, with untreated cells as controls. The relative rate of reduced growth of HepG2 cells was detected by the CCK-8 method. Flow cytometry assay was applied to determine the rate of HepG2 cell apoptosis. After DHA treatment, the levels of β-catenin and C-myc mRNAs and proteins were measured by real-time PCR and Western blot, respectively.
RESULTS: In the concentration range from 0 to 45 mg/mL and with a treatment time of 24 h, DHA significantly inhibit the growth of HepG2 cells in vitro, and significant differences in the absorbance (A value) were observed between the experimental group and control group (P < 0.01), and between each two concentrations in the experimental group. If drug concentration or action time was increased, the results showed no statistically significant differences. Flow cytometric analysis indicated that DHA promotes the apoptosis of HepG2 cells. There were significant differences in the apoptosis rate between the experimental group and control group (P < 0.01), and between each two concentrations in the experimental group. Real-time PCR detected low levels of C-myc expression in HepG2 cells treated with DHA, and significant differences in C-myc expression were observed between the experimental group and control group (P < 0.01) and between each two concentrations in the experimental group. There was no significant difference in β-catenin relative expression between the experimental group and control group, or between different concentrations in the experimental group. Western blot analysis demonstrated that DHA could decrease the protein expression of β-catenin and C-myc in HepG2 cells.
CONCLUSION: DHA promotes apoptosis and inhibits proliferation of HepG2 cells possibly via mechanism associated with down-regulating the protein expression of β-catenin and the mRNA expression of C-myc.
- Citation: Li YY, Fan YJ, Zou H, Jiang HT, Li JX, Sun LJ, Cao JY. Docosahexaenoic acid promotes apoptosis and inhibits proliferation of HepG2 cells by altering β-catenin and C-myc expression. Shijie Huaren Xiaohua Zazhi 2014; 22(13): 1834-1840
- URL: https://www.wjgnet.com/1009-3079/full/v22/i13/1834.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i13.1834
二十二碳六烯酸(docosahexaenoic acid, DHA)属于ω-3多不饱和脂肪酸, 是分子结构中含有6个碳碳双键的脂肪酸. 自被发现以来, 已证实其具有调节人体内血脂和脂蛋白正常代谢, 降低血液粘稠度和胆固醇水平, 预防心脑血管疾病等诸多生理效应. 近年来, DHA对肿瘤防治方面的研究愈来愈受到重视, 流行病学调查表明: 饮食中高ω-3多不饱和脂肪酸摄入的人群中乳腺癌、前列腺癌、结肠癌等肿瘤的发病率明显降低[1,2]. 大量的实验研究证实: 以DHA为代表的ω-3多不饱和脂肪酸能够抑制肿瘤的生长、侵袭及转移; 诱导肿瘤细胞分化、凋亡; 延长荷瘤宿主的生存时间[3-5]. 但目前关于DHA对人肝癌细胞的影响及其作用机制研究较少. 本实验中运用不同浓度的DHA处理人肝癌细胞HepG2, 观察药物作用前后对细胞增殖及凋亡的影响并探讨其作用机制, 以期为其应用于肝癌的药物预防和治疗提供实验及理论依据.
DHA购自美国Sigma公司; 胎牛血清、胰酶、1640、双抗购自Hyclone公司; CCK-8购自南京建成生物工程研究所有限公司; Annexin-Ⅴ-FITC/PI凋亡检测试剂盒购自江苏南京凯基生物科技发展有限公司; DRR037逆转录试剂盒(PrimeScript® RT reagent Kit Perfect Real Time), RR820荧光定量PCR试剂盒(SYBR® Premix Ex Taq™ Ⅱ)购自TaKaRa公司; 小鼠抗人β-catenin蛋白抗体; 兔抗人c-myc抗体购自美国CST公司.
1.2.1 细胞株及其培养: 人肝癌HepG2细胞由青岛大学医学院附属医院中心实验室惠赠. 细胞培养于含10%胎牛血清、100 U/mL青霉素和100 U/mL链霉素的1640培养液中, 置于37 ℃、5%CO2及饱和湿度的培养箱中培养生长.
1.2.2 DHA稀释: DHA用2.5 mL过滤除菌的无水酒精溶解后, 再用含2%胎牛血清的1640培养液稀释成15、30、45、60、75 μg/mL. 另配制成1 mg/mL的DHA储存液, 置于-80 ℃冰箱备用.
1.2.3 CCK-8法检测DHA对HepG2细胞生长增殖的影响: 培养细胞至对数生长期, 胰酶消化细胞制成细胞数为1×105/mL的细胞悬液, 以每孔200 μL接种于96孔板, 置于细胞培养箱中培养24 h细胞贴壁后, 分别加入15、30、45、60、75 μg/mL的DHA, 用等量的含2%胎牛血清的1640培养液设置阴性对照, 另外用不含细胞和DHA的含2%胎牛血清的1640培养液设置空白对照. 每种浓度均设5个复孔, 边缘孔加入少量PBS溶液, 置于细胞培养箱中分别培养24、48、72 h后取出每孔加入10 μL的CCK-8, 于摇床摇匀后置于细胞培养箱中培养3 h后终止培养, 测定每孔在波长为450 nm的细胞吸光度(A), 计算各组细胞的相对生在抑制率. 重复试验3次. 细胞存活率(%) = [(As-Ab)/(Ac-Ab)]×100%, As: 实验孔(含有细胞的培养基、CCK-8、DHA), Ac:对照孔(含有细胞的培养基、CCK-8、没有DHA), Ab:空白孔(不含细胞和DHA的培养基、CCK-8).
1.2.4 流式细胞术测定DHA对HepG2细胞的凋亡影响: 取对数生长期细胞, 胰酶消化后制成1×105/mL的细胞悬液, 以每孔1 mL加入24孔板, 待细胞培养箱中培养24 h后加入15、30、45 μg/mL的DHA, 用等量的2% 1640培养液设置阴性对照, 于细胞培养箱中培养24 h后用不含EDTA的胰酶消化细胞, 消化时加入2%的胎牛血清防止细胞消化过度. 离心收集细胞, 用预冷1×PBS(4 ℃)重悬细胞, 离心收集洗涤细胞, 加入300 μL的1×Binding Buffer重新悬浮细胞, 加入5 μL的Annexin V-FITC混匀后, 避光, 室温孵育15 min, 上机前5 min再加入5 μL的PI染色, 上机前, 补加200 μL的1×Binding Buffer. 阴性对照组分别设置双阴(不加Annexin V-FITC和PI)、双阳(加Annexin V-FITC和PI)、单阳(只加Annexin V-FITC或PI).
1.2.5 实时荧光定量RT-RCR测定HepG2细胞中β-catenin及C-myc基因的表达: (1)引物设计与合成 引物由上海生物工程股份有限公司设计合成. C-myc(Forward): CCTCCACTCGGAAGGACTATC; C-myc(Reverse): GTGTTCGCCTCTTGACATTCTC. β-catenin(Forward): ATGTCCAGCGTTTGGCTGAA; β-catenin (Reverse): TGGTCCTCGTCATTTAGCAGTT. GAPDH(Forward): CGGGGCTCTCCAGAACATC; GAPDH(Reverse): ATGACCTTGCCCACAGCCT; (2)RNA提取及cDNA合成将浓度为1×105/mL的细胞悬液2 mL铺至六孔板, 于细胞培养箱中培养24 h后弃去培养液, PBS冲洗两遍, 加入浓度分别为15、30、45 μg/mL的DHA后再培养24 h. 每孔加入0.5 mL的TRIzol按说明书步骤提取RNA, 所有标本通过光密度分析结果A260/280 = 1.8-2.0, 取RNA 3 μL逆转录成cDNA 10 μL, 反应体系包括: 5×PrimeScript® Buffer(for Real Time)2 μL, PrimeScript® RT Enzyme Mix I 0.5 μL, Oligo dT Primer(50 μmol/L)0.5 μL, Random 6 mers(100 μmol/L)0.5 μL, Total RNA 3 μL, RNase Free dH2O 3.5 μL. 反应条件37 ℃ 15 min, 85 ℃ 5 s; (3)实时荧光定量RT-PCR 20 μL反应体系包括SYBR®Premix Ex Taq™(2×)10 μL, PCR Forward Primer(10 μmol/L)0.8 μL, PCR Reverse Primer(10 μmol/L)0.8 μL, DNA模板2 μL, dH2O 6.4 μL. C-myc基因扩增反应条件: 95 ℃ 30 s变性, 95 ℃ 5 s, 58 ℃ 20 s, 60个循环. β-catenin基因扩增反应条件: 95 ℃ 30 s变性, 95 ℃ 5 s, 60 ℃ 20 s, 60个循环. 扩增完毕后, 进行溶解曲线及扩增曲线分析; (4)目的基因mRNA表达水平相对定量分析 以GAPDH为内参, 进行RT-PCR扩增, 测量各cDNA模板的Ct值, 通过Ct值进行相对定量分析, 实验组和对照组的基因表达的相对定量用2-∆∆Ct表示, 即2-∆∆Ct值表示实验组和对照组目的基因表达的倍数关系, 其中∆∆Ct = (实验组目的基因平均Ct值-实验组内参基因平均Ct值)-(对照组目的基因平均Ct值-对照组内参基因平均Ct值).
1.2.6 Western blot检测HepG2细胞中β-catenin和C-myc蛋白的表达: 将HepG2细胞经浓度为15、30、45 μg/mL的DHA处理后, 以等量的2%的不含DHA的1640培养液为对照组, 制备细胞蛋白裂解液, BCA蛋白试剂盒测定蛋白浓度, 取50 μg蛋白质样品上样, 与上样缓冲液按照4:1混合, 95 ℃ 5 min, 经聚丙烯酰胺凝胶电泳(75 V恒压80 min, 120 V恒压出现溴酚蓝刚出胶底部止)分离后转移至硝酸纤维素膜, 5%脱脂奶粉PBST溶液封闭1 h后加入相应的一抗(小鼠抗人β-catenin蛋白抗体, 稀释倍数1:1000、兔抗人C-myc蛋白抗体, 稀释倍数1:1000)4 ℃过夜, 和相应二抗37 ℃孵育1 h, PBST液洗涤5 min×3次, 按ECL试剂盒说明进行显色. 以β-actin为内参, 应用图像分析软件进行图像扫描分析蛋白表达情况.
统计学处理 应用SPSS18.0软件进行统计分析, 数据用mean±SD表示, CCK-8检测细胞生长增殖数据运用多因素方差分析, 其余数据采用单因素方差分析进行比较. P<0.05为差异有统计学意义.
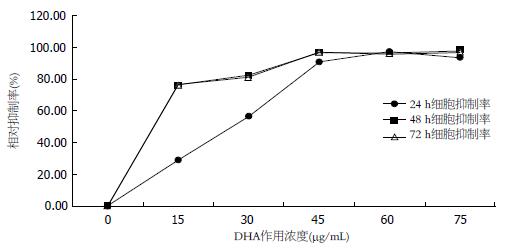
2.1.1 DHA作用浓度的影响: 不同浓度的DHA(15、30、45、60、75 μg/mL)对HepG2细胞作用前后细胞A值与对照组的差异均有显著的统计学意义(P<0.01). 在DHA浓度为15、30、45 μg/mL作用时, HepG2细胞任意两组相比细胞吸光度A的差异有显著统计学意义(P<0.01), 继续增加药物浓度, 差异无统计学意义.
2.1.2 DHA作用时间的影响: HepG2细胞在DHA作用24与48、72 h相比, 细胞吸光度A的差异有显著统计学意义(P<0.01), DHA作用48与72 h相比细胞吸光度A差异无统计学意义(P = 0.493>0.1). 不同DHA浓度和作用时间下各组HepG2细胞的吸光度如表1, 对各组细胞生长抑制率的影响如图1. 因此, 将DHA作用浓度为15、30、45 μg/mL, 作用时间24 h作为探讨其对人肝癌HepG2细胞作用机制的最佳条件.
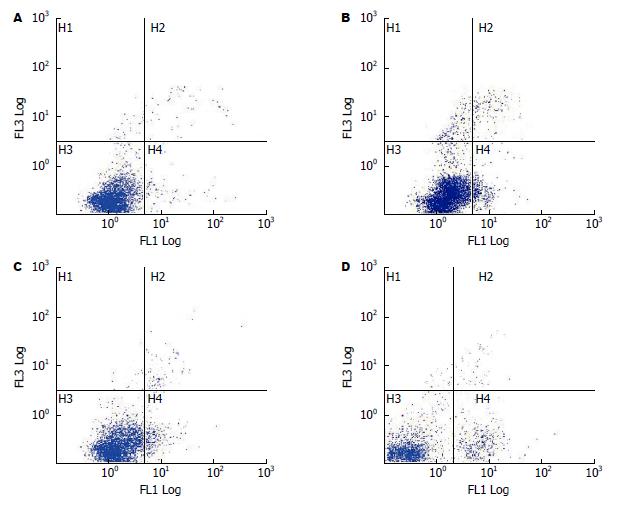
HepG2细胞经浓度为0、15、30、45 μg/mL的DHA处理后, 其细胞凋亡率分别为3.717%±1.013%、7.353%±2.206%、11.153%±1.240%、16.377%±2.000%(图2). 任意两组之间细胞凋亡率差异有显著统计学意义(P<0.01).
在不同DHA浓度作用下, 两种目的基因的相对表达量2-∆∆Ct值如表2. 不同浓度DHA对HepG2细胞作用前后实验组与对照组及各实验组之间C-myc基因相对表达量的差异有显著的统计学意义(P<0.01); 细胞实验组与对照组及各实验者组之间β-catenin基因的相对表达量差异无统计学意义.
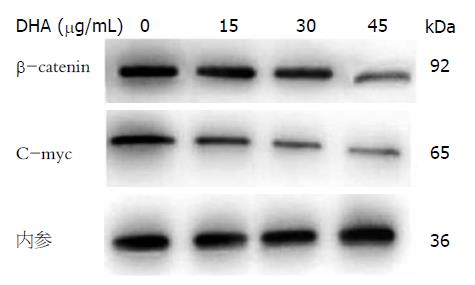
在不同浓度的DHA作用下, HepG2细胞的β-catenin、C-myc蛋白表达的结果如图3. 从图中可以看到: HepG2细胞β-catenin蛋白及C-myc蛋白水平随着DHA作用浓度升高表达量降低.
肝癌在所有恶性肿瘤的患病率中位居第5位, 然而其死亡率却高达第2位. 世界上每年死于肝癌的患者高达70万例, 且新增肝癌患者约75万例, 其中约一半的患者发生在中国[6]. 肝癌患者约有80%丧失手术机会, 即使获得根治性手术切除, 5年内仍有60%-70%的患者出现转移复发. 因此, 积极寻求一种针对肝癌患者安全有效的药物治疗方案已是十分必要.
本次研究中发现DHA在体外对人肝癌细胞HepG2起到抑制细胞生长增殖作用. 当DHA作用浓度从15-45 μg/mL, 作用时间24-48 h内对HepG2的生长增殖抑制作用呈现剂量-时间依赖关系, 在该范围内DHA作用浓度越大, 作用时间越长, 对肝癌细胞的生长增殖抑制作用就越大. 当进一步增加DHA的作用浓度可以发现其对肝癌细胞生长增殖的抑制作用并无明显增加. 同时, 通过流式细胞术发现DHA对肝癌细胞有促进凋亡的作用.
以DHA为代表的ω-3多不饱和脂肪酸可以杀伤人体多种肿瘤细胞, 但其具体机制却不甚明确, 可能与其改变生物膜的结构和功能, 增加细胞脂质过氧化作用、抑制相关癌基因编码蛋白及肿瘤新生血管形成、抑制细胞信号转导通路等有关[7,8]. Wnt信号通路是最近发现在肿瘤发生发展中起重要作用的信号传导通路, Wei等[9]发现Wnt蛋白在肝癌组织及其细胞系中表达增高, 与肝癌的发生有密切关系. Wnt信号进入胞内后, 使β-catenin不能被GSK-3β磷酸化. 磷酸化的β-catenin才可通过遍在蛋白化而被胞浆内的蛋白酶体所降解, 由于非磷酸化的β-catenin不能被蛋白酶体降解, 从而导致β-catenin在胞浆内积聚, 并移向核内, 上调靶基因C-myc等的表达. 通过推动细胞周期发展或产生异常蛋白, 使细胞发生癌变[10]. Wnt信号传导通路在肝癌细胞发生发展的许多阶段均有重要作用[11,12]. 本次研究中运用荧光定量PCR及Western blot从多个层面检测了不同浓度DHA作用前后β-catenin和C-myc基因及蛋白质水平的变化情况. 结果表明: 随着DHA的作用浓度增加, HepG2细胞中的β-catenin及C-myc蛋白的表达量降低, C-myc基因表达量降低, 但是β-catenin基因表达量未见明显变化. 说明DHA通过某种机制降低β-catenin蛋白质水平, 使得Wnt通路中的靶基因C-myc表达量降低. 进一步支持Lim[13]等研究, 其发现DHA可以促进Axin和GSK-3β结合形成降解β-catenin的复合物, 从而降低细胞质中β-catenin的蛋白浓度. 同时El-Bassiouni等[14]研究发现C-myc的过度表达与肝癌的发生发展有密切关系. 并有研究表明肝癌细胞中β-catenin在胞质中分布较多, 胞核可见明显积聚现象[15]. β-catenin在肝癌细胞中高表达并与其分化程度有关[16]. 这就进一步说明DHA对人肝癌的作用机制与降低β-catenin的蛋白质水平进而下调C-myc基因表达有关.
本次研究证实DHA可以抑制肝癌细胞生长增殖, 促进细胞凋亡. 其可能的机制是从蛋白质水平上降低了β-catenin的表达量, 进而下调了靶基因C-myc的表达量, 但随着DHA作用浓度及作用时间的进一步增加, 细胞的生在增殖的抑制作用趋于平缓, 推测在DHA抑制肝癌细胞生在增殖的过程中可能存在某个关键物质达到饱和状态, 限制了下游机制的进一步发生发展, 亦或当DHA作用浓度和作用时间达到一定程度时又引发了细胞的其他机制拮抗了药物的进一步作用, 其对肝癌细胞的作用机制还有待进一步研究.
二十二碳六烯酸(docosahexaenoic acid, DHA)是人体所必需的一种ω-3多不饱和脂肪酸, 是含有6个双键且碳链长度为22个碳原子的直链脂肪酸, 主要从食物尤其是深海鱼类中获得. 自发现以来, 其在防治心脑血管疾病方面的积极作用已得到世界公认. 近年来, 流行病学及基础研究均证明其具有降低肿瘤发病率及杀伤肿瘤细胞的作用, 然而其机制十分复杂, 详尽机制仍有待深入探讨.
戴朝六, 教授, 中国医科大学第二临床学院(盛京医院)肝胆外科
从基因及分子水平上探讨DHA对肝癌细胞的作用是当前研究的热点. Wnt/β-catenin通路异常活化与肿瘤的发生发展有着密切关系. 通过研究DHA对该通路的影响或能更进一步揭示及丰富其抗肿瘤的机制.
相关研究表明Wnt通路被激活后可以使β-catenin在细胞内积聚, 进而影响靶基因表达, 与肿瘤的发生发展有密切联系. C-myc已证实在多种肿瘤组织中高表达, 是决定细胞从G0/G1期进入S期的开关, 细胞提前进入S期, 启动和加速肿瘤的发生, 使肿瘤向恶性转化. 阻断wnt/β-catenin通路可以抑制肿瘤细胞生长并促进凋亡.
本研究主要基于CCK-8和流式细胞术检测不同浓度DHA对肝癌HepG2细胞抑制增殖及诱导凋亡的影响, 并且分别从基因和分子水平分析不同浓度DHA作用前后β-连环蛋白(β-catenin)及C-myc表达量的变化.
针对DHA对人肝癌HepG2细胞的影响及其作用机制的探讨, 有一定的理论价值并对将来开发相关药物有参考意义.
本文探讨DHA对人肝癌HepG2细胞有的生长增殖抑制与促进凋亡作用及其机制, 实验结果达到论文设计的要求, 对结果的解释恰当、合理. 具有一定的指导意义.
编辑 田滢 电编 鲁亚静
| 1. | Fernández E, Gallus S, La Vecchia C. Nutrition and cancer risk: an overview. J Br Menopause Soc. 2006;12:139-142. [PubMed] [DOI] |
| 2. | Gutt CN, Brinkmann L, Mehrabi A, Fonouni H, Müller-Stich BP, Vetter G, Stein JM, Schemmer P, Büchler MW. Dietary omega-3-polyunsaturated fatty acids prevent the development of metastases of colon carcinoma in rat liver. Eur J Nutr. 2007;46:279-285. [PubMed] [DOI] |
| 3. | Larsson SC, Kumlin M, Ingelman-Sundberg M, Wolk A. Dietary long-chain n-3 fatty acids for the prevention of cancer: a review of potential mechanisms. Am J Clin Nutr. 2004;79:935-945. [PubMed] |
| 4. | Kojima M, Wakai K, Tokudome S, Suzuki K, Tamakoshi K, Watanabe Y, Kawado M, Hashimoto S, Hayakawa N, Ozasa K. Serum levels of polyunsaturated fatty acids and risk of colorectal cancer: a prospective study. Am J Epidemiol. 2005;161:462-471. [PubMed] [DOI] |
| 5. | Kim J, Lim SY, Shin A, Sung MK, Ro J, Kang HS, Lee KS, Kim SW, Lee ES. Fatty fish and fish omega-3 fatty acid intakes decrease the breast cancer risk: a case-control study. BMC Cancer. 2009;9:216. [PubMed] [DOI] |
| 6. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 7. | Yu JH, Kang SG, Jung UY, Jun CH, Kim H. Effects of omega-3 fatty acids on apoptosis of human gastric epithelial cells exposed to silica-immobilized glucose oxidase. Ann N Y Acad Sci. 2009;1171:359-364. [PubMed] [DOI] |
| 8. | Spencer L, Mann C, Metcalfe M, Webb M, Pollard C, Spencer D, Berry D, Steward W, Dennison A. The effect of omega-3 FAs on tumour angiogenesis and their therapeutic potential. Eur J Cancer. 2009;45:2077-2086. [PubMed] [DOI] |
| 9. | Wei W, Chua MS, Grepper S, So SK. Blockade of Wnt-1 signaling leads to anti-tumor effects in hepatocellular carcinoma cells. Mol Cancer. 2009;8:76. [PubMed] [DOI] |
| 10. | Hoppler S, Kavanagh CL. Wnt signalling: variety at the core. J Cell Sci. 2007;120:385-393. [PubMed] |
| 11. | Branda M, Wands JR. Signal transduction cascades and hepatitis B and C related hepatocellular carcinoma. Hepatology. 2006;43:891-902. [PubMed] [DOI] |
| 12. | Monga SP. Hepatic adenomas: presumed innocent until proven to be beta-catenin mutated. Hepatology. 2006;43:401-404. [PubMed] [DOI] |
| 13. | Lim K, Han C, Dai Y, Shen M, Wu T. Omega-3 polyunsaturated fatty acids inhibit hepatocellular carcinoma cell growth through blocking beta-catenin and cyclooxygenase-2. Mol Cancer Ther. 2009;8:3046-3055. [PubMed] [DOI] |
| 14. | El-Bassiouni A, Nosseir M, Zoheiry M, El-Ahwany E, Ghali A, El-Bassiouni N. Immunohistochemical expression of CD95 (Fas), c-myc and epidermal growth factor receptor in hepatitis C virus infection, cirrhotic liver disease and hepatocellular carcinoma. APMIS. 2006;114:420-427. [PubMed] [DOI] |