修回日期: 2014-03-20
接受日期: 2014-03-28
在线出版日期: 2014-05-08
目的: 探讨超早期肠内营养(enteral nutrition, EN)对重度急性胰腺炎(severe acute pancreatitis, SAP)大鼠肠黏膜屏障功能的影响.
方法: 将60只♂SD大鼠分为假手术组(Sham组15只)、SAP空白对照组(SAP组15只)、肠内营养组(EN组15只)、肠外营养组(parenteral nutrition, PN组15只). SAP大鼠模型制作采用逆行胆胰管注射5%牛磺胆酸钠法, 假手术组以生理盐水代替. 假手术组与SAP空白对照组在术后6 h给予生理盐水, 其他2组在术后6 h分别给予肠内、肠外营养液支持治疗. 所有组均在造模后第48小时处死大鼠. 处死前抽取外周血检测血浆淀粉酶、内毒素、二胺氧化酶的含量. 各组取胰腺组织分别计算胰腺病理评分和胰腺脓肿发生率; 各组取末端回肠组织常规光镜观察回肠末端黏膜形态学变化, 测量黏膜厚度和绒毛高度.
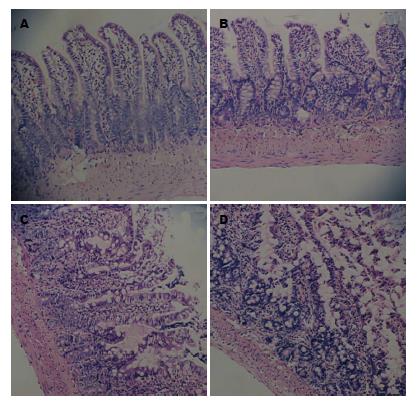
结果: SAP空白对照组大鼠血浆内毒素和二胺氧化酶水平分别为0.545 EU/mL±0.095 EU/mL、1.52 U/mL±0.09 U/mL, PN组大鼠二者血浆水平分别下降为0.333 EU/mL±0.046 EU/mL、1.17 U/mL±0.10 U/mL, EN组大鼠则继续下降至0.247 EU/mL±0.069 EU/mL、0.91 EU/mL±0.13 EU/mL, 与SAP空白对照组比较, EN组内毒素水平(P<0.01), 与PN组比较, EN组内毒素水平(P<0.05); 与前两组比较, EN组二胺氧化酶水平(P<0.01). SAP空白对照组、EN组、PN组血浆淀粉酶水平分别为10171 U/L±665.77 U/L、9428.2 U/L±1076.61 U/L、10533 U/L±1669.13 U/L, 三组间比较无显著差异. 胰腺病理评分: SAP空白对照组14.50±1.05、PN组10.44±1.01, EN组8.08±1.24, 与前两组比较, EN组有显著差异(P<0.01); 胰腺脓肿发生率: SAP空白对照组9/15、PN组6/15、EN组2/15, 三组比较无显著差异. 末端回肠黏膜病理分析显示: SAP空白对照组大鼠末端回肠黏膜厚度和绒毛高度分别为226.67 µm±20.84 µm、137.33 µm±9.38 µm, EN组大鼠294.79 µm±20.49 µm、194.54 µm±11.96 µm, PN组大鼠306.11 µm±24.34 µm、201.72 µm±10.60 µm, 与SAP空白对照组相比, EN组和PN组大鼠回肠黏膜厚度及绒毛高度明显改善(P<0.01), 但EN组和PN组比较未见显著差异.
结论: 超早期肠内营养能改善SAP大鼠肠道屏障功能, 减轻肠源性内毒素血症.
核心提示: 本研究利用重度急性胰腺炎(severe acute pancreatitis, SAP)动物模型, 选择超早期(发病后6 h)给予肠内营养(enteral nutrition, EN), 发现超早期EN能改善SAP大鼠肠道屏障功能, 减轻肠源性内毒素血症, 为早期EN在SAP中的临床应用提供理论基础和实验依据.
引文著录: 林浩, 陈杰, 刘立玺, 胡兆鹏, 朱方擎, 李兴, 龚敏, 文萍, 文剑波. 超早期肠内营养对重度急性胰腺炎大鼠肠黏膜屏障功能的影响. 世界华人消化杂志 2014; 22(13): 1785-1792
Revised: March 20, 2014
Accepted: March 28, 2014
Published online: May 8, 2014
AIM: To investigate the effect of early enteral nutrition on the intestinal barrier function in rats with severe acute pancreatitis (SAP).
METHODS: Sixty male Sprague-Dawley rats were randomly allocated into 4 groups: a sham-operation group (n = 15), an SAP group (control group, n =15), a parenteral nutrition group (PN group, n = 15) and an enteral nutrition group (EN group, n = 15). SAP was induced by retrograde injection of 5% sodium taurocholate into the biliopancreatic duct. Rats in the sham-operation group only underwent laparotomy without induction of SAP. Six hours after surgery, rats in the former two groups were given normal saline, while those in the latter two groups were administrated with EN and PN, respectively. All rats were sacrificed 48 h after operation. Serum levels of amylase (AMS), endotoxin and diamine oxidase (DAO) were detected. Pathological changes of the pancreas were observed by light microscopy. The incidence of pancreatic abscess was calculated. The sections of terminal ileum were obtained to measure the height of villi and the thickness of the mucosa.
RESULTS: Plasma levels of endotoxin and DAO were significantly lower in the EN group than in the SAP group and PN group (endotoxin: 0.247 EU/mL ± 0.069 EU/mL vs 0.545 EU/mL ± 0.095 EU/mL, 0.333 EU/mL ± 0.046 EU/mL; P < 0.05 for the PN group, P < 0.01 for the SAP group; DAO: 0.91 EU/mL ± 0.13 EU/mL vs 1.52 U/mL ± 0.09 U/mL, 1.17 U/mL ± 0.10 U/mL; P < 0.01 for both). There were no significant differences in plasma amylase (AMS) between the SAP group, EN group and PN group (10171 U/L ± 665.77 U/L vs 9428.2 U/L ± 1076.61 U/L vs 10533 U/L ± 1669.13 U/L). The histological score of the injured pancreas in the EN group was markedly decreased in comparison with those in the SAP group and PN group (8.08 ± 1.24 vs 14.50 ± 1.05, 10.44 ± 1.01; P < 0.01 for both). The rate of pancreatic abscess in the three groups was not statistically different (SAP group: 9/15, EN group: 2/15, PN group: 6/15). Compared with the SAP group, the thickness of the mucosa and height of villi were improved obviously in both the EN group and PN group (thickness of mucosa: 226.67 µm ± 20.84 µm vs 294.79 µm ± 20.49 µm, 306.11 µm ± 24.34 µm; P < 0.01 for both; height of villi: 137.33 µm ± 9.38 µm vs 194.54 µm ± 11.96 µm, 201.72 µm ± 10.60 µm; P < 0.01 for both), although there was no significant difference between the EN group and PN group.
CONCLUSION: Early enteral nutrition can significantly improve the gut barrier function and ameliorate intestinal endotoxemia in rats with SAP.
- Citation: Lin H, Chen J, Liu LX, Hu ZP, Zhu FQ, Li X, Gong M, Wen P, Wen JB. Early enteral nutrition improves intestinal barrier function in rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2014; 22(13): 1785-1792
- URL: https://www.wjgnet.com/1009-3079/full/v22/i13/1785.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i13.1785
重度急性胰腺炎(severe acute pancreatitis, SAP)是临床常见的危重急症, 病死率约36%-50%, 如后期合并感染则病死率极高[1]. SAP发病机制复杂, 其中肠黏膜屏障功能受损时, 可出现肠道细菌和内毒素移位, 发生肠源性内毒素血症, 导致胰腺组织及其他远处器官继发感染, 这促进了全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)及多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)的发生, 而SIRS和MODS的发展又加重了肠黏膜屏障功能的破坏, 形成恶性循环, 因此肠道是控制SAP发生发展的"中心器官"之一[2-4]. 一系列的研究表明: SAP发病后数小时即出现肠道屏障功能损害的迹象, 比如肠上皮细胞的凋亡、肠道通透性增加等[5-7]. 而近年来国内外研究显示早期肠内营养(enteral nutrition, EN)能改善SAP的肠道屏障功能, 从而提高预后水平[8-17]. 但其给予的具体时机目前尚无定论. 因此, 本研究选择SAP超早期(发病后6 h)给予EN, 探讨其对SAP大鼠肠道屏障功能的影响, 为早期EN在SAP中的临床应用提供理论基础和实验依据.
♂SD大鼠(上海斯莱克实验动物有限公司); 百普素(荷兰纽迪希亚公司); 8.5%乐凡命、20%脂肪乳注射液、安达美、水乐维他、维他利匹特(华瑞制药有限公司); 50%葡萄糖注射液(北京双鹤药业有限公司); 戊巴比妥钠(南方医科大学试剂中心); 内毒素检测鲎试剂盒(厦门市鲎试剂实验厂有限公司); 牛磺胆酸钠、二胺氧化酶标准品、戊二胺、辣根过氧化物酶、邻联二茴香胺(美国Sigma公司); 结合式阻血夹(新华手术器械有限公司); 输液用连通管(德清县新德意医疗器械有限公司); 儿童头皮针(浙江康德莱医疗器械股份有限公司); 微量注射泵(浙江史密斯医学仪器有限公司); AU2700全自动生化分析仪(日本奥林巴斯公司); 台式高速低温离心机(Beckman公司); UV754分光光度计(上海分析仪器厂); 光学显微镜和测微尺(日本NIKON公司); 自制大鼠固定器.
1.2.1 动物分组: ♂SD大鼠60只, 体质量250-300 g, 分为4组: 假手术组(Sham组15只)、SAP空白对照组(SAP组15只)、肠外营养组(parenteral nutrition, PN组15只)、肠内营养组(EN组15只). SD大鼠适应性喂养1 wk后进行实验.
1.2.2 SAP模型的制备: 大鼠术前禁食12 h, 但不禁水, 以2%戊巴比妥钠(每100 g体质量0.35 mL)腹腔注射麻醉后, 无菌条件下剖腹, 提起十二指肠, 以结合式阻血夹夹住肝门部胆胰管, 在近十二指肠胆胰管处用1 mL注射器穿刺, 逆行注射5%牛磺胆酸钠(每100 g体质量0.1 mL), 注射后拔除穿刺针, 以结合式阻血夹夹住近十二指肠处胆胰管, 见胰腺组织充血、水肿, 被膜下有散在出血点, 标志造模成功. 假手术组以同体积生理盐水代替牛磺胆酸钠逆行注射. 术后各组大鼠给予背部皮下注射生理盐水(每100 g体质量2 mL), 并自由饮水. 假手术组与SAP空白对照组于造模后6 h给予生理盐水, EN组与PN组于造模后6 h分别给予EN、PN. 各组大鼠于造模后48 h处死.
1.2.3 喂养途径的建立: (1)EN途径建立: 经胃幽门区, 置入已用生理盐水充盈的输液用连通管, 远端位于空肠屈氏韧带以下5 cm左右, 在胃部荷包缝合固定, 经皮下隧道将硅胶管自左侧腹部引出, 固定于左侧腹部皮肤, 连接于微量输液泵, 并将大鼠放入自制固定器内生活. 假手术组与SAP空白对照组亦采用此方法, 但以生理盐水代替EN制剂; (2)肠外营养途径建立: PN组大鼠在胃幽门区和左侧腹壁制作与EN组相同的创面, 但不置管. 术后放入自制固定器后用75%乙醇擦拭暴露尾静脉, 用已连接于输液用连通管的5.5号儿童头皮针行尾静脉穿刺, 见回血后轻推入少许生理盐水, 并连接于微量输液泵, 穿刺处用医用胶布固定.
1.2.4 营养液配置及给予: (1)肠内营养液(EN)配置: 将125 g百普素用温开水溶解成500 mL的溶液; (2)肠外营养液(TPN)配置: 每100 mL营养液用8.5%乐凡命50 mL, 20%脂肪乳注射液18.8 mL, 50%葡萄糖溶液30 mL及安达美、水乐维他、维他利匹特各0.4 mL配置. 两种营养液每100 mL所含非蛋白热卡及含氮量基本一致; (3)营养液给予: EN组在造模成功后4 h给予2 mL生理盐水冲洗肠管, 后用微量输液泵肠内间歇推注营养液(每次推注5 mL, 速度30 mL/h, 1 d推注7次, 总热卡为35 kcal, 两次推注的时间间隔为2 h). 肠外营养组给予微量输液泵均匀推注营养液(每次推注12 mL, 速度4 mL/h, 1 d推注3次, 总热卡约36 kcal, 两次推注的时间间隔为6 h, 含推注时间3 h). 各组的总液体入量及总热卡量大致相等. 假手术组和SAP空白对照组以生理盐水代替EN制剂, 其给液速度、剂量、频率与EN组相同.
1.2.5 检测指标和检测: (1)血浆指标的检测: 各组大鼠均在造模后48 h心脏穿刺采血后处死. 使用内毒素检测鲎试剂盒, 采用动态浊度法, 对血浆样品进行内毒素检测; 采用黎君友等[18]改良的分光光度法检测血浆中二胺氧化酶(DAO)活性; 使用AU2700全自动生化分析仪(日本奥林巴斯公司)测量血清淀粉酶浓度; (2)病理指标的检测: 各组大鼠切取胰腺及末端回肠, 用生理盐水冲洗后, 经固定、包埋、切片、染色等处理. 胰腺病理学评分按照国际改良的Schmidt标准法联合Rongione法[19,20], 制定以下评分标准(表1). 光镜下取3张非连续切片各5个随机视野, 每个视野病理总分为各单项分之和, 每张切片的病理评分为5视野分值的平均数, 三张切片的平均分为该大鼠的最终胰腺病理得分, 同时肉眼观察胰腺脓肿的发生率; 在常规光镜下, 观察末端回肠组织的形态学变化, 并采用目镜测微尺分别测定3张非连续切片各5个随机视野的黏膜厚度及绒毛高度, 3张切片的平均值为该大鼠的最终分值.
| 组织病变 | 评分项目和积分 | ||||
| 0 | 1 | 2 | 3 | 4 | |
| 水肿 | 无 | 区域性小叶间隔增宽 | 弥漫性小叶间隔增宽 | 2+腺泡间隔增宽 | 3+细胞间隔增宽 |
| 坏死 | 无 | 腺管周围实质破坏 | 小叶缺失<20% | 小叶缺失20%-50% | 小叶缺失>50% |
| 出血 | 无 | 胰腺实质出血<20% | 实质出血20%-50% | 实质出血50%-75% | 实质出血>75% |
| 炎细胞浸润 | 无 | 白细胞2-10个 /HP | 11-20个/HP | 21-30个/HP | >30个/HP或出现微脓肿 |
统计学处理 采用SPSS16.0统计软件包处理数据. 计量数据采用mean±SD表示, 多样本均数比较采用单因素方差分析, 均数间两两比较, 根据方差齐性分别采用LSD法、Bonferroni法或DunnettT3法、DunnettC法, P<0.05为差异有统计学意义. 多个样本率的两两比较采用卡方检验, P<0.007为差异有统计学意义.
建模后, SAP空白对照组、EN组和PN组大鼠均出现精神倦怠、少动、竖毛、泪腺分泌物增多等症状. 假手术组大鼠术后同样出现类似症状, 但程度较轻, 术后6-8 h大鼠活动开始活跃.
与假手术组相比, SAP空白对照组、EN组、PN组血浆内毒素水平均明显升高(P<0.01), 与SAP空白对照组相比, 经过营养支持治疗后的PN组与EN组大鼠血浆内毒素水平下降, 差异有统计学意义(P<0.01), 其中EN组内毒素水平下降幅度高于PN组(P<0.05)(表2).
与假手术组相比, 其余各组血浆二胺氧化酶水平均明显上升(P<0.01). 与SAP空白对照组和PN组比较, EN组大鼠血浆二胺氧化酶水平表达降低(P<0.01)(表2).
假手术组大鼠血清淀粉酶水平在各组中最低(P<0.01). 经过牛磺胆酸钠造模后, SAP空白对照组、EN组、PN组大鼠血清淀粉酶水平显著高于假手术组(P<0.01), 但SAP空白对照组、EN组、PN组组间未见明显差异(表2).
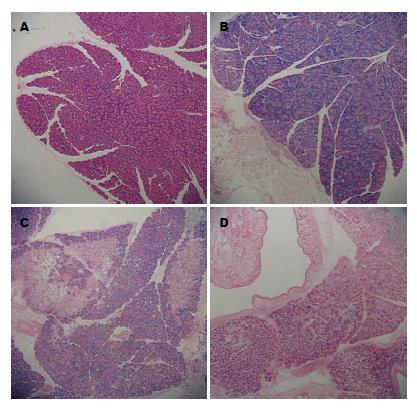
假手术组大鼠胰腺病理切片偶可见局限性小叶间隔增宽, 无坏死、出血及血管周围或小叶内白细胞浸润; 其他各组胰腺病理切片均可见不同程度的上述表现, 并且严重程度在不同组内可有部分交叉. (1)胰腺病理评分: 与假手术组相比, SAP空白对照组、EN组和PN组的病理评分明显升高, 差异具有统计学意义(P<0.01); 相比于SAP空白对照组, EN和PN组评分均明显降低(P<0.01), 同时EN组评分低于PN组, 差异有统计学意义(P<0.01); (2)大鼠胰腺脓肿发生率: 假手术组(0/15)、SAP空白对照组(9/15)、EN组(2/15)、PN组(6/15); 与假手术组相比, SAP空白对照组大鼠胰腺脓肿发生率明显上升(P<0.00313), 但SAP空白对照组、EN组及PN组组间比较, 未见明显统计学差异(表3, 图1).
SAP是消化系统疾病中常见的需要紧急入院治疗的疾病之一. 该病发病机制复杂, 其中肠道屏障功能障碍作为SAP发生发展的"中心器官"之一, 在SIRS及MODS的演变进展中扮演重要角色. 一系列动物实验显示, SAP发病后3 h即可出现肠上皮细胞凋亡, 6 h肠道通透性开始增高、在起病8-18 h内即有肠道细菌移位、感染[5-7]. 在临床研究中发现, SAP患者的肠道通透性明显高于轻症患者, 特别是合并有MODS或者最终死亡的患者[21]. 因此, 早期干预肠道屏障功能的继续损害, 显得尤为重要.
近年来众多基础实验和临床研究均发现, 早期EN能有效改善肠黏膜屏障功能, 限制肠道细菌移位, 有效减轻SIRS和MODS的发生发展, 从而显著改善预后[8-17]. 但是关于实施早期EN的具体时机国内外学界尚无定论, 鉴于SAP发病后数小时即可能出现肠道屏障功能损害, 故本研究选择SAP超早期(发病后6 h)给予EN, 探讨其对SAP大鼠肠道屏障功能的影响, 为早期EN在SAP中的临床应用提供理论基础和实验依据.
在本试验中我们首先观察到, 与假手术组相比, 各组重度急性胰腺炎大鼠血清淀粉酶水平明显升高, 结合胰腺病理切片, 可以证实SAP大鼠模型制作成功.
其次, 正常运作的肠黏膜屏障可以阻止肠腔内有害的物质包括细菌及其内毒素等进入血循环[22,23]. 但是在SAP时, 肠黏膜通透性增加, 大分子的内毒素可以通过门静脉进入全身各组织器官, 参与SIRS、MODS的过程, 而肠源性内毒素血症又进一步增加肠道黏膜通透性, 形成恶性循环[24-26]. 有资料表明, 内毒素在发病早期即可移位至各器官, 在大多数SAP患者外周血中均可以测到内毒素, 且疾病严重程度与内毒素水平呈正相关[27,28]. 因此内毒素水平可作为评价SAP肠道屏障功能和疾病预后的有价值的指标. 本研究血浆内毒素水平检测显示, 各组大鼠血浆内毒素水平均较假手术组有明显上升, 故初步考虑SAP已经导致肠道黏膜通透性增加, 而组间比较发现, EN组大鼠内毒素水平最低, 从而推测EN组大鼠肠道屏障损害最小, 说明超早期EN可减少内毒素的吸收.
DAO存在于人类和所有哺乳动物小肠绒毛上皮细胞胞浆中, 具有高特异性、高活性、高含量的特点. 当肠屏障功能障碍时, 绒毛上皮细胞破坏, 该酶释放入血, 导致血浆浓度增高, 因其在外周血中活性稳定, 故可通过测定其在外周血中的变化, 评估肠道屏障破坏程度[29]. 通过检测血浆DAO, 我们发现, 与假手术组相比较, 其他各组大鼠血浆DAO浓度明显增加. 在SAP空白对照组、EN组和PN组的比较中, SAP空白对照组大鼠血DAO水平较EN组和PN组增高, 说明该组大鼠末端回肠绒毛上皮细胞破坏更加严重. EN组与PN组相比, 血DAO水平下降, 提示SAP发病后6 h给予EN能部分改善SAP重创下的肠道屏障. PN组与SAP空白对照组相比, 血中DAO水平亦低于后者, 提示在SAP高代谢的状态下, 及时给予营养支持的重要性, 结合三组实验结果, 可以推测在SAP治疗过程中, 营养支持及其途径的选择均是影响SAP预后的重要因素.
上述提及, 肠道是SAP发生发展的"中心器官"之一. 有研究发现, 多数的胰腺及其周围组织感染是由肠源性菌群移位引起[30,31]. 我们在观察SAP空白对照组、EN组、PN组大鼠胰腺组织时发现: SAP空白对照组中, 出现胰腺脓肿的大鼠只数明显多于EN组和PN组, 虽三组组间胰腺脓肿的发生率未见明显差异, 但根据胰腺脓肿发生的趋势, 结合本实验中所观察到的末端回肠组织病理学变化情况, 我们考虑SAP大鼠在发病后48 h内可能就有细菌移位至胰腺, 并且肠道屏障功能的保存程度与胰腺感染的严重度呈一定的相关性.
总之, 超早期EN可能通过改善肠黏膜屏障功能, 减少肠源性内毒素移位, 从而减轻SIRS及MODS发生发展, 在动物实验中体现了其有效性和安全性, 为早期EN在SAP中的临床应用提供理论基础和实验依据.
重度急性胰腺炎(severe acute pancreatitis, SAP)是临床上常见的急危重症, 死亡率高达36%-50%. 该病发病机制复杂, 其中肠黏膜屏障功能损伤后可出现肠道细菌和内毒素移位, 引发机体感染, 形成"二次打击", 从而加重全身炎症反应综合征(systemic inflammatory response syndrome)和多器官功能障碍综合征(multiple organ dysfunction syndrome)的发生发展, 这是导致SAP患者死亡的主要原因之一.
谭学瑞, 教授, 汕头大学医学院第一附属医院内科
众多研究表明早期肠内营养可有效保护肠黏膜屏障, 减少肠源性细菌和内毒素移位, 从而改善SAP患者预后, 但是实施早期肠内营养的具体时机, 目前国内外学界尚无定论.
近年来研究发现SAP发病后数小时即可出现肠道黏膜屏障功能的损害引起肠源性细菌和内毒素的移位.
目前尚无SAP起病后6 h即给予肠内营养并观察其对肠道黏膜屏障功能影响的研究.
本研究利用动物模型, 有效解决了临床研究中患者起病时间的不准确性、治疗的安全性、患者的依从性等限制因素, 并证实超早期肠内营养能改善SAP大鼠肠道屏障功能, 减轻肠源性内毒素血症, 为进一步的临床研究提供依据.
本文立意较新颖, 实验结果可信, 对临床工作有一定参考价值.
编辑 田滢 电编 鲁亚静
| 2. | Ammori BJ. Role of the gut in the course of severe acute pancreatitis. Pancreas. 2003;26:122-129. [PubMed] [DOI] |
| 3. | Gloor B, Müller CA, Worni M, Martignoni ME, Uhl W, Büchler MW. Late mortality in patients with severe acute pancreatitis. Br J Surg. 2001;88:975-979. [PubMed] [DOI] |
| 4. | Ogawa M. Acute pancreatitis and cytokines: "second attack" by septic complication leads to organ failure. Pancreas. 1998;16:312-315. [PubMed] |
| 6. | Yasuda T, Takeyama Y, Ueda T, Shinzeki M, Sawa H, Nakajima T, Kuroda Y. Breakdown of intestinal mucosa via accelerated apoptosis increases intestinal permeability in experimental severe acute pancreatitis. J Surg Res. 2006;135:18-26. [PubMed] [DOI] |
| 7. | Schwarz M, Thomsen J, Meyer H, Büchler MW, Beger HG. Frequency and time course of pancreatic and extrapancreatic bacterial infection in experimental acute pancreatitis in rats. Surgery. 2000;127:427-432. [PubMed] [DOI] |
| 11. | Kotani J, Usami M, Nomura H, Iso A, Kasahara H, Kuroda Y, Oyanagi H, Saitoh Y. Enteral nutrition prevents bacterial translocation but does not improve survival during acute pancreatitis. Arch Surg. 1999;134:287-292. [PubMed] [DOI] |
| 12. | Wang G, Sun B, Gao Y, Meng QH, Jiang HC. The effect of emodin-assisted early enteral nutrition on severe acute pancreatitis and secondary hepatic injury. Mediators Inflamm. 2007;2007:29638. [PubMed] [DOI] |
| 13. | Omura K, Hirano K, Kanehira E, Kaito K, Tamura M, Nishida S, Kawakami K, Watanabe Y. Small amount of low-residue diet with parenteral nutrition can prevent decreases in intestinal mucosal integrity. Ann Surg. 2000;231:112-118. [PubMed] [DOI] |
| 14. | Windsor AC, Kanwar S, Li AG, Barnes E, Guthrie JA, Spark JI, Welsh F, Guillou PJ, Reynolds JV. Compared with parenteral nutrition, enteral feeding attenuates the acute phase response and improves disease severity in acute pancreatitis. Gut. 1998;42:431-435. [PubMed] [DOI] |
| 15. | Marik PE, Zaloga GP. Meta-analysis of parenteral nutrition versus enteral nutrition in patients with acute pancreatitis. BMJ. 2004;328:1407. [PubMed] [DOI] |
| 16. | Petrov MS, Pylypchuk RD, Uchugina AF. A systematic review on the timing of artificial nutrition in acute pancreatitis. Br J Nutr. 2009;101:787-793. [PubMed] [DOI] |
| 17. | Heyland DK, Dhaliwal R, Drover JW, Gramlich L, Dodek P. Canadian clinical practice guidelines for nutrition support in mechanically ventilated, critically ill adult patients. JPEN J Parenter Enteral Nutr. 2003;27:355-373. [PubMed] |
| 19. | Rongione AJ, Kusske AM, Kwan K, Ashley SW, Reber HA, McFadden DW. Interleukin 10 reduces the severity of acute pancreatitis in rats. Gastroenterology. 1997;112:960-967. [PubMed] [DOI] |
| 20. | Schmidt J, Rattner DW, Lewandrowski K, Compton CC, Mandavilli U, Knoefel WT, Warshaw AL. A better model of acute pancreatitis for evaluating therapy. Ann Surg. 1992;215:44-56. [PubMed] |
| 21. | Ammori BJ, Leeder PC, King RF, Barclay GR, Martin IG, Larvin M, McMahon MJ. Early increase in intestinal permeability in patients with severe acute pancreatitis: correlation with endotoxemia, organ failure, and mortality. J Gastrointest Surg. 1999;3:252-262. [PubMed] [DOI] |
| 22. | Wischmeyer PE. Glutamine: role in gut protection in critical illness. Curr Opin Clin Nutr Metab Care. 2006;9:607-612. [PubMed] [DOI] |
| 23. | MacFie J. Enteral versus parenteral nutrition: the significance of bacterial translocation and gut-barrier function. Nutrition. 2000;16:606-611. [PubMed] [DOI] |
| 27. | Penalva JC, Martínez J, Laveda R, Esteban A, Muñoz C, Sáez J, Such J, Navarro S, Feu F, Sánchez-Payá J. A study of intestinal permeability in relation to the inflammatory response and plasma endocab IgM levels in patients with acute pancreatitis. J Clin Gastroenterol. 2004;38:512-517. [PubMed] |
| 28. | Vasilescu C, Herlea V, Buttenschoen K, Beger HG. Endotoxin translocation in two models of experimental acute pancreatitis. J Cell Mol Med. 2003;7:417-424. [PubMed] [DOI] |
| 30. | Nettelbladt CG, Katouli M, Bark T, Svenberg T, Möllby R, Ljungqvist O. Evidence of bacterial translocation in fatal hemorrhagic pancreatitis. J Trauma. 2000;48:314-315. [PubMed] [DOI] |
| 31. | 张 泰昌. 急性胰腺炎继发细菌性感染的临床特点及治疗. 国外医学: 消化系疾病分册. 1993;13:5-8. |