修回日期: 2013-01-20
接受日期: 2013-02-20
在线出版日期: 2013-03-18
目的: 探讨PI3Kp110不同亚单位p110α、p110β在结直肠腺瘤癌变过程中的表达及其相关性.
方法: 随机选择低级别上皮内瘤变(low-grade intraepithelial neoplasia, LGIN)腺瘤组织46例、高级别上皮内瘤变(high-grade intraepithelial neoplasia, HGIN)腺瘤组织32例、结直肠腺瘤癌变组织60例以及30例正常黏膜组织, 应用免疫组织化学染色法, 分别检测p110α、p110β的表达情况, 分析两者表达的相关性及其与临床病理因素的关系.
结果: (1)p110α在癌组织中的的表达明显高于LGIN腺瘤及正常组织(P<0.05), 但与HGIN腺瘤无明显差异(P>0.05); 而在HGIN腺瘤中的表达高于LGIN腺瘤及正常组织, 且差异有统计学意义(58.64±15.37 vs 37.80±14.47, P<0.05). p110β在癌组织、HGIN腺瘤、LGIN腺瘤及正常组织中的表达逐渐降低, 且差异有统计学意义(P<0.05); (2)癌组织中p110α的表达与年龄、肿瘤直径、分化程度有相关性(P<0.05), 而与患者的性别、肿瘤的发病部位、TNM分期及淋巴结转移等因素无关(P>0.05); p110β的表达与肿瘤的分化程度、TNM分期等临床因素间具有相关性(P<0.05), 与患者的性别、年龄、肿瘤直径、发病部位及淋巴结转移等因素无关(P>0.05); (3)p110α、p110β在LGIN腺瘤中的表达呈正相关关系(r = 0.419, P<0.05), 而在癌组织、HGIN腺瘤、正常组织中的表达无相关性(r = 0.145、-0.036、0.242, P>0.05).
结论: p110α与p110β分别在腺瘤向腺癌转化过程的不同阶段中发挥重要作用, 联合检测p110α、p110β的表达可作为早期预测腺瘤癌变的指标.
引文著录: 孟晓, 吴淑华, 李扬扬, 田东. PI3Kp110不同亚单位在结直肠腺瘤癌变中的表达及相关性. 世界华人消化杂志 2013; 21(8): 661-666
Revised: January 20, 2013
Accepted: February 20, 2013
Published online: March 18, 2013
AIM: To investigate the expression of PI3Kp110α and PI3Kp110β in colorectal canceration and to analyze their correlation.
METHODS: PI3Kp110α and PI3Kp110β expression was detected by immunohistochemistry in 30 cases of normal colorectal mucosa, 46 cases of low-grade intraepithelial neoplasia (LGIN), 32 cases of high-grade intraepithelial neoplasia (HGIN) and 60 cases of colorectal carcinoma.
RESULTS: The expression of PI3Kp110α in colorectal carcinoma was significantly higher than that in normal colorectal mucosa and LGIN (both P < 0.05), but there was no significant difference between colorectal carcinoma and HGIN (P > 0.05). The expression of PI3Kp110β was highest in colorectal carcinoma, followed by HGIN, LGIN and normal colorectal mucosa (P < 0.05). PI3Kp110α expression was correlated with patient age, tumor size and tumor differentiation (all P < 0.05). PI3Kp110β expression was correlated with TNM stage and degree of tumor differentiation (both P < 0.05). The expression of PI3Kp110α was positively correlated with that of PI3Kp110β in LGIN (P < 0.05). There was no significant correlation between the expression of PI3Kp110α and that of PI3Kp110β in colorectal carcinoma, HGIN or normal colorectal mucosa (all P > 0.05).
CONCLUSION: PI3Kp110α and p110β may play different roles in colorectal canceration.
- Citation: Meng X, Wu SH, Li YY, Tian D. Expression of PI3Kp110α and PI3Kp110β in colorectal canceration. Shijie Huaren Xiaohua Zazhi 2013; 21(8): 661-666
- URL: https://www.wjgnet.com/1009-3079/full/v21/i8/661.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i8.661
PI3Kp110是磷酸肌醇-3-激酶(phosphoinositide3-kinases, PI3K)/蛋白激酶B(protein kinase B, PKB)细胞信号通路中核心分子PI3Ks的催化亚基[1]. PI3K/AKT细胞信号通路的活化可通过影响下游信号因子调节细胞的生长、生存、增殖以及迁移等[2-5], 而PI3Ks的突变可导致PI3K/AKT细胞信号通路异常, 与结直肠癌的发生、发展密切相关[6,7]. 90%的结直肠癌来自腺瘤的恶变, 即腺瘤-腺癌序列[8], 但在此过程中PI3Kp110的不同亚单位所发挥的作用及其相关性尚不明确. 本文分别在正常组织、低级别上皮内瘤变腺瘤组织、高级别上皮内瘤变腺瘤组织以及由腺瘤癌变的癌组织中对PI3Kp110的不同亚单位p110α、p110β的表达情况进行了研究, 进一步探索PI3Kp110不同亚单位在结直肠腺瘤癌变过程中的表达情况及其意义.
收集滨州医学院附属医院病理科2011-01/2012-03存档的结直肠组织蜡块共168例. 其中, 结直肠腺瘤癌变60例, HGIN腺瘤组织32例, LGIN腺瘤组织46例, 正常黏膜组织30例. 选取的所有病例均为首次发现, 术前未进行任何放化疗且未发现其他部位的原发癌灶. 正常黏膜组织取自距肿瘤边缘5 cm处. 根据2010年消化系肿瘤WHO分类标准[9], 由两位高年资病理医师重新阅片诊断. 腺瘤癌变组中, 男42例, 女18例; 年龄: 45-85岁, 平均62.9岁. 肿瘤直径: ≥5 cm者28例, <5 cm者32例; 发病部位: 结肠30例, 直肠30例; 肿瘤分化程度: 高分化腺癌26例, 中、低分化34例; 淋巴结转移26例, 无淋巴结转移34例. 按美国肿瘤研究联合会(AJCC)和国际癌症防治联合会(UICC)共同制定的2009年的TNM分期, Ⅰ期和Ⅱ期共42例, Ⅲ期和Ⅳ期共18例. 所有标本均经40 g/L甲酫固定, 常规脱水, 石蜡包埋, 3 μm厚度切片.
1.2.1 免疫组织化学染色: 兔抗人PI3Kp110α单克隆抗体浓缩液(HongKong, 批号ab71090)和小鼠抗人PI3Kp110β单克隆抗体浓缩液(HongKong, 批号ab55593)购自Abcam公司; 通用型二抗以及其他辅助试剂均购自北京中杉金桥公司; 将石蜡包埋组织制成3 μm切片, PI3Kp110α、PI3Kp110β一抗稀释度分别为1:150、1:200, 分别用已知阳性表达的脑组织、乳腺癌组织做阳性对照, 均用PBS代替一抗做空白对照, 免疫组织化学染色采用EnVision法, 染色步骤按说明书进行.
1.2.2 结果判断: p110α以上皮细胞胞浆内出现棕黄色颗粒为阳性标志, p110β以上皮细胞胞浆均质黄染为阳性标志. 在高倍镜下(×400)随机选取5个不同视野, 用Imageproplus 6.0病理图像分析软件分别测试每个视野下p110α、p110β蛋白阳性表达的平均吸光度, 以5个视野平均吸光度的平均值作为该例组织的测量值, 平均吸光度值越高该例组织中目的蛋白的表达水平越高.
统计学处理 所有实验数据采用SPSS16.0统计软件分析, 各组吸光度值以mean±SD表示. 不同病变各组均数比较用方差分析; p110α、p110β表达相关性用Pearson相关分析; p110α、p110β的表达与结直肠癌临床病理等因素的关系采用多元线性回归分析. 以P = 0.05为检验水准, P≤0.05为具有统计学意义.
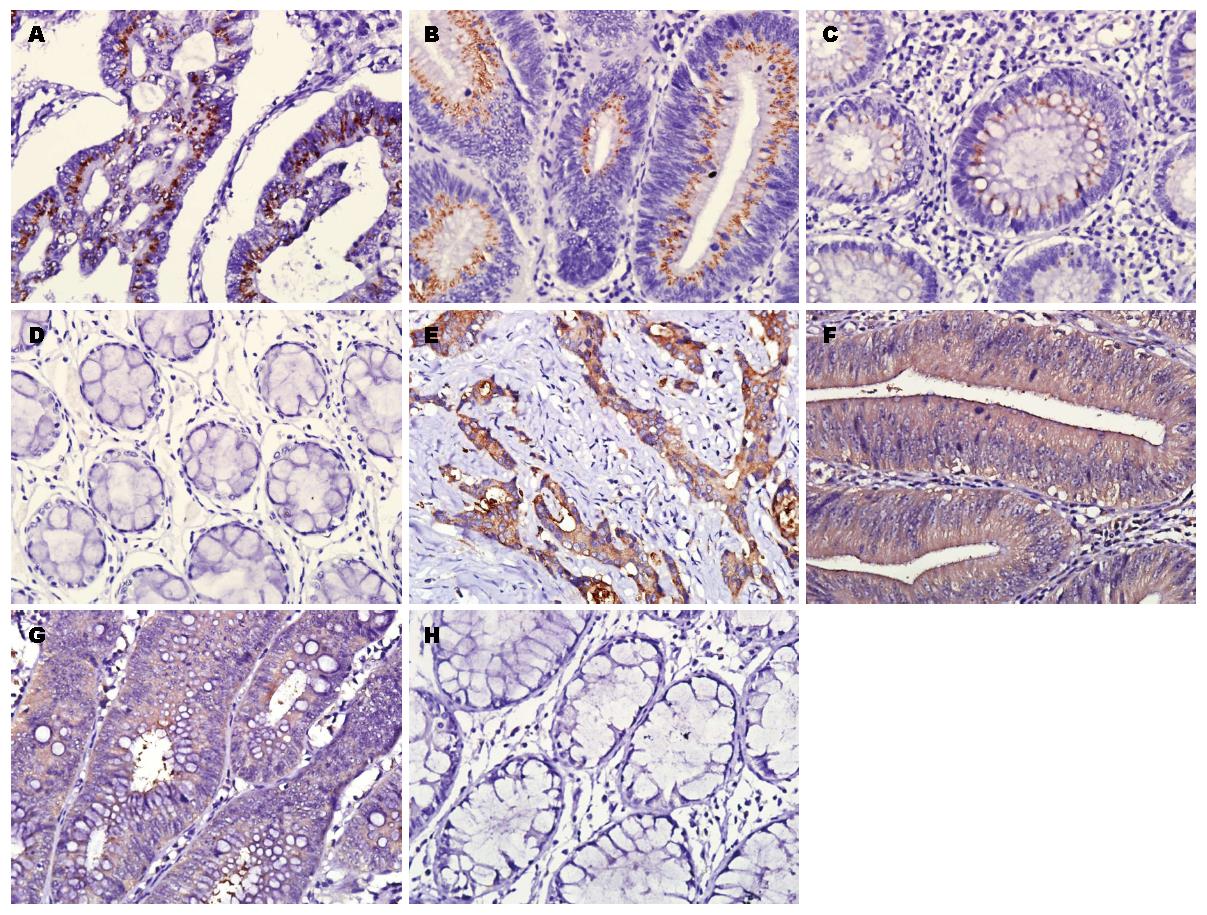
p110α、p110β的阳性表达部位均位于上皮细胞的胞浆内(图1). 结果显示, p110α在癌组织中的表达明显高于LGIN腺瘤组及正常组织(P<0.05), 而与HGIN腺瘤中的表达无差异(P>0.05); 在HGIN腺瘤中p110α的表达明显高于LGIN腺瘤、正常组织, 其差异有统计学意义(P<0.05); 而LGIN腺瘤中的表达与正常组织间无差异(P>0.05). p110β在癌组织、HGIN、LGIN、正常组织中的表达逐渐降低, 且各组间的差异均有统计学意义(P<0.05, 表1).
| 分组 | n | p110α | p110β |
| 正常组 | 30 | 30.74±9.96 | 29.50±7.34 |
| LGIN组 | 46 | 37.80±14.47 | 50.99±23.52 |
| HGIN组 | 32 | 58.64±15.37 | 58.12±11.83 |
| 腺癌组 | 60 | 58.51±28.34 | 78.97±46.39 |
经多元线性回归分析, 癌组织组中p110α的表达与年龄、肿瘤直径、分化程度有相关性(P<0.05), 而与患者的性别、肿瘤的发病部位、TNM分期及淋巴结转移等因素无关(P>0.05, 表2); p110β的表达与肿瘤的分化程度、TNM分期等临床因素间具有相关性(P<0.05), 与患者的性别、年龄、肿瘤直径、发生部位及淋巴结转移等因素无关(P>0.05, 表2).
| 分组 | n | p110α | P值 | p110β | P值 |
| 性别 | 0.331 | 0.708 | |||
| 男 | 42 | 61.59±29.74 | 70.67±51.62 | ||
| 女 | 18 | 51.31±23.99 | 98.33±21.82 | ||
| 年龄(岁) | 0.002 | 0.666 | |||
| ≤50 | 6 | 102.17±31.0 | 53.22±20.69 | ||
| 50-60 | 14 | 62.81±28.35 | 82.75±74.69 | ||
| ≥60 | 40 | 50.45±21.35 | 81.50±35.03 | ||
| 肿瘤部位 | 0.821 | 0.650 | |||
| 结肠 | 30 | 54.26±28.42 | 82.78±59.43 | ||
| 直肠 | 30 | 62.75±28.089 | 75.15±28.58 | ||
| 肿瘤直径(cm) | 0.004 | 0.257 | |||
| <5 | 32 | 45.18±24.95 | 64.72±29.27 | ||
| ≥5 | 28 | 73.74±24.28 | 95.24±56.60 | ||
| 分化程度 | 0.038 | 0.044 | |||
| 低、中 | 34 | 62.23±29.72 | 105.86±44.36 | ||
| 高 | 26 | 53.64±26.19 | 43.79±14.51 | ||
| 分期 | 0.469 | 0.024 | |||
| I+II | 42 | 61.28±28.98 | 58.84±24.07 | ||
| III+IV | 18 | 52.03±26.42 | 125.92±52.31 | ||
| 淋巴结转移 | 0.118 | 0.428 | |||
| 无 | 34 | 62.19±29.29 | 50.99±19.70 | ||
| 有 | 26 | 53.69±26.84 | 115.56±45.93 |
结直肠癌在消化系肿瘤中发病率仅次于胃癌和食管癌, 位于第3位[10], 且发病率逐年增高, 发病年龄日趋年轻化. 结直肠腺瘤在大肠良性上皮性肿瘤中的发病率最高, 且伴有不同程度的上皮内瘤变, 其发病率随年龄增长逐年增高. 由于绝大部分结直肠癌由腺瘤演变而来, 寻找早期的分子学诊断标志物, 探寻腺瘤向腺癌演变的癌变机制, 从而做到结直肠癌的早发现、早诊断、早治疗, 已经成为提高结直肠癌患者5年生存率、减少复发的关键. PI3K/AKT细胞信号转导通路的异常参与肿瘤发生发展的进程, 且与细胞的增殖、分化、转移等密切相关[11-13], 而PI3Ks作为该通路的核心分子, 其催化亚基p110 4个亚单位中的2个亚型p110α、p110β在腺瘤癌变过程中的作用及其相关性尚不明确, 需要进一步研究.
PI3Kp110α是原癌基因PIK3CA编码的蛋白, 研究发现, 在多种恶性肿瘤中存在PIK3CA基因的突变以及其编码的蛋白p110α的过度表达, 尤其在大肠癌、神经胶质细胞瘤、胃癌中PIK3CA突变率较高[14,15]. p110α在调控细胞的增殖、分化、存活、侵袭、转移等方面发挥着重要作用[16,17]. Samuel等[18]认为, PIK3CA的突变可能发生在细胞即将获得侵袭能力时或在获得侵袭能力的同时. Weber等[19]通过shRNA(short hairpin RNA, 短发夹RNA)干扰多形性成胶质细胞瘤中PIK3CA表达发现, p110α的表达降低后细胞的增殖、迁移能力降低, 提示PIK3CA在细胞转变为癌的过程中可能起到重要作用. Miron等[20]通过对处于3种不同分期的乳腺癌中PIK3CA突变位点的研究发现, 3种乳腺癌组织中PIK3CA的突变频率并无明显差异, 从而推测PIK3CA的突变可能在肿瘤的起始过程发挥一定的作用. 本实验研究结果显示, p110α在结直肠癌组织中的表达明显高于正常黏膜组织、LGIN腺瘤, 提示在结直肠癌中存在PIK3CA基因的突变, 可能在腺瘤癌变过程中发挥作用. 而在结直肠癌组织中p110α的表达与HGIN腺瘤无明显差异, 提示p110α的突变可能发生在癌变的早期阶段, 可能是结直肠癌发生的始动因素之一. 在研究中发现, p110α的表达与患者的性别、肿瘤的发病部位、TNM分期及有无淋巴结转移等无相关性; 而肿瘤的分化程度越低、年龄越大、肿瘤直径越大, p110α的表达程度越高, 提示在年龄越大的人群中, 更容易发生PIK3CA的突变, p110α的高表达与大肠癌的恶性潜能相关.
PI3Kp110β是原癌基因PIK3CB编码的蛋白, 在细胞的增殖、周期调控和凋亡等活动中发挥着重要作用, 且与肿瘤的耐药密切相关[21-23]. 目前的研究证实p110β参与多种类型肿瘤的发生发展, 在前列腺癌、乳腺癌、子宫内膜癌、恶性胶质瘤[24-28]等恶性肿瘤中均存在p110β的高表达. Liu等[29]通过特异性靶向shRNA干扰p110β的表达后发现, p110β的表达降低后抑制了肿瘤细胞的增殖、促进了肿瘤细胞的凋亡. Wee等[30]通过shRNA干扰技术干扰PTEN缺失的癌细胞中的PIK3CB编码的蛋白的表达, 发现在p110β表达降低后PI3K/AKT信号通路失活, 且在体内和体外实验中均出现细胞生长抑制, 提示p110β在PTEN缺失肿瘤的进展过程中发挥重要作用. 目前对于p110β的研究已成为国内外研究的热点. 本实验研究结果显示, p110β在正常黏膜组织、LGIN腺瘤、HGIN腺瘤、癌组织中的表达呈逐渐增高趋势, 提示p110β可能在腺瘤向腺癌的演进过程的不同阶段均发挥重要作用. 研究同时发现, p110β的表达与患者的性别、年龄、肿瘤直径、发病部位及有无淋巴结转移等无相关性; TNM分期越高、肿瘤的分化程度越低, p110β的表达程度越高, 提示p110β与肿瘤的生物学特性密切相关.
目前关于PI3Ks在肿瘤发生发展中所起到的作用日趋受到关注, p110α、p110β在肿瘤发生中的作用也已经逐渐被认识, 但在同一组织中p110α、p110β的表达情况及其相关性尚不明确. 本研究在结直肠腺瘤癌变不同阶段中同步检测了p110α、p110β的表达并分析其相关性, 结果显示p110α与p110β在LGIN腺瘤中的表达呈正相关, 而在癌组织、HGIN腺瘤、正常组织中的表达无相关性. 我们推测在腺瘤-腺癌序列的起始阶段, 即在细胞开始出现异型增生时, p110α与p110β有协同促进细胞增殖及异型程度进展的作用, 而随着细胞异型程度的增加及癌变过程的进展, p110α与p110β分别在腺瘤向腺癌转化过程的不同阶段中发挥重要作用, 而两者在癌组织中的同时高表达促进了肿瘤细胞的去分化.
总之, 在结直肠癌变过程中存在p110α、p110β的高表达, 并均与肿瘤的分化程度呈正相关, 但其在腺瘤-腺癌序列中的表达情况不完全相同. p110α在HGIN腺瘤中表达显著异常, 而p110β在结直肠癌变过程中随病变的异型程度增加, 其表达逐渐升高. 因此, 我们认为, p110α的异常表达可能在腺瘤即将发生癌变时起作用, 而p110β的异常表达可能在结直肠腺瘤癌变的整个发生发展过程中发挥作用. 由此可见, PI3Kp110的不同亚单位在腺瘤向腺癌转化过程的不同阶段中分别发挥促癌变作用. 因此, p110α、p110β均可作为结直肠癌早期诊断的分子标志物, 联合检测p110α、p110β对于早期预测腺瘤癌变具有临床意义, 并且也为结直肠癌的分子靶向治疗提供了新的思路.
结直肠癌是最常见的消化系肿瘤之一, 在我国, 随着生活水平的提高和饮食习惯的改变, 发病率日趋升高. 探讨结直肠癌发生发展过程中的分子机制, 对于寻找分子靶向治疗的新的靶点尤为重要.
斯坎德尔·白克力, 教授, 新疆医科大学基础医学院生物化学教研室
p110α、p110β已证实在多种恶性肿瘤中高表达, 本实验选取经腺瘤癌变的腺癌组织, 删除经其他方式癌变的癌组织, 为保证均衡性仅选择管状腺瘤组织, 探索p110α、p110β在结直肠腺瘤癌变过程中表达的相关性.
近年来的研究显示, 在多种恶性肿瘤中存在PIK3CA基因的突变以及其编码的蛋白p110α的过度表达, 且p110α在调控细胞的增殖、分化、存活、侵袭、转移等方面发挥着重要作用. 在前列腺癌、乳腺癌、子宫内膜癌、恶性胶质瘤等恶性肿瘤中均存在p110β的高表达, 且p110β是在细胞的周期调控、增殖和凋亡等活动中发挥着重要作用.
为深入研究结直肠腺瘤-腺癌变机制, 本文特选取经腺瘤癌变的癌组织, 在同一例组织中同时检测了p110α和p110β的表达情况, 分析两者在腺瘤-腺癌序列中的表达特点及相关性以及与临床病理因素的关系.
本研究采用免疫组织化学法检测p110α、p110β在结直肠腺瘤癌变不同阶段中的表达情况, 有助于阐释p110α和p110β在腺瘤-腺癌序列中所起到的作用及其两者在腺瘤癌变过程中表达的相关性, 为寻找分子靶向治疗的新靶点提供了参考依据.
本文在寻找结直肠癌早期诊断的分子标志物研究中具有重要的意义, 符合伦理学要求, 也有一定的新颖性.
编辑: 李军亮 电编: 闫晋利
| 1. | Funaki M, Katagiri H, Inukai K, Kikuchi M, Asano T. Structure and function of phosphatidylinositol-3, 4 kinase. Cell Signal. 2000;12:135-142. [DOI] |
| 2. | Liu P, Cheng H, Roberts TM, Zhao JJ. Targeting the phosphoinositide 3-kinase pathway in cancer. Nat Rev Drug Discov. 2009;8:627-644. [PubMed] [DOI] |
| 3. | Carnero A. The PKB/AKT pathway in cancer. Curr Pharm Des. 2010;34-44. [PubMed] [DOI] |
| 4. | Kolasa IK, Rembiszewska A, Felisiak A, Ziolkowska-Seta I, Murawska M, Moes J, Timorek A, Dansonka-Mieszkowska A, Kupryjanczyk J. PIK3CA amplification associates with resistance to chemotherapy in ovarian cancer patients. Cancer Biol Ther. 2009;8:21-26. [PubMed] [DOI] |
| 5. | Samuels Y, Ericson K. Oncogenic PI3K and its role in cancer. Curr Opin Oncol. 2006;18:77-82. [PubMed] [DOI] |
| 6. | Armaghany T, Wilson JD, Chu Q, Mills G. Genetic alterations in colorectal cancer. Gastrointest Cancer Res. 2012;5:19-27. [PubMed] |
| 7. | Catasus L, Gallardo A, Cuatrecasas M, Prat J. PIK3CA mutations in the kinase domain (exon 20) of uterine endometrial adenocarcinomas are associated with adverse prognostic parameters. Mod Pathol. 2008;21:131-139. [PubMed] |
| 8. | Abdou AG, Aiad H, Asaad N, Abd El-Wahed M, Serag El-Dien M. Immunohistochemical evaluation of vascular endothelial growth factor (VEGF) in colorectal carcinoma. J Egypt Natl Canc Inst. 2006;18:311-322. [PubMed] |
| 9. | 周 晓军, 樊 祥山. 解读2010年消化系统肿瘤WHO分类(Ⅰ). 临床与实验病理学杂志. 2011;27:341-346. |
| 10. | Kerr D. Clinical development of gene therapy for colorectal cancer. Nat Rev Cancer. 2003;3:615-622. [PubMed] [DOI] |
| 11. | Manning BD, Cantley LC. AKT/PKB signaling: navigating downstream. Cell. 2007;129:1261-1274. [PubMed] [DOI] |
| 12. | Yuan TL, Cantley LC. PI3K pathway alterations in cancer: variations on a theme. Oncogene. 2008;27:5497-5510. [PubMed] [DOI] |
| 14. | Karakas B, Bachman KE, Park BH. Mutation of the PIK3CA oncogene in human cancers. Br J Cancer. 2006;94:455-459. [PubMed] [DOI] |
| 15. | Li VS, Wong CW, Chan TL, Chan AS, Zhao W, Chu KM, So S, Chen X, Yuen ST, Leung SY. Mutations of PIK3CA in gastric adenocarcinoma. BMC Cancer. 2005;5:29. [PubMed] [DOI] |
| 16. | Zhou XK, Tang SS, Yi G, Hou M, Chen JH, Yang B, Liu JF, He ZM. RNAi knockdown of PIK3CA preferentially inhibits invasion of mutant PIK3CA cells. World J Gastroenterol. 2011;17:3700-3708. [PubMed] |
| 17. | Liu JF, Zhou XK, Chen JH, Yi G, Chen HG, Ba MC, Lin SQ, Qi YC. Up-regulation of PIK3CA promotes metastasis in gastric carcinoma. World J Gastroenterol. 2010;16:4986-4991. [PubMed] |
| 18. | Samuels Y, Wang Z, Bardelli A, Silliman N, Ptak J, Szabo S, Yan H, Gazdar A, Powell SM, Riggins GJ. High frequency of mutations of the PIK3CA gene in human cancers. Science. 2004;304:554. [PubMed] [DOI] |
| 19. | Weber GL, Parat MO, Binder ZA, Gallia GL, Riggins GJ. Abrogation of PIK3CA or PIK3R1 reduces proliferation, migration, and invasion in glioblastoma multiforme cells. Oncotarget. 2011;2:833-849. [PubMed] |
| 20. | Miron A, Varadi M, Carrasco D, Li H, Luongo L, Kim HJ, Park SY, Cho EY, Lewis G, Kehoe S. PIK3CA mutations in in situ and invasive breast carcinomas. Cancer Res. 2010;70:5674-5678. [PubMed] [DOI] |
| 21. | Jia S, Liu Z, Zhang S, Liu P, Zhang L, Lee SH, Zhang J, Signoretti S, Loda M, Roberts TM. Essential roles of PI(3)K-p110beta in cell growth, metabolism and tumorigenesis. Nature. 2008;454:776-779. [PubMed] |
| 22. | Ciraolo E, Iezzi M, Marone R, Marengo S, Curcio C, Costa C, Azzolino O, Gonella C, Rubinetto C, Wu H. Phosphoinositide 3-kinase p110beta activity: key role in metabolism and mammary gland cancer but not development. Sci Signal. 2008;1:ra3. [PubMed] [DOI] |
| 23. | Dbouk HA, Backer JM. A beta version of life: p110β takes center stage. Oncotarget. 2010;1:729-733. [PubMed] |
| 24. | Zhu Q, Youn H, Tang J, Tawfik O, Dennis K, Terranova PF, Du J, Raynal P, Thrasher JB, Li B. Phosphoinositide 3-OH kinase p85alpha and p110beta are essential for androgen receptor transactivation and tumor progression in prostate cancers. Oncogene. 2008;27:4569-4579. [PubMed] [DOI] |
| 25. | Yip SC, El-Sibai M, Hill KM, Wu H, Fu Z, Condeelis JS, Backer JM. Over-expression of the p110beta but not p110alpha isoform of PI 3-kinase inhibits motility in breast cancer cells. Cell Motil Cytoskeleton. 2004;59:180-188. [PubMed] [DOI] |
| 26. | Crowder RJ, Phommaly C, Tao Y, Hoog J, Luo J, Perou CM, Parker JS, Miller MA, Huntsman DG, Lin L. PIK3CA and PIK3CB inhibition produce synthetic lethality when combined with estrogen deprivation in estrogen receptor-positive breast cancer. Cancer Res. 2009;69:3955-3962. [PubMed] [DOI] |
| 27. | An HJ, Cho NH, Yang HS, Kwak KB, Kim NK, Oh DY, Lee SW, Kim HO, Koh JJ. Targeted RNA interference of phosphatidylinositol 3-kinase p110-beta induces apoptosis and proliferation arrest in endometrial carcinoma cells. J Pathol. 2007;212:161-169. [PubMed] [DOI] |
| 28. | Pu P, Kang C, Zhang Z, Liu X, Jiang H. Downregulation of PIK3CB by siRNA suppresses malignant glioma cell growth in vitro and in vivo. Technol Cancer Res Treat. 2006;5:271-280. [PubMed] |
| 29. | Liu W, Wang G, Cao X, Luo X, Li Z, Deng Y, Li X, Wang S, Liu M, Hu J. Down-regulation of p110β expression increases chemosensitivity of colon cancer cell lines to oxaliplatin. J Huazhong Univ Sci Technolog Med Sci. 2012;32:280-286. [PubMed] [DOI] |
| 30. | Wee S, Wiederschain D, Maira SM, Loo A, Miller C, deBeaumont R, Stegmeier F, Yao YM, Lengauer C. PTEN-deficient cancers depend on PIK3CB. Proc Natl Acad Sci U S A. 2008;105:13057-13062. [PubMed] [DOI] |