修回日期: 2013-11-21
接受日期: 2013-02-20
在线出版日期: 2013-02-28
目的: 探讨肿瘤坏死因子α(tumor necrosis factor α, TNFα)对人肾小球系膜细胞(human mesangial cells, HMCs)IP3R1蛋白和mRNA表达的影响及PKC和肿瘤坏死因子受体(tumor necrosis factor receptor, TNFR)在此信号通路中的作用, 以期为肝肾综合征(hepatorenal syndrome, HRS)肾小球滤过率下降的发生机制和防治思路提供理论依据.
方法: 用实时定量PCR和免疫印记法检测IP3R1 mRNA和蛋白表达的情况, 并分别用PMA耗竭内源性蛋白激酶C(endogenous protein kinase C, PKC), PKCα特异性抑制剂Safingol和PKCδ特异性抑制剂Rottlerin及HA-DN-PKCα质粒转染干预上述诱导实验. 同时, 用免疫印记法检测TNFα对PKCα和p-PKCα的表达的影响. 此外, 免疫印记法检测TNFR对PKCα的活化及IP3R1蛋白表达的影响.
结果: TNFα作用HMCs后, IP3R1蛋白和mRNA表达均明显增加. PMA、PKCα抑制剂Safingol, HA-DN-PKCα质粒转染均能明显阻断TNFα诱导的IP3R1蛋白的上调, 而PKCδ抑制剂Rottlerin无明显阻断作用. TNFα刺激HMCs, 各不同时间组总PKCα蛋白表达无明显差异, 而TNFα刺激8 h p-PKCα蛋白表达明显增加. TNFR1抗体+TNFα组和TNFR2抗体+TNFα组, IP3R1蛋白表达均有明显的不同程度的下降. TNFR1抗体+TNFα组p-PKCα蛋白表达明显下降, 而TNFR2抗体+TNFα组, p-PKCα蛋白表达无明显变化.
结论: TNFα能上调HMCs中IP3R1蛋白及IP3R1 mRNA的表达. 活化的PKCα可能在TNFα上调IP3R1的表达中起重要作用. TNFα可能通过TNFR1/PKCα途径及TNFR2途径上调IP3R1的表达.
引文著录: 王育蓉, 章欢, 孙辉, 李翠红, 刘沛. TNFα通过TNFR1/PKCα和TNFR2信号通路诱导人肾小球系膜细胞IP3R1的表达. 世界华人消化杂志 2013; 21(6): 521-526
Revised: November 21, 2013
Accepted: February 20, 2013
Published online: February 28, 2013
AIM: To investigate the role of PKC and TNFR in TNFα-induced expression of IP3R1 in human mesangial cells (HMCs).
METHODS: Quantitative real-time polymerase chain reaction and immunoblot assay were used to examine the effect of TNFα treatment on IP3R1 mRNA and protein expression. Depletion of PKC with PMA, treatment with PKC kinase inhibitors, and overexpression of dominant negative mutant of PKCα were used to examine the role of PKC in TNFα-induced expression of IP3R1 in HMCs. The expression of total PKCα and p-PKCα was assayed by Western blot. The contribution of TNFR1 and TNFR2 to PKCα activation and TNFα-induced IP3R1 expression was also detected by Western blot.
RESULTS: Treatment with TNFα increased IP3R1 mRNA and protein expression in HMCs, and this effect could be blocked by prolonged incubation with PMA, Safingol treatment and transfection with domain negative PKCα construct. TNFα could promote PKCα autophosphorylation. Both anti-TNFR1 and TNFR2 antibodies attenuated TNFα-induced IP3R1 expression, while only anti-TNFR1 antibody attenuated TNFα-induced PKCα activity.
CONCLUSION: TNFα increases the expression of IP3R1 through the TNFR1/PKCα and TNFR2 signaling pathways in HMCs.
- Citation: Wang YR, Zhang H, Sun H, Li CH, Liu P. TNFα induces IP3R1 expression via TNFR1/PKCα and TNFR2 signaling pathways in human mesangial cells. Shijie Huaren Xiaohua Zazhi 2013; 21(6): 521-526
- URL: https://www.wjgnet.com/1009-3079/full/v21/i6/521.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i6.521
肝肾综合征(hepatorenal syndrome, HRS)是重症肝病的严重并发症, 病死率高达70%. 目前认为肾小球滤过率(glomerular filtration rate, GFR)下降是HRS的主要发病机制[1]. 1,4,5-三磷酸肌醇受体(IP3R)是胞内钙贮库, IP3R与IP3结合后发生构象改变, 内质网中的储备钙被释放到细胞质中, 胞质游离Ca2+浓度升高引起细胞收缩[2]. 肾小球系膜细胞(glomerular mesangial cells, GMCs)收缩可导致GFR下降[3]. 国内外研究表明高表达的Ⅰ型1,4,5-三磷酸肌醇受体(IP3R1)介导Ca2+失衡、细胞收缩敏感性增加, 与许多疾病的进展如房颤, 哮喘、阿尔茨海默及帕金森氏病等关系密切[4-6]. TNFα与重型肝炎发生发展密切相关[7]. 体外实验表明TNFα可上调IP3R1表达[6,8,9]: TNFα可诱导神经元细胞IP3R1表达; 在肝硬化大鼠及暴发性肝衰竭小鼠模型中, 肾小球系膜细胞(glomerular mesangial cells, GMCs)IP3R1蛋白表达明显增加.
综上所述, 我们认为TNFα通过上调IP3R1表达, 为胞内IP3提供足够的IP3R, 促进GMCs内Ca2+释放, 引起GMCs收缩, 导致GFR下降, 这可能是HRS时肾脏对缩血管物质发生高敏的分子基础. 为深入探讨IP3R1表达的分子机制, 我们以人肾小球系膜细胞(human mesangial cells, HMCs)为研究对象, 探讨TNFα对IP3R1表达的影响, 并进一步研究PKC及TNFR在此信号通路中的作用, 希望能在揭示肝肾综合征GFP下降的分子机制方面有所突破, 并为干预肝肾综合征发生发展的新策略提供理论基础及作用靶点.
HMCs和人肾小球系膜细胞专用培养基(mesangial cell medium, MCM)(4201): sccience cell公司; TNFα、兔抗人TNFR1、兔抗人TNFR2抗体: R&D公司; 兔抗人Ⅰ型IP3R抗体: Chemicon International公司; Rottlerin、Safingol: Calbiochen公司; TRIzol: Invitrogen公司; 引物合成, 逆转录试剂盒ExScriptTM RT Reagent Kit、PCR试剂盒SYBR® premix EX TaqTM: Takara公司; 人野生型PKCα(pHACE-WT-PKCα)质粒, 活性失活PKCα(pHACE-DN-PKCα)质粒及pCDNA3.0质粒由韩国大学博士惠赠(经大连宝生物工程有限公司测序分析).
1.2.1 细胞培养及给药: 应用MCM将原代HCMs细胞在37℃、5%CO2恒温培养箱中进行培养, 适时换液, 消化传代, 取4-8代细胞做后继实验. 待细胞生长到约80%-90%融合时, 吸弃旧培养基, 换成无血清(free serum medium, FSM)MCM同步饥饿24 h后继续加药处理.
不同细胞模型分组: (1)分为不同时间(0、2、4、8、24 h)组, TNFα(100 ng/mL)刺激HMCs, 实时定量PCR和免疫印迹检测IP3R1 mRNA和蛋白表达; (2)多种信号抑制剂预处理HMCs分组: TNFα处理0 h组(T0h组); TNFα处理24 h组(T24h组); Rottlerin/Safingol单独处理组; TNFα+抑制剂组. PKCδ特异性抑制剂Rottlerin(5 μmol/L), PKCα特异性抑制剂Safingol(5 μmol/L)预处理血清饥饿的HMCs 1 h后, 再予TNFα刺激24 h; (3)质粒转染分组: TNFα处理0 h组(T0h组); 空载体组(pCDNA3.0)+TNFα; DN-PKCα+TNFα; WT-PKCα+TNFα每组设3个孔; (4)正常对照组(T0h组); TNFα刺激8 h或24 h组(T8h, T24h); TNFR1抗体+TNFα组(TR1+T组); TNFR2抗体+TNFα组(TR2+T组).
1.2.2 实时定量PCR: 细胞总RNA提取, 反转录为cDNA. 采用SYBR GreenⅠ荧光染料嵌合法, 分别制作目的基因(IP3R1)和管家基因(GAPDH)的标准曲线. 检测各实验组中IP3R1目的基因的相对表达量. 引物: IP3R1-F: 5'-ACAGGGTTTCGCCATGTTGAC-3'; IP3R1-R: 5'-AGGCTCAGTGGCTCATGCCTA-3'; GAPDH-F: 5'-GCACCGTCAAGGCTGAGAAC-3'; GAPDH-R: 5'-TGGTGAAGACGCCAGTGGA-3'. IP3R1/GAPDH mRNA的相对表达量 = IP3R1基因拷贝数/GAPDH基因拷贝数, 校正结果以T0h为1, 其余组与之比较.
1.2.3 Western blot: 提取细胞总蛋白, 经SDS-PAGE电泳后, 电转移至PVDF膜后加一抗孵育过夜; 加二抗室温孵育2 h; TBST洗膜3次, ECL发光法检测. 以分子量45 kDa的β-actin作为内参, 应用数码凝胶成像软件分析. 目的蛋白含量 = 目的蛋白灰度值/同一样本β-actin灰度值.
1.2.4 质粒瞬时转染: 质粒转化(转化大肠杆菌DH5α感受态菌)、扩增、氨苄青霉素筛选、小提质粒后酶切鉴定、测序证明(TAKARA公司完成)相应质粒为野生型或显性负突变体进一步中提质粒, -20 ℃冻存备用. 采用脂质体瞬时转染, 制备转染试剂、转染试剂/空载体、转染试剂/重组质粒转染复合物. 转染复合物加到各个培养瓶中并轻轻摇动. 每组重复3次. 转染操作按说明书进行. 转染后培养48 h, 分析结果.
统计学处理 实验数据以mean±SD表示, 计量资料各组间的比较采用方差分析, 所有数据均在SPSS15.0软件分析处理, P<0.05被认为差异有统计学意义.
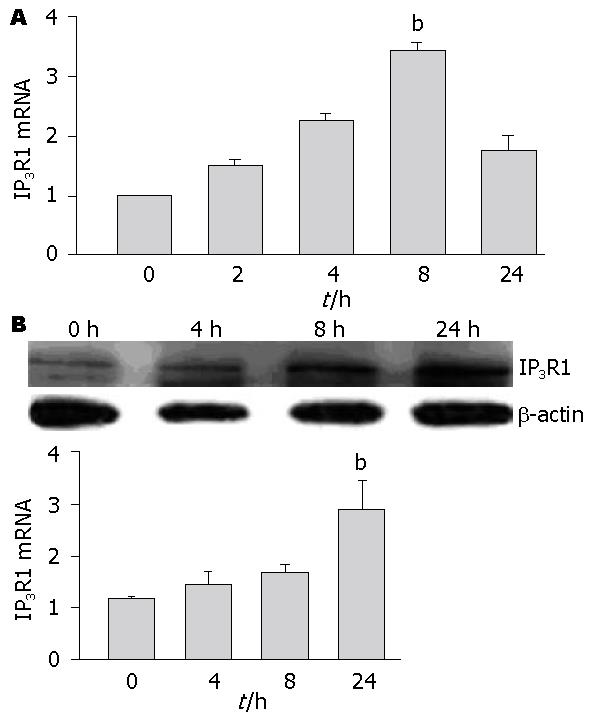
与对照组相比, TNFα处理后2 h到8 h IP3R1 mRNA表达逐渐增加, 于8 h达高峰(P<0.01, 图1A); IP3R1蛋白表达于TNFα刺激4 h开始升高, 至24 h IP3R1蛋白表达增加达高峰(P<0.01, 图1B).
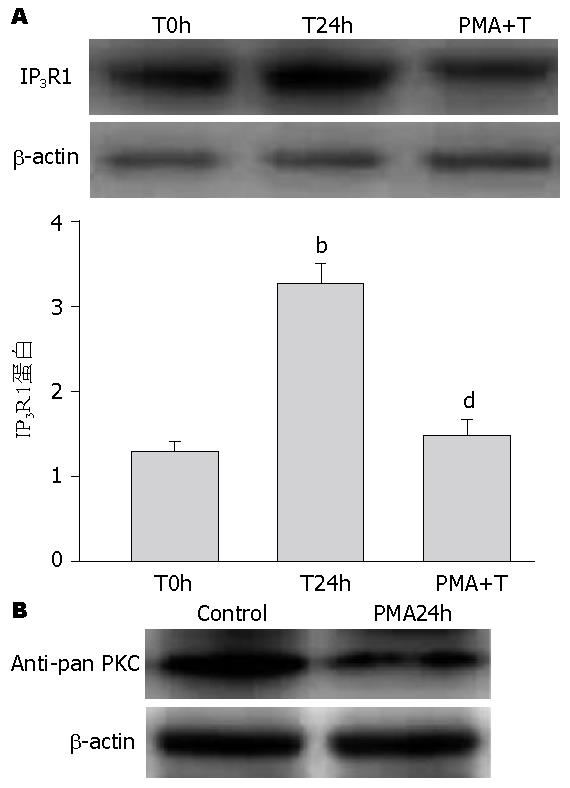
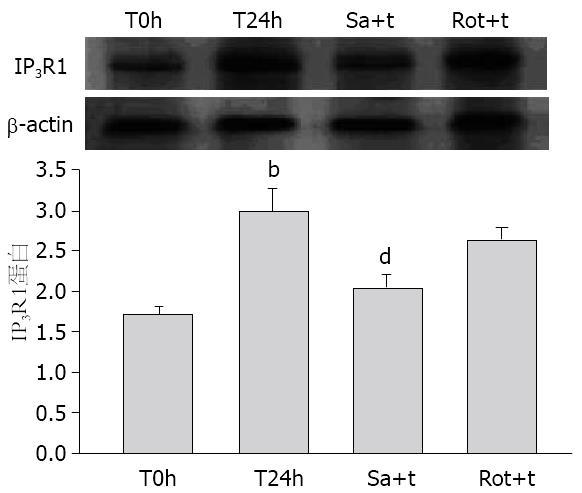
PMA预处理耗竭内源性PKC(传统型PKC、cPKC和新型PKC、nPKC), 再予TNFα刺激, IP3R1蛋白表达明显下降(P<0.01, 图2A). PMA刺激HMCs 24 h后, 总PKC的表达与对照组相比明显下降(图2B), 证实了PMA 24 h孵育对内源性PKC的耗竭作用. 说明cPKC和/或nPKC可能参与人系膜细胞中IP3R1蛋白的表达. 为进一步探究PKC亚型在IP3R1蛋白表达中的作用, PKCα和PKCδ的选择性抑制剂Safingol和Rottlerin预处理HMCs 1 h后, 再予TNFα刺激, Sa+T组IP3R1蛋白表达明显下降(P<0.01); 而rot+T组IP3R1蛋白表达无明显变化(P>0.05, 图3), 提示PKCα可能参与人系膜细胞中TNFα上调IP3R1的表达.
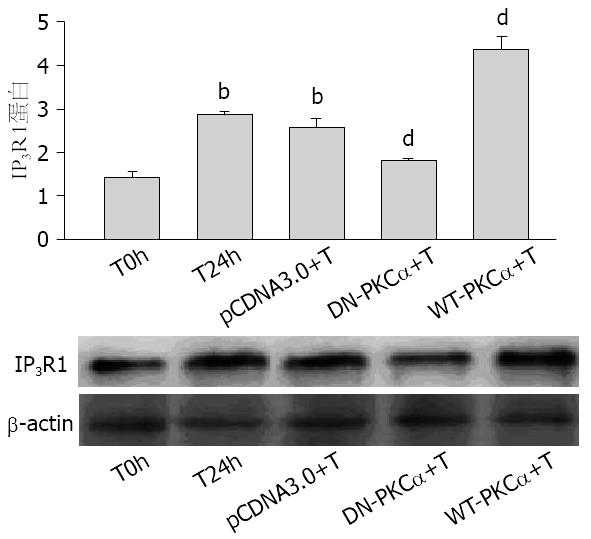
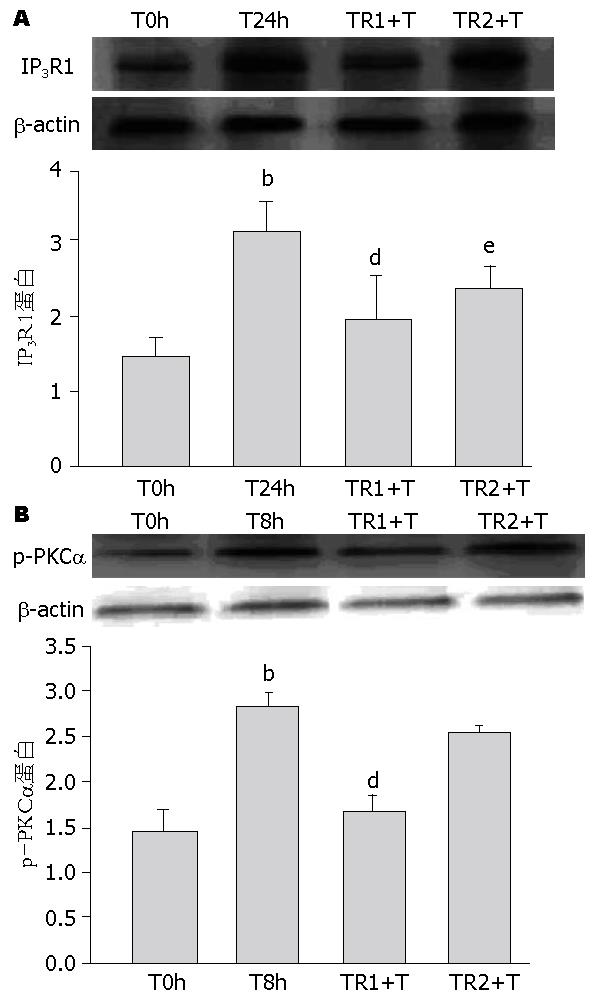
与T24h组比较, pHACE-WT-PKCα+TNFα组IP3R1蛋白表达明显增加(P<0.01), 而pHACE-DN-PKCα+TNFα组IP3R1蛋白表达明显降低(P<0.01); 与T0h比较, T24h组和pCDNA3.0组+TNFα组IP3R1蛋白表达均明显增加, 而此两组间比较无明显差异(P>0.05), 说明质粒的转染并不影响细胞的活性(图4).
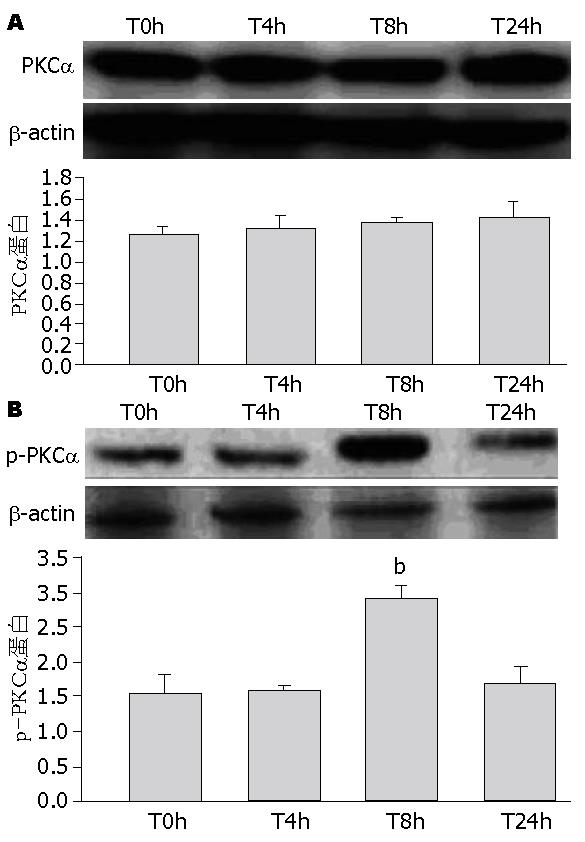
TNFα处理各时间组PKCα蛋白表达无明显差异(P>0.05, 图5A). TNFα刺激HMCs 8 h, p-PKCα蛋白表达明显增加(P<0.01, 图5B).
IP3R是对第二信使IP3应答的一种普遍存在的胞内Ca2+释放通道, 研究表明IP3R数目和结构的变化会影响细胞内Ca2+信号的幅度和频率, 直接影响细胞收缩, 并与多种疾病发生发展密切相关, 如转化生长因子β下调IP3R1表达, 降低GMCs和肾脏平滑肌收缩的敏感性, 与糖尿病肾病发生发展密切相关[10]; 肝硬化动物模型中肾小球系膜细胞和入球小动脉平滑肌中IP3R1表达增加可能与肾脏低灌注有关[8,9]. 肾脏IP3R1主要存在于肾小球系膜细胞、血管平滑肌细胞[11].
系膜细胞在肾脏疾病中不仅是主要的靶细胞, 也是病变过程的主要参与者. 重型肝炎患者血清中TNFα明显增加[7]. 本实验中, 我们首先应用实时定量PCR方法和免疫印迹法, 从基因和蛋白水平验证了TNFα可上调HMCs的IP3R1表达, 这与国内动物实验及国外学者在神经元细胞中研究结果是一致的[6]. IP3R1 mRNA在时相上首先出现表达升高, 是IP3R1蛋白表达增加的始动因素.
蛋白激酶C(protein kinase C, PKC)是一类钙和磷脂依赖性磷酸化激酶, 广泛分布于各组织和器官中. 文献表明系膜细胞的舒缩功能也与PKC激活有密切关系, 激活的PKC可通过调节系膜细胞骨架分布来影响肾小球滤过功能[11]. PKC家族至少包括12种亚型[12], 其中PKCα约占肾脏PKC的1/3, 对维持肾脏生理功能有重要的作用[11]. 本实验中, 我们利用PMA耗竭内源性敏感的PKC这一特性[13], 及选择性化学抑制剂的方法初步确定了PKCα参与TNFα上调IP3R1的表达. 通过瞬时转染pHACE-DN-PKCα质粒, 使PKCα活性失活, 排除化学抑制剂潜在影响其他蛋白的因素, IP3R1的表达明显下降, 进一步证实了活化的PKCα在上调IP3R1表达中的重要作用. 继续的实验结果: TNFα刺激HMCs 8 h, p-PKCα表达明显增加, 表明TNFα以时间依赖性活化PKCα, PKCα蛋白Thr638位点的磷酸化代表PKCα的活化[14], 但PKCα总蛋白无明显变化, 说明TNFα增加了PKCα从非磷酸化转变成磷酸化的形式, 活化的PKCα参与了下游IP3R1的表达.
TNFα主要通过DAG和非DAG依赖的途径如活化胆绿素还原酶、活性氧、酪氨酸等途径活化PKCα[15-17]. 而在HMCs中, TNFα是通过何种途径活化PKCα进而促进IP3R1的表达? TNFα作为一种多效性细胞因子, 是通过与TNFR结合才得以实现的. TNFα两种受体TNFR1和TNFR2均存在于多种组织细胞和免疫细胞表面, 他们胞外结构区有30%的同源性, 但胞内结构区差别很大, 提示他们在细胞内信号传递上有差异, 并可诱发不同的生物学作用[18]. 本实验中, 我们利用特异性抗TNFR的单克隆抗体封闭细胞表面TNFα受体, 研究TNFR的作用. 有趣的是, 我们发现两组单克隆抗体封闭组, IP3R1表达都不同程度地明显下降, 抗TNFR1组下调IP3R1蛋白达53%, 而抗TNFR2组下调IP3R1蛋白42%, 此结果表明了TNFR1和TNFR2都参与了IP3R1表达的上调, 那么, TNFR与PKCα活化的关系如何? 我们发现抗TNFR1单克隆抗体封闭组, p-PKCα显著减少, 而抗TNFR2单克隆抗体封闭组p-PKCα表达无明显变化, 说明TNFR1介导了PKCα的活化, 文献表明: TNFα可通过TNFR1胞内特定部位, 即接头蛋白FAN, 活化PC-PLC, PC-PLC水解细胞膜磷脂酰胆碱生成胆碱和DAG进而活化PKC[19].
综上所述, 我们认为人系膜细胞中, TNFα至少可通过TNFR1/PKCα途径及非依赖PKCα的TNFR2希信号传导途径上调IP3R1的表达, 高表达的IP3R1为胞内IP3提供足够的IP3R, 促进胞内Ca2+释放, 增加肾小球系膜细胞收缩, 导致GFR下降, 进而促进HRS的发生与发展. 但在TNFα上调IP3R1表达的信号事件中, TNFR1与TNFR2的具体作用机制, 是独立作用或存在相互作用, 或者与其他信号分子相关联等问题目前尚不清楚, 仍有待于进一步实验研究.
肝肾综合征(HRS)发生时肾脏血流量明显减少, 其主要原因是肾脏血管收缩, 具体机制不十分清楚. 肾小球系膜细胞内有丰富的IP3R1, IP3与IP3R1结合, 促进细胞内储备Ca2+释放, 引起肾血流减少. TNFα是引起重症肝炎发生的重要细胞因子, 那么TNFα能否上调人肾小球系膜细胞IP3R1表达? 在此信号转导事件中, 蛋白激酶C及肿瘤坏死因子受体的作用如何? 为解决这一问题, 本文研究了TNFα对人肾小球系膜细胞IP3R1表达的影响并深入研究TNFα上调IP3R1表达的信号转导机制.
黄颖秋, 教授, 本溪钢铁(集团)总医院消化内科
肝肾综合征时TNFα浓度升高, 许多文献报道TNFα可通过多种机制参与病理状态时的血管收缩. 文献报道, 动物模型及在神经元细胞中, TNFα可上调IP3R1的表达.
目前对肝肾综合征时肾血管收缩机制的研究主要集中在多种神经体液因素对血流动力学的影响方面, 而对其分子水平发病机制及胞内信号转导机制还知之甚少. 在人细膜细胞中, TNFα对IP3R1表达的影响及相应的信号转导机制国内外还没有相关报道.
本文发现TNFα明显上调IP3R1蛋白及mRNA表达, TNFα可通过TNFR1/PKCα途径及非依赖PKCα的TNFR2信号转导途径上调IP3R1的表达, 为进一步深入研究肾脏血管收缩机制提供了帮助.
肝肾综合征: 又称功能性肾功能衰竭, 是指严重肝脏疾病患者体内代谢产物的损害, 血液动力学的改变及血流量的异常, 导致肾脏血流量的减少和滤过率降低所引起, 而其肾脏并无解剖和组织学方面的病变. 临床表现为进行性少尿、无尿、氮质血症、低钠血症等症候群.
本文立题新颖, 实验方法较先进, 实验依据充分, 实验结果能客观证实研究结论, 学术价值较好. 研究结果对于探讨肝肾综合征的发病机制有一定的理论价值.
编辑: 田滢 电编: 闫晋利
| 1. | Lata J. Hepatorenal syndrome. World J Gastroenterol. 2012;18:4978-4984. [PubMed] [DOI] |
| 2. | Taylor CW, da Fonseca PC, Morris EP. IP(3) receptors: the search for structure. Trends Biochem Sci. 2004;29:210-219. [PubMed] [DOI] |
| 3. | Yao J, Kitamura M, Oite T. [Characteristics of glomerular mesangial cells]. Nihon Jinzo Gakkai Shi. 2008;50:554-560. [PubMed] |
| 4. | Brightling C, Berry M, Amrani Y. Targeting TNF-alpha: a novel therapeutic approach for asthma. J Allergy Clin Immunol. 2008;121:5-10; quiz 11-12. [PubMed] [DOI] |
| 5. | Liang X, Xie H, Zhu PH, Hu J, Zhao Q, Wang CS, Yang C. Enhanced activity of inositol-1,4,5-trisphosphate receptors in atrial myocytes of atrial fibrillation patients. Cardiology. 2009;114:180-191. [PubMed] [DOI] |
| 6. | Park KM, Yule DI, Bowers WJ. Impaired TNF-alpha control of IP3R-mediated Ca2+ release in Alzheimer's disease mouse neurons. Cell Signal. 2010;22:519-526. [PubMed] [DOI] |
| 7. | Lu JW, Wang H, Yan-Li J, Zhang C, Ning H, Li XY, Zhang H, Duan ZH, Zhao L, Wei W. Differential effects of pyrrolidine dithiocarbamate on TNF-alpha-mediated liver injury in two different models of fulminant hepatitis. J Hepatol. 2008;48:442-452. [PubMed] [DOI] |
| 8. | Wen Y, Cui W, Liu P. Type I inositol 1, 4, 5-triphosphate receptors increase in kidney of mice with fulminant hepatic failure. World J Gastroenterol. 2007;13:2344-2348. [PubMed] |
| 10. | Sharma K, Deelman L, Madesh M, Kurz B, Ciccone E, Siva S, Hu T, Zhu Y, Wang L, Henning R. Involvement of transforming growth factor-beta in regulation of calcium transients in diabetic vascular smooth muscle cells. Am J Physiol Renal Physiol. 2003;285:F1258-F1270. [PubMed] |
| 11. | Tuttle KR, Anderberg RJ, Cooney SK, Meek RL. Oxidative stress mediates protein kinase C activation and advanced glycation end product formation in a mesangial cell model of diabetes and high protein diet. Am J Nephrol. 2009;29:171-180. [PubMed] [DOI] |
| 12. | Zeng L, Webster SV, Newton PM. The biology of protein kinase C. Adv Exp Med Biol. 2012;740:639-661. [PubMed] [DOI] |
| 13. | Govekar RB, Kawle PD, Advani SH, Zingde SM. Reduced PKC α Activity Induces Senescent Phenotype in Erythrocytes. Anemia. 2012;2012:168050. [PubMed] |
| 14. | Kim JM, Noh EM, Kwon KB, Kim JS, You YO, Hwang JK, Hwang BM, Kim BS, Lee SH, Lee SJ. Curcumin suppresses the TPA-induced invasion through inhibition of PKCα-dependent MMP-expression in MCF-7 human breast cancer cells. Phytomedicine. 2012;19:1085-1092. [PubMed] [DOI] |
| 15. | Pal D, Outram SP, Basu A. Novel regulation of protein kinase C-η. Biochem Biophys Res Commun. 2012;425:836-841. [PubMed] [DOI] |
| 16. | Zhang Z, Cui W, Li G, Yuan S, Xu D, Hoi MP, Lin Z, Dou J, Han Y, Lee SM. Baicalein protects against 6-OHDA-induced neurotoxicity through activation of Keap1/Nrf2/HO-1 and involving PKCα and PI3K/AKT signaling pathways. J Agric Food Chem. 2012;60:8171-8182. [PubMed] [DOI] |
| 17. | Miralem T, Lerner-Marmarosh N, Gibbs PE, Tudor C, Hagen FK, Maines MD. The human biliverdin reductase-based peptide fragments and biliverdin regulate protein kinase Cδ activity: the peptides are inhibitors or substrate for the protein kinase C. J Biol Chem. 2012;287:24698-24712. [PubMed] [DOI] |
| 18. | Cabal-Hierro L, Lazo PS. Signal transduction by tumor necrosis factor receptors. Cell Signal. 2012;24:1297-1305. [PubMed] [DOI] |
| 19. | Bertram A, Ley K. Protein kinase C isoforms in neutrophil adhesion and activation. Arch Immunol Ther Exp (Warsz). 2011;59:79-87. [PubMed] [DOI] |