修回日期: 2013-01-22
接受日期: 2013-01-25
在线出版日期: 2013-02-28
目的: 观察光敏剂磁性纳米粒子螯合物(photosensitizer-magnetic nanoparticle chelate complex, PMNCC)进入兔VX2肝转移癌模型体内的生物学分布情况.
方法: 成功制备PMNCC, 建立兔Vx2肝转移癌模型. 在成瘤后第16、18、20天经耳缘静脉注射PMNCC, 第22天处死实验兔, 取肿瘤及肝、脾、心、肺、肾组织, 利用普鲁氏染色、原子吸收光谱分析及透射电镜成像检测PMNCC在动物体内的生物学分布情况.
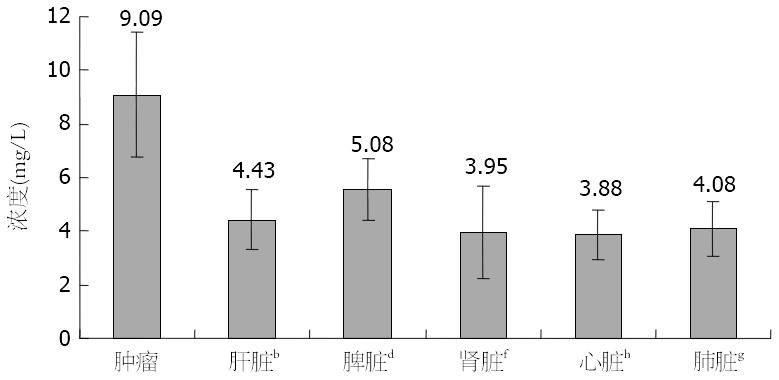
结果: 普鲁氏染色与透射电镜成像检测发现PMNCC在肿瘤组织内的摄取量明显高于肝脏、脾脏、肾脏等其他脏器组织, 原子吸收光谱分析检测肿瘤组织中铁相对浓度为9.09 mg/L±2.31 mg/L, 明显高于其他脏器组织(肝脏4.43 mg/L±1.10 mg/L、脾脏5.08 mg/L±1.35 mg/L、肾脏3.95 mg/L±1.70 mg/L、心脏3.88 mg/L±0.93 mg/L、肺脏4.08 mg/L±1.02 mg/L), 差异均有显著统计学意义(P<0.01).
结论: PMNCC在兔VX2肝转移癌模型体内主要被肿瘤组织摄取, PMNCC具有促进磁性纳米粒子进入肿瘤细胞内的能力.
引文著录: 龚健, 刘煜昊, 葛海燕. 光敏剂磁性纳米粒子螯合剂在兔VX2肝转移癌模型中的生物学分布. 世界华人消化杂志 2013; 21(6): 464-470
Revised: January 22, 2013
Accepted: January 25, 2013
Published online: February 28, 2013
AIM: To observe the biodistribution of photosensitizer-magnetic nanoparticle chelate complex (PMNCC) in rabbits with VX2 metastatic hepatic carcinoma.
METHODS: After PNMCC was successfully prepared, a rabbit model of VX2 metastatic hepatic carcinoma was developed. PMNCC was administered via the ear vein on the 16th, 18th and 20th day after induction of metastatic carcinoma, and tumor-bearing rabbits were sacrificed on the 22nd day. Tissue specimens were obtained and the biodistribution of PMNCC was observed by Prussian blue staining, atomic absorption spectroscopy (AAS) and transmission electron microscopy (TEM).
RESULTS: Prussian blue staining and TEM analysis showed that the amount of PMNCC in tumor tissue was significantly higher than those in the liver, spleen, or kidney. The mean relative iron concentration detected by atomic absorption spectroscopy in tumor tissue was 9.09 mg/L ± 2.31 mg/L, significantly higher than those in other organs (all P < 0.01).
CONCLUSION: PMNCC was mainly distributed in tumor tissue in rabbits with VX2 metastatic hepatic carcinoma, and PMNCC has the ability to carry magnetic nanoparticles into tumor cells.
- Citation: Gong J, Liu YH, Ge HY. Biodistribution of photosensitizer-magnetic nanoparticle chelate complex in rabbits with VX2 metastatic hepatic carcinoma. Shijie Huaren Xiaohua Zazhi 2013; 21(6): 464-470
- URL: https://www.wjgnet.com/1009-3079/full/v21/i6/464.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i6.464
肝转移癌的预后极差, 目前手术治疗仍是肝转移癌患者的主要治疗手段, 但是大部分患者在就诊时就已失去手术指征, 一般只有约10%-15%的患者适合手术切除[1]. 经过20多年的发展, 以肝动脉栓塞化疗为主的介入技术已成为肝癌非手术治疗的首选方法. 然而, 介入治疗的效果也远非理想[2,3]. 近年来, 随着纳米技术的研究进展, 肿瘤磁热疗(magnetically mediated hyperthermia, MMH)成为了肿瘤治疗的研究热点, 也为肿瘤治疗的发展带来了新契机. 磁热疗的特点之一就是靶向性, 这也是肿瘤磁热疗的前提, 靶向性不足将导致严重并发症. 我们的前期研究[4]已成功将光敏剂与磁性纳米粒子螯合, 并证实利用光敏剂的肿瘤靶向性能将磁性纳米粒子携带入肿瘤组织中. 在此基础上, 本研究通过观察PMNCC进入兔VX2肝移植癌模型体内的生物学分布情况, 明确PMNCC在生物体内是否具有良好的靶向性.
采用健康新西兰大白兔: 20只, 雌雄各半, 体质量2.5-3.0 kg, 由同济大学附属同济医院动物实验中心提供并饲养. 光敏剂: 主要成分为血卟啉单甲醚(HMME)(10 mg/mL), 避光, -20 ℃保存, 由上海市第二军医科大学红绿光研究所提供. 磁性纳米粒子: 主要成分为葡聚糖4万色包被的Fe3O4粒子, Fe含量为1.32 mmol/mL, 水合粒径: 50 nm, 多分散系数PDI = 0.197, 其型号为061010磁粒, 由上海交通大学纳米材料研究所惠赠. LEICA DM IRB显微镜及成像系统: 徕卡仪器有限公司产品. 透射电镜: CM120 Philips公司产品, 电镜成像检测由复旦大学电镜室协助完成. 3510型原子吸收光谱仪: 安捷伦科技上海有限公司产品.
1.2.1 光敏剂-纳米磁性螯合剂溶液的制备: 光敏剂: 10 μL, 纳米磁性粒子: 150 μL, 0.9%NaCl溶液: 10 mL. 等比值取光敏剂溶液、纳米磁性粒子溶液、0.9%NaCl溶液, 在PH = 7.35-7.45, 避光的条件下混匀, 37 ℃水浴30 min, 分装为10 mL. 避光, 使用前配制, 4 ℃保存.
1.2.2 兔VX2肝转移癌模型的建立方法及处理: 按3%戊巴比妥钠溶液1.0 mL/kg剂量经耳缘静脉麻醉实验兔. 取仰卧位, 以剑突为中心备皮, 直径约10 cm, 常规消毒. 取正中纵行切口, 长约3 cm, 暴露肝左叶, 轻提该肝叶, 用组织钳一头经肝包膜钝性斜行戳一窦道, 长约1 cm, 将已剪好的直径约1 mm3肿瘤组织块2-3块塞入窦道中, 生理盐水纱布压迫窦道口数分钟后明胶海棉止血, 以防止种植的肿瘤组织块脱出流入腹腔, 逐层关腹. 术后肌注1 mL硫酸庆大霉素预防感染. 在成瘤后第16、18、20天经耳缘静脉注射PMNCC溶液(1 mL/kg), 第22天处死试验兔, 取肿瘤及正常肝、脾、心、肺、肾组织.
1.2.3 普鲁氏蓝染色检测: 麻醉成功后切取大小约1 cm3的组织块, PBS刷洗, 迅速转移至4 ℃预冷的4%多聚甲醛固定液中, 4 ℃低温保存, 固定24 h. 制成石蜡切片, 经普鲁氏蓝染色中性红复染, 观察各脏器组织内PMNCC聚集及分布情况.
1.2.4 原子吸收光谱仪检测: 准确切取组织0.5 g, 剪碎组织, 按1:30加入0.25%胰酶, 4 ℃过夜. 1 500 r/min离心5 min去除胰酶, 按1:5加入红细胞裂解液, 10 min后3 000 r/min离心10 min去除上清液, 取细胞沉淀. 反复加入PBS液冲洗, 离心去除上清液, 直至细胞上清液澄清. 加入浓硝酸使细胞沉淀消化, 调控pH值1-2, 使所有铁元素氧化成游离三价铁离子. 3 000 r/min高速离心5 min, 取上清液. 去离子水定容至10 mL 滤纸过滤使样品澄清. 制定标准曲线. 根据溶液吸光度(A)值计算铁的浓度.
1.2.5 电镜检测: 成功麻醉后活体取样. 于载玻片上滴1滴4 ℃预冷的2.5%戊二醛固定液, 快速剪取小块组织, 在预冷的固定液内修切, 大小不超过1 mm3, 迅速转移至预冷的4 ℃固定液内, 取材过程在1 min左右完成. 常规制作电镜薄片, 3%醋酸铀-枸橼酸铅双电子染色, 透射电镜观察、拍片.
统计学处理 采用SPSS14.0统计学软件对实验结果进行统计学分析, 实验数据用mean±SD表示, P>0.05被认为差异无统计学意义, P<0.05被认为差异有统计学意义, P<0.01被认为差异有显著统计学意义.
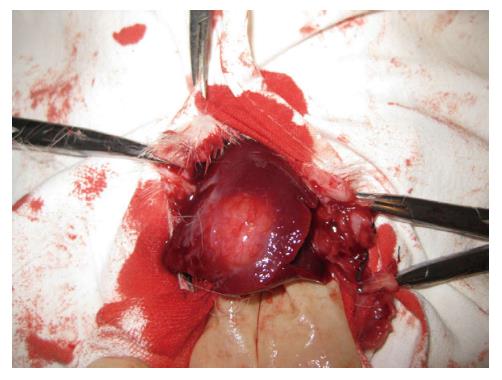
VX2肝转移癌模型于种植肿瘤组织块后10天左右形成, 多为肝脏突起肿块, 一个或数个, 色白质韧, 大小1 cm×1 cm×1 cm至4 cm×4 cm×4 cm不等, 与周围边界尚清(图1).
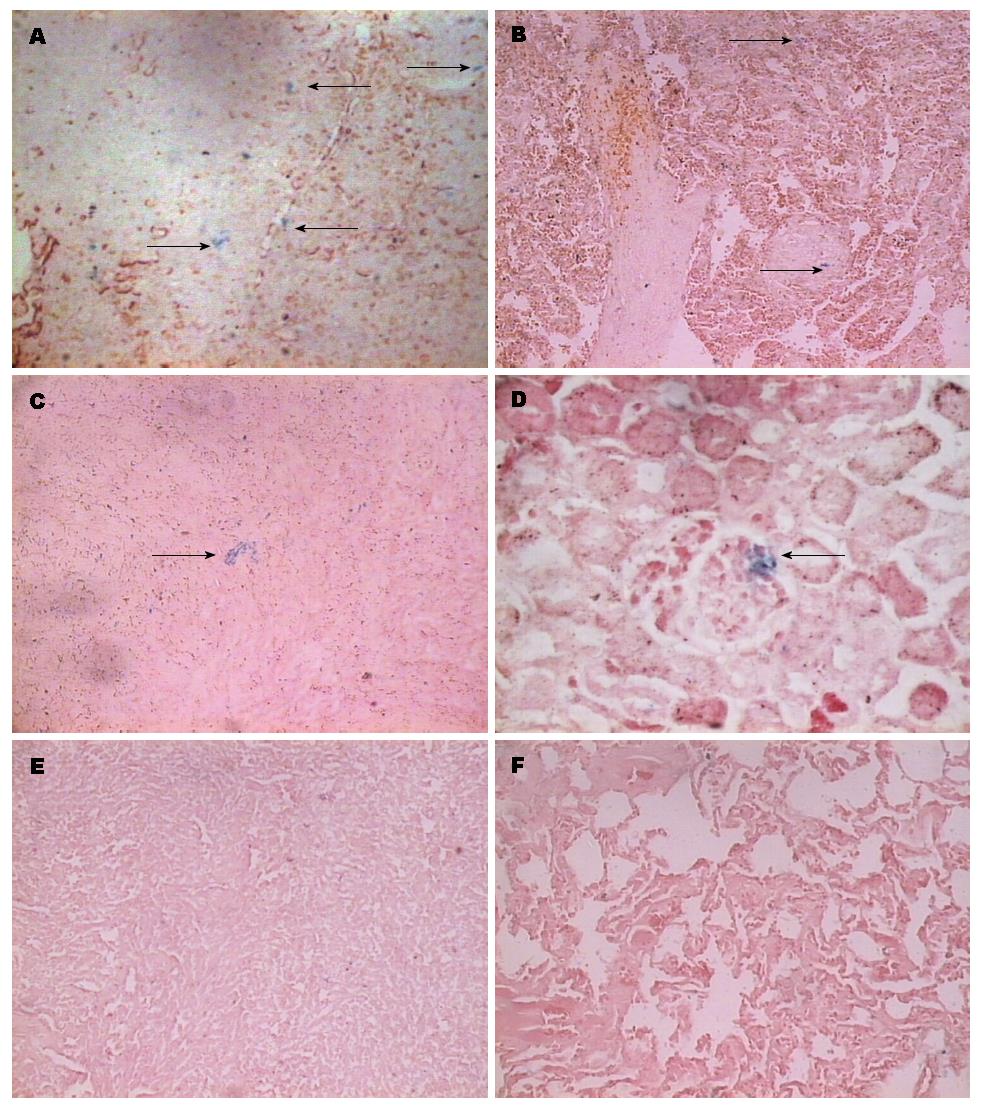
PMNCC含有游离Fe, 经普鲁氏染色后在光镜下表现为天蓝色颗粒, 可呈散在或聚集分布. 肿瘤组织中可见到大量天蓝色颗粒聚集沉着, 均匀散在分布, 明显多于其他脏器组织(图2A), 同时脾脏、肝脏中也见到少量的天蓝色颗粒(图2B, C), 心肺组织中未见天蓝色颗粒(图2E, F), 而在肾小球内发现少量天蓝色颗粒, 肾间质中未见明显异常表现(图2D), 推测PMNCC经肾脏排泄.
制定分析检测所需标准曲线. 在肿瘤组织中铁相对浓度高达9.09 mg/L±2.31 mg/L, 将近为其他脏器组织内的2倍多, 分别与肝脏4.43 mg/L±1.10 mg/L、脾脏5.08 mg/L±1.35 mg/L、肾脏3.95 mg/L±1.70 mg/L、心脏3.88 mg/L±0.93 mg/L、肺脏4.08 mg/L±1.02 mg/L中铁相对浓度比较, 差异有显著统计学意义, 均P<0.01(t值分别为5.762、4.744、5.668、6.625、5.682). 而肝脏、脾脏、肾脏、心脏、肺脏中铁相对浓度之间分别比较, 均P>0.05(图3).
磁热疗是在肿瘤病灶部位引入磁性介质, 磁性介质在外加的交变磁场作用下温度升高到41 ℃以上而杀死周围的肿瘤细胞[5]. 早在1957年, Gilchrist等[6]首先将磁性纳米微粒应用于医学研究, 将肿瘤热疗推至了磁靶向热疗的新阶段, 但由于当时条件所限, 诸如材料、温度测定方法、磁场等, 研究结果与临床应用相距甚远.
磁热疗理想的状态是磁性纳米粒子只聚集于肿瘤组织, 而不出现在其他脏器组织中, 从而将治疗局限于病灶, 不损伤到正常组织, 具有良好的靶向性是其推广至临床的前提. 为此, 国内外学者对此做了大量的研究, 希望能找到合适的方法携带更多磁性纳米粒子选择性进入肿瘤细胞内. 文献报导较多的应用于生物医学领域的磁性粒子的表面修饰分子是葡聚糖分子[7,8]. 国内学者Ma等[9]通过在Fe3O4纳米颗粒表面修饰聚乙二醇, 也在一定程度上提高了肿瘤细胞对Fe3O4纳米颗粒的摄取能力. 同样, Sonvico等[10]及郑元青等[11]采用叶酸对γ-Fe2O3纳米粒子进行表面修饰, Kohler等[12]使用甲氨喋呤与磁性纳米粒子结合, 赵印敏等[13]利用血管新生肽修饰的氧化铁纳米粒, 均被证实具有一定靶向作用, 但其在体内的摄入量及实际转运效果均尚不理想. 近期, 张建超等[14]利用负载γ-Fe2O3磁性纳米颗粒及阿霉素的海藻酸钠磁性载药微囊对脑胶质瘤C6细胞热化联合治疗. Basel等[15]利用肿瘤归巢细胞携带磁性纳米粒子治疗胰腺癌小鼠模型, 亦被证实了潜在的应用价值.
光敏剂可选择性积聚于肿瘤组织内, 在以特定波长的激光激活肿瘤组织内浓度相对较高的光敏剂, 通过光化学反应产生自由基、单态氧和血栓素A2, 杀伤肿瘤细胞, 即光动力疗法(photodynamic therapy, PDT). 与其他药物相比, 光敏剂自身具有一定的选择性, 能够相对高浓度的聚集在病变组织, 同时治疗时可以将辐射光源局限于病变组织, 因此PDT具有"二次选择性", 可相对特异性的杀伤病变细胞而不损伤正常组织[16]. 目前, PDT已广泛运用于临床诊治中, 包括皮肤肿瘤[17]、结肠癌[18]、视网膜血管瘤[19]、支气管肿瘤[20]、胆道肿瘤[21]、食道癌[22]等多种疾病.
相对于PDT, MTH目前主要还处于实验室与动物实验研究阶段, 临床上主要尝试应用于前列腺癌、脑胶质细胞瘤等治疗. 2005年, 德国学者Johannsen等[23]首次将磁性纳米粒子用于人类前列腺癌热疗的临床实验, 结果证实了磁热疗可以作为复发前列腺癌的微创性治疗方法. 同样, Maier-Hauff等[24]对治愈后再发前列腺癌的10名患者注入生物相容性的超顺磁性纳米粒子, 同样取得了确定疗效. 而在早期, 也有将右旋糖酐纳米磁性微粒经静脉注入患者血循环中, 而后在外加高频交变磁场中进行全身热疗的报道[25]. 同样, 利用磁性纳米粒子治疗脑胶质细胞瘤也被证实了其可行性及有效性[26,27].
我们独创性地利用光敏剂的亲肿瘤性将磁性纳米粒子携带入肿瘤细胞内, 为磁热疗的靶向性研究开拓了新的思路, 本实验通过普鲁氏蓝染色及透射电镜成像检测, 证实肝脏肿瘤组织中PMNCC的摄入量明显高于其他脏器组织. 原子吸收光谱检测也提示肿瘤组织中铁含量明显升高, 证实了PMNCC在体内具有良好的肿瘤靶向性.
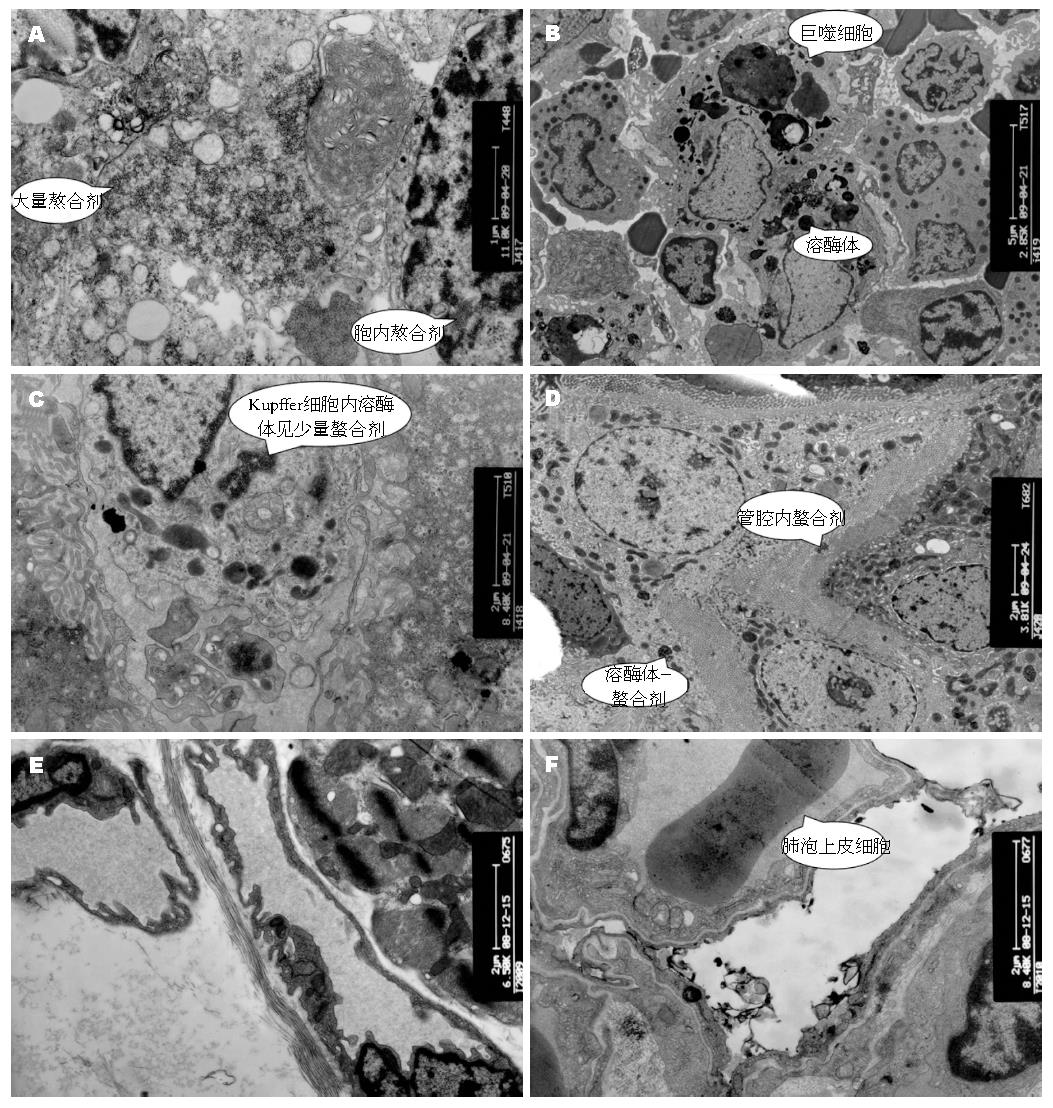
同时我们发现在脾脏、肝脏等网状内皮系统中, 虽然PMNCC的摄取量较肿瘤组织明显少, 但也有一定量的摄取. 分析原子吸收光谱检测结果也提示脾脏中相对含铁量在各个脏器中最高, 此结果与许多国内文献报道相符[28-30]. 内皮网状系统对PMNCC的摄取可能会对今后推广至临床实际运用中带来一定的不良反应, 这就需要我们进一步检测PMNCC在各个脏器内的代谢动力学情况以及寻求最佳注射剂量, 以在达到治疗效果的同时把对网状内皮系统脏器的损伤减到最小. 在普鲁氏染色与透射电镜成像检测中, 我们还意外发现在肾小球以及肾小管内有少量PMNCC沉着, 因此我们有理由推测可能主要通过肾脏排泄PMNCC.
本研究运用3种检测方法检测, 所得实验结果相一致, 从不同角度证实了PMNCC在兔VX2肝转移癌模型体内主要被肿瘤组织摄取, PMNCC具有强大的携带磁性纳米粒子进入肿瘤细胞内的功能. 这一研究成果将为PMNCC在肿瘤磁热疗中的运用及推广提供理论基础.
随着纳米技术的发展, 肿瘤磁热疗成为了当前的研究热点, 但由于磁性纳米粒子没有与肿瘤特异性结合的靶向特点, 严重阻碍了肿瘤磁热疗的发展.
高润平, 教授, 吉林大学第一医院肝胆胰内科
光敏剂与磁性纳米粒子具有螯合基础, 本研究检测螯合剂在动物模型体内的生物学分布情况, 拟证实螯合剂具有良好的肿瘤靶向性.
Basel等利用肿瘤归巢细胞携带磁性纳米粒子治疗胰腺癌小鼠模型, 结果显示具有提高肿瘤磁热疗的作用.
本研究独创性的运用光敏剂的亲肿瘤性携带磁性纳米粒子进入肿瘤组织中, 为肿瘤磁热疗靶向性研究方面提供了新的思路.
磁靶向热疗是一种新型的实体肿瘤治疗方法, 利用光敏剂的亲肿瘤性携带磁性纳米粒子进入肿瘤细胞内具有创新性. 探索光敏剂磁性纳米粒子螯合剂的生物学分布情况为开展肿瘤磁靶向热疗奠定了理论基础.
本文对光敏剂磁性纳米粒子螯合物(PMNCC)在兔VX2肝转移癌模型体内生物学分布进行了研究, 结果表明肝转移瘤组织内PMNCC的摄入量明显高于其他脏器组织, 为磁热疗的靶向性提供了实验基础.
编辑: 田滢 电编: 闫晋利
| 1. | Moroz P, Jones SK, Gray BN. Arterial embolization hyperthermia in porcine renal tissue. J Surg Res. 2002;105:209-214. [PubMed] [DOI] |
| 2. | Takamatsu S, Matsui O, Gabata T, Kobayashi S, Okuda M, Ougi T, Ikehata Y, Nagano I, Nagae H. Selective induction hyperthermia following transcatheter arterial embolization with a mixture of nano-sized magnetic particles (ferucarbotran) and embolic materials: feasibility study in rabbits. Radiat Med. 2008;26:179-187. [PubMed] [DOI] |
| 3. | Fortin JP, Gazeau F, Wilhelm C. Intracellular heating of living cells through Néel relaxation of magnetic nanoparticles. Eur Biophys J. 2008;37:223-228. [PubMed] [DOI] |
| 4. | 葛 海燕, 常 卓林, 李 淑萍, 刘 煜昊, 龚 健. 光敏剂-磁性纳米粒子螯合剂对磁性纳米粒子在VX2肝转移癌细胞内靶向性分布的影响. 世界华人消化杂志. 2011;19:3064-3069. [DOI] |
| 5. | Moroz P, Jones SK, Gray BN. Magnetically mediated hyperthermia: current status and future directions. Int J Hyperthermia. 2002;18:267-284. [PubMed] [DOI] |
| 6. | Gilchrist RK, Medal R, Shorey WD, Hanselman RC, Parrott JC, Taylor CB. Selective inductive heating of lymph nodes. Ann Surg. 1957;146:596-606. [PubMed] [DOI] |
| 7. | Kawaguchi T, Hanaichi T, Hasegawa M, Maruno S. Dextran-magnetite complex: conformation of dextran chains and stability of solution. J Mater Sci Mater Med. 2001;12:121-127. [PubMed] |
| 8. | Lacava LM, Lacava ZG, Da Silva MF, Silva O, Chaves SB, Azevedo RB, Pelegrini F, Gansau C, Buske N, Sabolovic D. Magnetic resonance of a dextran-coated magnetic fluid intravenously administered in mice. Biophys J. 2001;80:2483-2486. [PubMed] [DOI] |
| 9. | Ma M, Zhang Y, Yu W, Shen HY, Zhang HQ, Gu N. Preparation and characterization of magnetite nanoparticles coated by amino silane. Eng Aspects. 2003;212:219-226. |
| 10. | Sonvico F, Mornet S, Vasseur S, Dubernet C, Jaillard D, Degrouard J, Hoebeke J, Duguet E, Colombo P, Couvreur P. Folate-conjugated iron oxide nanoparticles for solid tumor targeting as potential specific magnetic hyperthermia mediators: synthesis, physicochemical characterization, and in vitro experiments. Bioconjug Chem. 2005;16:1181-1188. [PubMed] [DOI] |
| 12. | Kohler N, Sun C, Wang J, Zhang M. Methotrexate-modified superparamagnetic nanoparticles and their intracellular uptake into human cancer cells. Langmuir. 2005;21:8858-8864. [PubMed] [DOI] |
| 15. | Basel MT, Balivada S, Wang H, Shrestha TB, Seo GM, Pyle M, Abayaweera G, Dani R, Koper OB, Tamura M. Cell-delivered magnetic nanoparticles caused hyperthermia-mediated increased survival in a murine pancreatic cancer model. Int J Nanomedicine. 2012;7:297-306. [PubMed] [DOI] |
| 16. | Juarranz A, Jaén P, Sanz-Rodríguez F, Cuevas J, González S. Photodynamic therapy of cancer. Basic principles and applications. Clin Transl Oncol. 2008;10:148-154. [PubMed] [DOI] |
| 17. | Wiegell SR, Skødt V, Wulf HC. Daylight-mediated photodynamic therapy of basal cell carcinomas - an explorative study. J Eur Acad Dermatol Venereol. 2013; Jan 7. [Epub ahead of print]. [PubMed] [DOI] |
| 18. | Hatakeyama T, Murayama Y, Komatsu S, Shiozaki A, Kuriu Y, Ikoma H, Nakanishi M, Ichikawa D, Fujiwara H, Okamoto K. Efficacy of 5-aminolevulinic acid-mediated photodynamic therapy using light-emitting diodes in human colon cancer cells. Oncol Rep. 2013;29:911-916. [PubMed] [DOI] |
| 19. | Papastefanou VP, Pilli S, Stinghe A, Lotery AJ, Cohen VM. Photodynamic therapy for retinal capillary hemangioma. Eye (Lond). 2013; Jan 4. [Epub ahead of print]. [PubMed] [DOI] |
| 20. | Moghissi K, Dixon K, Gibbins S. Photodynamic therapy for bronchial carcinoid tumours: complete response over a 10-year follow-up. Eur J Cardiothorac Surg. 2013; Jan 2. [Epub ahead of print]. [PubMed] |
| 21. | Pereira SP, Aithal GP, Ragunath K, Devlin J, Owen F, Meadows H. Safety and long term efficacy of porfimer sodium photodynamic therapy in locally advanced biliary tract carcinoma. Photodiagnosis Photodyn Ther. 2012;9:287-292. [PubMed] [DOI] |
| 22. | Yoon HY, Cheon YK, Choi HJ, Shim CS. Role of photodynamic therapy in the palliation of obstructing esophageal cancer. Korean J Intern Med. 2012;27:278-284. [PubMed] [DOI] |
| 23. | Johannsen M, Gneveckow U, Eckelt L, Feussner A, Waldöfner N, Scholz R, Deger S, Wust P, Loening SA, Jordan A. Clinical hyperthermia of prostate cancer using magnetic nanoparticles: presentation of a new interstitial technique. Int J Hyperthermia. 2005;21:637-647. [PubMed] [DOI] |
| 24. | Maier-Hauff K, Rothe R, Scholz R, Gneveckow U, Wust P, Thiesen B, Feussner A, von Deimling A, Waldoefner N, Felix R. Intracranial thermotherapy using magnetic nanoparticles combined with external beam radiotherapy: results of a feasibility study on patients with glioblastoma multiforme. J Neurooncol. 2007;81:53-60. [PubMed] [DOI] |
| 25. | Wyman R. The temporal stability of the Drosophila oocyte. J Embryol Exp Morphol. 1979;50:137-144. [PubMed] [DOI] |
| 26. | Johannsen M, Gneveckow U, Thiesen B, Taymoorian K, Cho CH, Waldöfner N, Scholz R, Jordan A, Loening SA, Wust P. Thermotherapy of prostate cancer using magnetic nanoparticles: feasibility, imaging, and three-dimensional temperature distribution. Eur Urol. 2007;52:1653-1661. [PubMed] [DOI] |
| 27. | Zhao L, Yang B, Wang Y, Yao Z, Wang X, Feng SS, Tang J. Thermochemotherapy mediated by novel solar-planet structured magnetic nanocomposites for glioma treatment. J Nanosci Nanotechnol. 2012;12:1024-1031. [PubMed] [DOI] |
| 28. | 冯 彦林, 谭 家驹, 梁 生, 孙 静, 温 广华, 吴 校连, 夏 姣云. 抗人肝癌188Re-免疫磁性纳米微粒的生物学分布和肿瘤细胞抑制实验. 国际放射医学核医学杂志. 2007;31:321-324, 328. |