修回日期: 2013-05-31
接受日期: 2013-07-03
在线出版日期: 2013-08-08
目的: 研究miR-30d在结直肠癌组织中的表达情况, 并分析miR-30d反义寡核酸(antisense oligonucleotide, ASO)对结肠癌细胞增殖和凋亡的影响.
方法: 运用荧光定量PCR定量检测102例结直肠癌组织及对应癌旁组织中miR-30d的表达; 通过miR-30d ASO降低结肠癌细胞中miR-30d的表达, 利用MTT、细胞克隆形成实验、流式细胞技术观察miR-30d ASO对结肠癌细胞产生的生物学效应.
结果: 在102例结直肠癌病例中, 52.94%(54/102)的结直肠癌组织miR-30d表达明显高于对癌旁组织(P<0.05); miR-30d ASO可以显著降低miR-30d的表达(P<0.05); MTT实验结果显示结肠癌细胞转染miR-30d ASO后, 24、48和96 h的细胞存活数量均明显低于空白对照组和转染无义干扰组(P<0.05); 克隆形成实验结果显示miR-30d ASO组克隆形成率比空白对照组和转染无义干扰组显著降低(P<0.05); 流式细胞仪检测结果显示转染miR-30d ASO组较两个对照组细胞凋亡指数明显增加(P<0.05); 另外, 降低miR-30d的表达后发现Bcl-2 mRNA和蛋白均明显下降(P<0.05).
结论: miR-30d在结肠癌组织中表达上调, 降低miR-30d的表达可有效抑制结肠癌细胞生长、促进细胞凋亡. miR-30d有可能成为结肠癌基因表达调控的新靶点.
核心提示: miR-30d在结肠癌组织中表达上调, 降低miR-30d的表达可有效抑制结肠癌细胞生长、促进细胞凋亡. miR-30d有可能成为结肠癌基因表达调控的新靶点.
引文著录: 张善忠, 周毅, 刘芩, 汪志飞, 万冰. miR-30d反义核苷酸对结肠癌细胞增殖及凋亡的影响. 世界华人消化杂志 2013; 21(22): 2143-2150
Revised: May 31, 2013
Accepted: July 3, 2013
Published online: August 8, 2013
AIM: To investigate the expression of miR-30d in colon cancer tissues and the effect of a miR-30d antisense oligonucleotide (ASO) on the proliferation and apoptosis of colon cancer cells.
METHODS: The expression of miR-30d in 102 colon cancer tissues and matched tumor-adjacent tissues was detected by real-time quantitative PCR. After colon cancer cells were transfected with a miR-30d ASO, cell proliferation and apoptosis were measured by MTT assay, colony formation assay and flow cytometry.
RESULTS: miR-30d was overexpressed in 52.94% (54/102) of colon cancer tissues, and the positive rate of miR-30d overexpression was significantly higher in colon cancer tissues than in tumor-adjacent colon tissues (P < 0.05). Transfection of miR-30d ASO significantly reduced the expression of miR-30d (P < 0.05), decreased cell survival at 24, 48 and 96 h (all P < 0.05), inhibited colony formation (P < 0.05), and increased apoptosis (P < 0.05) compared with control cells. In addition, the expression of Bcl-2 mRNA and protein was significantly decreased after the expression of miR-30d was down-regulated.
CONCLUSION: MiR-30d is overexpressed in human colon cancer. Inhibition of the expression of miR-30d can effectively inhibit growth and promotes apoptosis of colon cancer cells. MiR-30d may become a new target for the regulation of gene expression in colon cancer.
- Citation: Zhang SZ, Zhou Y, Liu Q, Wang ZF, Wan B. A miR-30d antisense oligonucleotide inhibits proliferation and promotes apoptosis of colon cancer cells. Shijie Huaren Xiaohua Zazhi 2013; 21(22): 2143-2150
- URL: https://www.wjgnet.com/1009-3079/full/v21/i22/2143.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i22.2143
微小RNA分子(microRNA, miRNA)是一种内源性的非编码小分子RNA, 广泛分布于动植物细胞体内, 大量研究发现miRNA在恶性肿瘤细胞的发生、发展中发挥重要作用, 其中包括调控细胞的增殖、分化和凋亡[1-8]. 研究报道miR-30d在前列腺癌、肾细胞癌以及肝癌等恶性肿瘤中表达上调[9-11]. 过表达的miR-30d可以促进肝癌细胞发生发展[11]. 然而miR-30d在结肠癌中的表达及功能研究尚未见报道. 本实验采用荧光定量PCR的方法检测miR-30d在结直肠癌组织中的表达情况, 同时设计并利用miR-30d的反义寡核酸(antisense oligonucleotide, ASO)抑制miR-30d在结肠癌细胞中的表达, 研究抑制miR-30d对结肠癌细胞增殖和凋亡的影响, 同时分析其调控的分子机制.
经景德镇市第一人民医院医学伦理委员会批准及患者知情同意, 收集2008-01/2012-12景德镇市第一人民医院胃肠外科肠癌及对应癌旁组织手术标本(n = 102). 所有标本均经病理学检查确诊, 其中男68例, 女34例, 年龄26-71岁. 所有患者术前均未接受放化疗. 结肠癌SW480和LoVo细胞购自中国科学院上海细胞库; TaqMan miRNA分析试剂盒(美国ABI公司); DMEM高糖培养基(美国Gibco公司)、胎牛血清(美国Hyclone公司)、脂质体Lipfectamine 2000(美国Invitrogen公司); 反义miR-30d寡核苷酸(miR-30d ASO)(大连宝生物公司); Annexin V-FITC凋亡检测试剂盒(南京凯基公司); 总蛋白提取试剂盒(北京普利莱); 鼠抗人Bcl-2单克隆抗体(美国Santa cruz公司), β-actin二抗((北京中杉金桥公司); 实时荧光定量PCR分析仪(美国ABI公司); 流式细胞仪(美国BD公司).
1.2.1 荧光定量PCR检测miR-30d的表达: 采用RNA提取试剂提取癌组织及癌旁组织中总RNA, 测定浓度, -80 ℃保存. 运用miRNA分析试剂盒检测miR-30d的表达. 首先取2 μg总RNA为反应模板与3 μL逆转录酶相互混合, 反应体系为20 μL, 反应条件为: 16 ℃ 30 min, 45 ℃ 30 min, 85 ℃ 5min. 反应结束后, 收集cDNA. 采用SYBR Green法定量检测, 将质粒稀释品分别梯度稀释为1×10-1、1×10-2、1×10-3、1×10-4、1×10-5、1×10-6、1×10-7和1×10-8, 用于建立标准曲线. 反应条件: 95 ℃ 15 min; 95 ℃ 30 s, 60 ℃ 30 s, 72 ℃ 30 s, 共45个循环, 最后72 ℃延伸7 min. 在每个循环的最后增加溶解曲线. 阈值定义为基础荧光信号的10个标准差, 即时循环数为Ct, 依据标准曲线计算目的基因的mRNA量. 实验重复3次.
1.2.2 反义miR-30d单核苷酸的设计: 获取人miR-30d的序列(http://www.sanger.ac.uk/software/Rfam/mirna), 设计其反义寡核苷酸序列, 运用NCBI BLAST索程序以排除其他的同源序列. 另外, 同时设计一条随机阴性对照序列, 如下所示: 反义miR-30d sense: 5'-CAUUGCCAGUCGUUACGUGUC-3', antisense: 5'-GACACGTAACGACTGGCAATG-3', 随机序列: sense: 5'-UCCUCUGAACGUGGCACGUUT-3'; antisense: 5'-AGCUCACTCGUCCGCAGTATT-3', 送上海英骏生物技术公司合成.
1.2.3 细胞培养和反义寡核苷酸转染: 将SW480和LoVo结肠癌细胞接种于DMEM培养基(含10%FBS), 50 mL/L CO2、37 ℃条件下培养. 运用LipfectamineTM 2000转染试剂盒进行转染, 反义miR-30d寡核苷酸终浓度分别为: 100、150、200和250 nmol/L. 本实验组筛选出最佳终干扰浓度为150 nmol/L. 转染后培养时间分别为24、48、72 h初步筛出最佳作用时间为48 h. 上述操作重复3次.
1.2.4 转染miR-30d ASO后对miR-30d表达的影响: 转染终浓度为150 nmol/L的miR-30d ASO 48 h后, 提取总RNA, 测定浓度, 逆转录为cDNA(反应条件同1.2.1), 测定cDNA浓度. 运用microRNA检测试剂盒检测miR-30d的表达(具体条件同1.2.1). 上述操作重复3次.
1.2.5 克隆形成实验检测结肠癌细胞的增殖: 实验分为3组: 空白对照组、转染无义干扰组和miR-30d ASO组. 转染结肠癌SW480和LoVo细胞后, 取对数生长期的细胞接种于6孔培养板中, 约400-500个/孔, 置37 ℃、50 mL/L CO2, 培养2-3 wk. 期间观察培养细胞的生长情况, 当出现肉眼可见的克隆细胞团时, 终止细胞培养. 去上清, PBS漂洗2次. 固定20 min, 去固定液, 加Giemsa染色液染色30 min, 之后利用ddH2O清洗染色液, 干燥后在普通光学显微镜下计算>50个细胞的克隆数, 克隆形成率 = 克隆数/接种细胞数×100%. 上述操作重复3次.
1.2.6 MTT检测结肠癌细胞生长情况: 实验分组同1.2.5, 收集各组SW480和LoVo细胞, 将细胞充分打匀, 接种于96孔培养板(6×103/孔), 24 h后换液. 每组设有6个复孔. 转染后第1天至第4天, 每孔加入MTT试剂(浓度为5 mg/mL)20 μL, 在50 mL/L CO2、37 ℃条件下继续孵育4 h. 去各孔上清, 滴入DMSO每孔150 μL, 在室温摇10 min, 以完全溶解MTT结晶. 测定各孔吸光度(A)值(波长490 nm). 每组重复3次. 按下列公式计算细胞生长抑制率(%): 细胞生长抑制率 = (实验组平均A490-对照组平均A490)/对照组平均A490×100%上述操作重复3次.
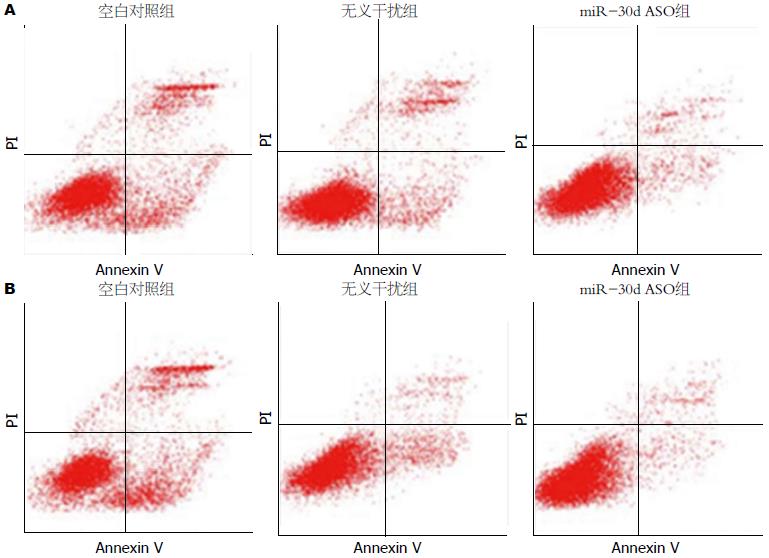
1.2.7 流式细胞术分析细胞早期凋亡: 实验分组同1.2.5, 将结肠癌细胞接种于6孔板中, 转染反义miR-30d ASO. 48 h后收集细胞, PBS漂洗2次, 离心、弃上清. 最后运用Annexin V-FITC早期凋亡试剂盒和流式细胞仪检测各组细胞的早期凋亡情况. 上述操作重复3次.
1.2.8 检测各组细胞Bcl-2 mRNA的表达水平: 实验分组同1.2.5, 各组细胞加入裂解液, 提取总RNA, 逆转录为cDNA, 运用SYBR Green Real Time PCR Master Mix通过荧光定量PCR方法检测Bcl-2 mRNA表达. Bcl-2的引物序列为上游: 5'-AACTGGGGGAGGATTGTGGC-3'; 下游: 5'-GATCCAGGTGTGCAGGTGCC-3'. 反应条件: 95 ℃变性45 s, 58 ℃退火45 s, 72 ℃延伸30 s, 40个循环. 以GAPDH作为内参. 在ABI7500反应平台上进行PCR反应.
1.2.9 检测各组细胞Bcl-2蛋白的表达水平: 实验分组同1.2.5, 收集各组结肠癌细胞, 运用总蛋白提取试剂盒提取总蛋白, 经10%SDS-PAGE电泳后转膜, 将膜放在含5%脱脂奶粉的TBST缓冲液中37 ℃封闭2 h, 加一抗稀释液 1:600稀释鼠抗人Bcl-2单克隆抗体, 4 ℃过夜, 1×TBST缓冲液洗3次(每次10 min), 加辣根过氧化物酶标记的山羊抗兔IgG(1:5000稀释), 置于37 ℃孵育2 h, 1×TBST缓冲液洗3次(每次10 min), 运用ECL化学发光法检测目的蛋白条带. 以β-actin作为内参.
统计学处理 采用SPSS17.0统计软件包进行分析. 计量资料以mean±SD表示, 癌及癌旁组织比较采用配对样本t检验, 多组均数之间比较采用单因素方差分析, 两两比较采用LSD-t检验, P<0.05为差异有统计学意义.
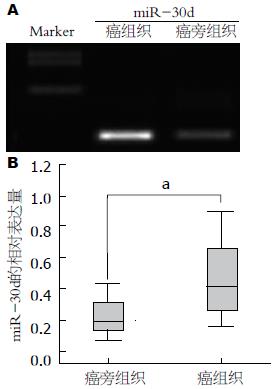
利用荧光定量PCR检测102例结直肠癌患者癌及癌旁组织中miR-30d的表达, 结果发现: 52.94%(54/102)例结直肠癌组织miR-30d的表达明显高于相对应的正常癌旁组织, 结果有统计学意义(t = 26.57, P<0.05)(图1).
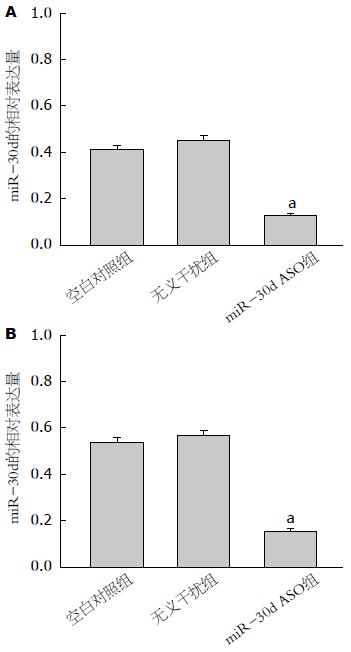
荧光定量PCR方法检测结果发现: SW480细胞转染miR-30d ASO组miR-30d的相对表达量较空白对照组和转染无义干扰组明显降低(组间F = 292.43, P<0.05); LoVo细胞同样发现miR-30d ASO组miR-30d的相对表达量较空白对照组和转染无义干扰组明显下调(组间F = 341.32, P<0.05)(图2).
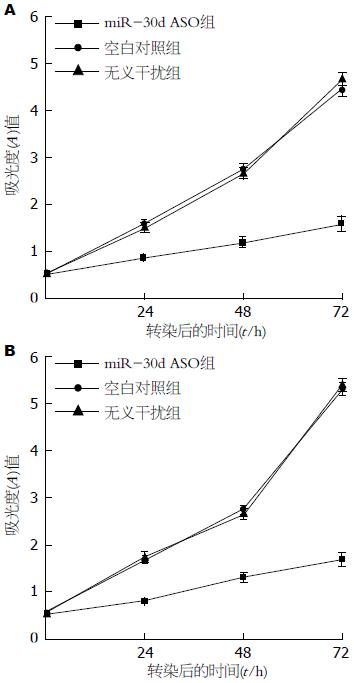
MTT检查结果发现: SW480细胞转染miR-30d ASO组的生长较空白对照组和转染无义干扰组明显降低(P<0.05), 而空白对照组和转染无义干扰组细胞生长情况无明显差别(P>0.05). LoVo细胞与SW480细胞结果一致(图3).
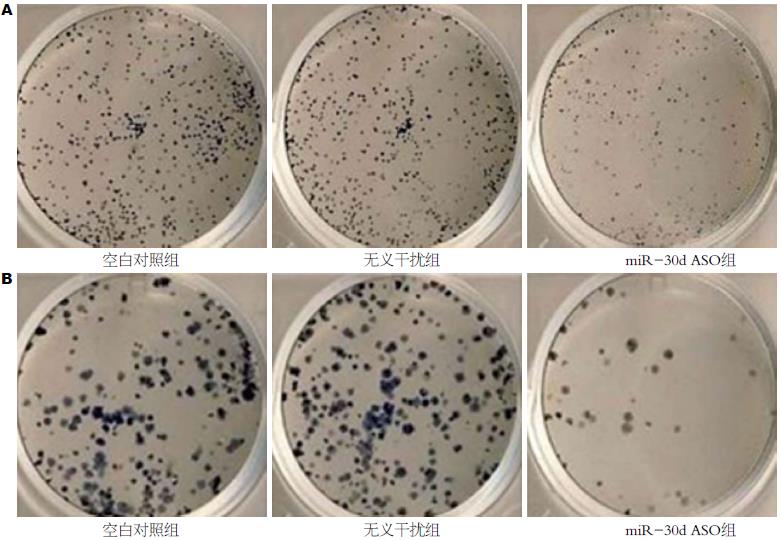
克隆形成实验结果提示: miR-30dASO转染SW480细胞后, 克隆形成率比空白对照组和转染无义干扰组明显降低(P<0.05). LoVo细胞与SW480细胞结果一致(图4).
结肠癌细胞SW480转染miR-30d ASO后, 流式细胞仪检测细胞凋亡的结果显示: miR-30d ASO组的凋亡指数增加明显(P<0.05). LoVo细胞与SW480细胞结果一致(图5).
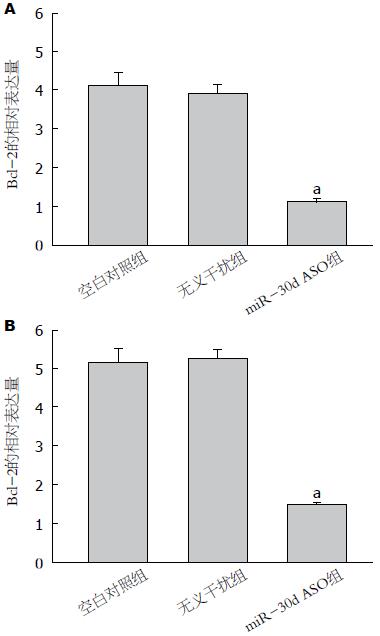
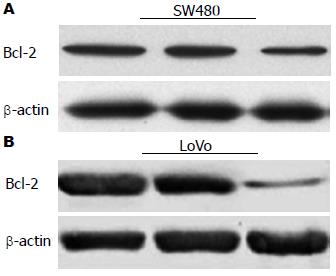
miR-30d ASO转染SW480和LoVo细胞后, 利用荧光定量PCR和Western blot检查各组细胞中Bcl-2 mRNA和Bcl-2蛋白表达水平, 结果发现miR-30d ASO组Bcl-2 mRNA和Bcl-2蛋白的相对表达水平明显低于空白对照组和转染无义干扰组(P<0.05)(图6, 7).
研究已经证实miRNAs是一类新的基因调节子, 其在控制细胞的生长、发育、分化、新生血管形成和凋亡等生物学过程中发挥着非常重要的作用[12,13]. 随着miRNA的发现以及逐渐深入的研究, 研究发现miRNAs与癌症的发生及侵袭转移关联紧密[14,15]. 因此miRNAs有可能成为诊断恶性肿瘤的分子标志和判断肿瘤侵袭转移及预后的分子靶点, 此外miRNAs在转录后水平调节其靶基因的表达, 这将更有助于癌症的早期发现、早期诊断和早期治疗, 其必将具有非常广阔的临床应用前景.
结直肠癌是世界上我国乃至世界上最常见的恶性肿瘤之一, 尤其常见于西方发达国家[16-27], 在中国结直肠癌发病率的增长速度是全世界平均增长水平的2倍[16]. 结直肠癌的发生过程比较缓慢, 多数是由于结直肠黏膜发生病变然后逐渐发展为腺瘤状息肉, 最后演变成具有侵袭转移特性的恶性肿瘤. 如果早期诊断和治疗, 结直肠患者生存率可高达90%. 但由于结直肠早期临床表现并无特异性, 几乎所发现的结直肠患者大约50%以上属于临床晚期, 治疗效果不理想. 因此, 我们急迫地需要找到新的肿瘤标志物来进一步提高结直肠癌的早期诊疗效果. 近年随着miRNAs研究的不断深入, 发现大量异常表达的miRNAs通过调控靶基因的表达而调节包括结肠癌在内的多种恶性肿瘤的发生发展, 大规模地筛选肿瘤发生发展过程中异常表达的miRNAs将为人们全面认识肿瘤的生物学特性发挥重要作用, 也为结肠癌的早期诊治提供了新的希望. 最近研究发现miR-30d在前列腺癌及肝癌等恶性肿瘤中的表达上调[9-11], 但miR-301在结直肠癌中的表达及其作用目前还不清楚.
本实验首先利用实时荧光定量PCR检测临床结直肠癌标本和对应的正常癌旁组织, 结果发现miR-30d在肿瘤组织中呈明显高表达, 两者差异具有统计学意义. 这表明miR-30d在结直肠癌发生发展中发挥重要作用. 目前有大量研究针对目的miRNA设计相应的ASO来研究miRNA在细胞中的生物学功能[28-30]. 为了进一步分析miR-30d对结肠癌细胞功能的影响, 本实验首先通过转染miR-30d ASO降低结肠癌细胞中miR-30d的表达, 同时利用MTT方法检测降低miR-30d的表达后结肠癌细胞生长情况, 结果发现转染miR-30d ASO的结肠癌细胞存活率明显降低. 此外我们运用克隆形成实验还观察到转染miR-30d ASO后, 结肠癌细胞克隆形成率比空白对照组和无义干扰组明显减少. 表明miR-30d在结肠癌细胞的生长中发挥着非常重要的作用.
为了进一步分析降低miR-30d表达对结肠癌细胞凋亡情况的影响, 本实验运用流式细胞技术检测细胞凋亡情况, 结果发现转染miR-30d ASO组细胞凋亡较对照组明显增加. 因为Bcl-2与细胞凋亡的关系密切. 为证实miR-30d对结肠癌细胞凋亡的影响是否与Bcl-2相关, 本实验通过检测miR-30d ASO组和对照组Bcl-2 mRNA和蛋白变化, 结果发现转染miR-30d ASO组Bcl-2 mRNA和蛋白水平明显降. 这表明miR-30d可能通过调节Bcl-2的表达而影响细胞的凋亡, 从而进一步达到对肿瘤细胞增殖能力的调控.
总之, miR-30d在调控结肠癌细胞的增殖和凋亡方面发挥重要作用, 其很可能成为一个结肠癌新的癌前标志物, 为结肠癌临床基因治疗提供新的靶点.
微小RNA分子(microRNA, miRNA)是一种内源性的非编码小分子RNA, 广泛分布于动植物细胞体内, 大量研究发现miRNA在恶性肿瘤细胞的发生、发展中发挥重要的作用, 其中包括调控细胞的增殖、分化和凋亡.
李淑德, 教授, 中国人民解放军第二军医大学长海医院消化内科; 刘海林, 主任医师, 上海交通大学医学院附属第九人民医院消化科
近年随着miRNAs研究的不断深入, 发现大量异常表达的miRNAs通过调控靶基因的表达而调节包括结肠癌在内的多种恶性肿瘤的发生发展, 大规模的筛选肿瘤发生发展过程中异常表达的miRNAs将为人们全面认识肿瘤的生物学特性发挥重要作用, 也为结肠癌的早期诊治提供了新的希望.
研究报道miR-30d在前列腺癌、成神经管细胞瘤以及肝癌等恶性肿瘤中表达上调. 过表达miR-30d的表达可以促进在肝癌细胞中的发生发展, 然而miR-30d在结肠癌中的表达及功能研究尚未见报道.
本研究首次检测miR-30d在结肠癌中呈过表达, 同时发现miR-30d在结肠癌细胞的生长中发挥着非常重要的作用.
miR-30d在调控结肠癌细胞的增殖和凋亡方面发挥重要作用, 其很可能成为一个结肠癌新的癌前标志物, 为结肠癌临床基因治疗提供新的靶点.
反义寡核酸: 人工合成的, 与靶基因或mRNA某一区段互补的核酸片断, 可以通过碱基互补原则结合于靶基因/mRNA上, 从而封闭基因的表达.
本文检测miR-30d mRNA在结肠癌组织中的表达, miR-30d反义核苷酸对结肠癌细胞增殖及凋亡的影响, 对结肠癌的治疗有重要理论指导意义.
编辑:田滢 电编:闫晋利
| 1. | Raisch J, Darfeuille-Michaud A, Nguyen HT. Role of microRNAs in the immune system, inflammation and cancer. World J Gastroenterol. 2013;19:2985-2996. [PubMed] [DOI] |
| 2. | Soga D, Yoshiba S, Shiogama S, Miyazaki H, Kondo S, Shintani S. microRNA expression profiles in oral squamous cell carcinoma. Oncol Rep. 2013;30:579-583. [PubMed] [DOI] |
| 3. | Luo W, Nie Q, Zhang X. MicroRNAs involved in skeletal muscle differentiation. J Genet Genomics. 2013;40:107-116. [PubMed] [DOI] |
| 4. | Sayed D, Abdellatif M. MicroRNAs in development and disease. Physiol Rev. 2011;91:827-887. [PubMed] [DOI] |
| 5. | Croce CM. Causes and consequences of microRNA dysregulation in cancer. Nat Rev Genet. 2009;10:704-714. [PubMed] [DOI] |
| 6. | Munker R, Calin GA. MicroRNA profiling in cancer. Clin Sci (Lond). 2011;121:141-158. [PubMed] [DOI] |
| 7. | Vejnar CE, Blum M, Zdobnov EM. miRmap web: comprehensive microRNA target prediction online. Nucleic Acids Res. 2013;41:W165-W168. [PubMed] [DOI] |
| 8. | Yu DC, Li QG, Ding XW, Ding YT. Circulating MicroRNAs: Potential Biomarkers for Cancer. Int J Mol Sci. 2011;12:2055-2063. [PubMed] [DOI] |
| 9. | Wu C, Jin B, Chen L, Zhuo D, Zhang Z, Gong K, Mao Z. MiR-30d induces apoptosis and is regulated by the Akt/FOXO pathway in renal cell carcinoma. Cell Signal. 2013;25:1212-1221. [PubMed] [DOI] |
| 10. | Kobayashi N, Uemura H, Nagahama K, Okudela K, Furuya M, Ino Y, Ito Y, Hirano H, Inayama Y, Aoki I. Identification of miR-30d as a novel prognostic maker of prostate cancer. Oncotarget. 2012;3:1455-1471. [PubMed] |
| 11. | Yao J, Liang L, Huang S, Ding J, Tan N, Zhao Y, Yan M, Ge C, Zhang Z, Chen T. MicroRNA-30d promotes tumor invasion and metastasis by targeting Galphai2 in hepatocellular carcinoma. Hepatology. 2010;51:846-856. [PubMed] [DOI] |
| 12. | Sarver AL, French AJ, Borralho PM, Thayanithy V, Oberg AL, Silverstein KA, Morlan BW, Riska SM, Boardman LA, Cunningham JM. Human colon cancer profiles show differential microRNA expression depending on mismatch repair status and are characteristic of undifferentiated proliferative states. BMC Cancer. 2009;9:401. [PubMed] [DOI] |
| 13. | Marchi S, Pinton P. Mitochondrial calcium uniporter, MiRNA and cancer: Live and let die. Commun Integr Biol. 2013;6:e23818. [PubMed] [DOI] |
| 14. | Yi B, Piazza GA, Su X, Xi Y. MicroRNA and cancer chemoprevention. Cancer Prev Res (Phila). 2013;6:401-409. [PubMed] [DOI] |
| 15. | Harquail J, Benzina S, Robichaud GA. MicroRNAs and breast cancer malignancy: an overview of miRNA-regulated cancer processes leading to metastasis. Cancer Biomark. 2012;11:269-280. [PubMed] |
| 16. | Jemal A, Siegel R, Ward E, Murray T, Xu JQ, Thum MJ. Cancer statistics 2007. CA Cancer J Clin. 2007;57:43-66. [PubMed] [DOI] |
| 17. | Sameer AS. Colorectal cancer: molecular mutations and polymorphisms. Front Oncol. 2013;3:114. [PubMed] [DOI] |
| 18. | Wu Q, Shi Y, Chen L, Xiao X, Dai G. Effect and safety of bevacizumab-containing chemotherapy treatment in Chinese patients with metastatic colorectal cancer. Onco Targets Ther. 2013;6:485-490. [PubMed] [DOI] |
| 19. | Mohan HM, Evans MD, Larkin JO, Beynon J, Winter DC. Multivisceral Resection in Colorectal Cancer: A Systematic Review. Ann Surg Oncol. 2013; May 11. [Epub ahead of print]. [PubMed] [DOI] |
| 20. | Gomez D, De Rosa A, Addison A, Brooks A, Malik HZ, Cameron IC. Cetuximab therapy in the treatment of metastatic colorectal cancer: The future frontier? Int J Surg. 2013;11:507-513. [PubMed] [DOI] |
| 21. | Voorham QJ, Rondagh EJ, Knol DL, van Engeland M, Carvalho B, Meijer GA, Sanduleanu S. Tracking the molecular features of nonpolypoid colorectal neoplasms: a systematic review and meta-analysis. Am J Gastroenterol. 2013;108:1042-1056. [PubMed] [DOI] |
| 22. | Serra-Sutton V, Serrano CB, Carreras ME. Quality indicators to assess a colorectal cancer prevention program. Int J Technol Assess Health Care. 2013;29:166-173. [PubMed] [DOI] |
| 23. | Di Lena M, Travaglio E, Altomare DF. New strategies for colorectal cancer screening. World J Gastroenterol. 2013;19:1855-1860. [PubMed] [DOI] |
| 24. | Johnson CM, Wei C, Ensor JE, Smolenski DJ, Amos CI, Levin B, Berry DA. Meta-analyses of colorectal cancer risk factors. Cancer Causes Control. 2013;24:1207-1222. [PubMed] [DOI] |
| 25. | Xiang H, Wang Y, Nie S. Meta-analysis of the association between insulin-like growth factor binding protein 3 genetic polymorphisms and colorectal cancer susceptibility. PLoS One. 2013;8:e59665. [PubMed] [DOI] |
| 26. | Tanis PJ, Doeksen A, van Lanschot JJ. Intentionally curative treatment of locally recurrent rectal cancer: a systematic review. Can J Surg. 2013;56:135-144. [PubMed] [DOI] |
| 27. | Yang TX, Morris DL, Chua TC. Pelvic exenteration for rectal cancer: a systematic review. Dis Colon Rectum. 2013;56:519-531. [PubMed] [DOI] |
| 28. | Nielsen TO, Sorensen S, Dagnæs-Hansen F, Kjems J, Sorensen BS. Directing HER4 mRNA expression towards the CYT2 isoform by antisense oligonucleotide decreases growth of breast cancer cells in vitro and in vivo. Br J Cancer. 2013;108:2291-2298. [PubMed] [DOI] |
| 29. | Mitrpant C, Porensky P, Zhou H, Price L, Muntoni F, Fletcher S, Wilton SD, Burghes AH. Improved antisense oligonucleotide design to suppress aberrant SMN2 gene transcript processing: towards a treatment for spinal muscular atrophy. PLoS One. 2013;8:e62114. [PubMed] [DOI] |
| 30. | Sypniewski D, Bednarek I, Gałka S, Loch T, Błaszczyk D, Sołtysik D. Cytotoxicity of etoposide in cancer cell lines in vitro after BCL-2 and C-RAF gene silencing with antisense oligonucleotides. Acta Pol Pharm. 2013;70:87-97. [PubMed] |