修回日期: 2013-05-29
接受日期: 2013-06-05
在线出版日期: 2013-07-28
目的: 建立适合慢性胃炎相关微小病毒增殖的细胞培养体系, 并鉴定该病毒的类型.
方法: 制备人胃腺癌SGC-7901传代细胞, 对微小病毒进行传代培养, 并使用倒置显微镜和透射电镜观察; 使用输血传播病毒(transfusion transmitted virus, TTV)病毒、人细小病毒B19引物扩增微小病毒模板DNA.
结果: 盲传3代后, 微小病毒即可在SGC-7901细胞上传代增殖, 并产生明显的细胞病变; 透射电镜结果显示, 微小病毒在细胞核和胞质内均有分布, 病毒呈球形, 直径20 nm左右; PCR结果显示, 微小病毒标本显示为TTV病毒DNA阳性.
结论: SGC-7901细胞可以作为微小病毒体外增殖培养体系, 微小病毒属于TTV病毒科成员.
核心提示: 本试验在慢性胃炎患者的组织标本中检测到输血传播病毒(transfusion transmitted virus, TTV)病毒核酸, 证实了TTV病毒可以在人胃黏膜层细胞进行定殖, 使用人胃腺癌SGC-7901传代细胞成功增殖了该病毒, 建立了该病毒的体外培养体系, 使用电子显微镜技术在受感染细胞中成功观察到TTV子代病毒.
引文著录: 张娜, 刘学芳, 李建国. 人慢性胃炎相关TTV病毒的体外培养与鉴定. 世界华人消化杂志 2013; 21(21): 2091-2095
Revised: May 29, 2013
Accepted: June 5, 2013
Published online: July 28, 2013
AIM: To develop a suitable proliferative cell culture system for chronic gastritis-related tiny virus, and to identify the type of this virus.
METHODS: The gastric adenocarcinoma cell line SGC-7901 was used to culture the tiny virus, and cells were observed by inverted microscopy and transmission electron microscopy (TEM). The primers for transfusion transmitted virus (TTV) and human parvovirus B19 were used to amplify DNA from the tiny virus.
RESULTS: After three blind passages in SGC-7901 cells, the tiny virus could proliferate in vitro and produce obvious CPE. TEM analysis showed that TTV was distributed in the nucleus and cytoplasm. The virions were globular, approximately 20 nm in size. PCR analysis showed that the tiny virus specimens were TTV DNA amplification-positive.
CONCLUSION: SGC-7901 cells can be used as a proliferation system for tiny virus. The tiny virus and TTV virus belong to the same genus.
- Citation: Zhang N, Liu XF, Li JG. Culture and identification of TTV virus associated with human chronic gastritis. Shijie Huaren Xiaohua Zazhi 2013; 21(21): 2091-2095
- URL: https://www.wjgnet.com/1009-3079/full/v21/i21/2091.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i21.2091
2008-07河南中医学院教授李建国等从慢性浅表性胃炎、慢性萎缩性胃炎和胃腺癌患者胃黏膜上皮细胞中观察到一种微小病毒感染(暂名为微小病毒), 初步研究显示, 该病毒直径较小(22.18-22.63 nm), 在细胞浆和细胞核内均可复制, 形态学表现不同于人类非洲淋巴细胞瘤病毒(Epstein-Barr virus, EBV)、人乳头瘤病毒(human papilloma virus, HPV)、乙型肝炎病毒(hepatitis B virus, HBV)以及人类免疫缺陷综合症病毒(human immunodeficiency virus, HIV)病毒[1]. 为了确定该病原, 我们采用人细小病毒B19和输血传播病毒(transfusion transmitted virus, TTV)的引物进行检测, 同时将病料同步接种于人胃腺癌细胞进行病毒培养, 为进一步的研究提供病毒培养手段.
微小病毒组织标本由河南中医学院病理实验中心在液氮中保存. 人胃腺癌细胞SGC-7901, 由河南中医学院细胞培养室液氮保存. 细胞DNA抽提试剂盒购自百泰克; PCR反应试剂盒购自天根生物; MEM培养液购自GIBCO; 胎牛血清购自民海血清; 胰酶购自索来宝生物; 引物合成由Invitrogen公司完成, 引物序列如下: 引物1(TTV病毒)上游引物: 5'-GCT ACG TCA CTA ACC ACG TG-3'; 下游引物: 5'-CTB CGG TGT GTA AAC TCA CC-3')[2]; 引物2(人细小病毒B19)上游引物: 5'-ATA AAT CCA TAT ACT CAT T-3'; 下游引物: 5'-CTA AAG TAT CCT GAC CTT G-3')[3].
1.2.1 样品制备: 用灭菌的磷酸盐缓冲液(PBS)分别将病料清洗干净, 剪碎, 按1:5(W/V)的比例加入pH 7.4的PBS进行研磨, 充分混匀, 反复冻融3次后, 再加入青霉素1000 U/mL, 链霉素1000 μg/mL. 置4 ℃冰箱过夜, 翌日5000 r/min离心20 min, 吸取上清液, 无菌检验合格后, 备用.
1.2.2 病毒接种与培养: 将长满单层传代细胞, 用少量PBS液洗涤两次, 取上述病料接种细胞, 接毒量与维持液的比例为1:5-1:10, 置37 ℃ 5%CO2细胞培养箱中吸附1 h, 再加入维持液(含2%犊牛血清的MEM营养液), 同时设正常对照细胞. 置37 ℃培养, 逐日在镜下观察, 若无细胞病变(cytopathic effect, CPE), 培养5 d收获进行盲传, 若出现细胞病变, 当出现80%细胞病变时收获, 连续传至第8代, 同时设未接毒细胞作为对照[4].
1.2.3 透射电镜观察: 当CPE达80%时收集细胞毒, 将细胞从细胞瓶中轻轻刮下, 4 ℃ 3000 r/min离心10 min, 取出细胞团, 包埋于2%的低熔点琼脂糖内, 按照文献方法进行电镜样品制备, 步骤如下: (1)固定: 将细胞团浸入25 mL/L戊二醛溶液中, 4 ℃固定2 h以上; (2)洗涤: 将细胞团取出使用磷酸盐缓冲液洗涤3次, 每次15 min; (3)后固定: 将细胞团浸入20 mL/L锇酸溶液中, 4 ℃固定2 h; (4)洗涤: 将细胞团取出使用磷酸盐缓冲液洗涤3次, 每次15 min; (5)脱水: 依次使用30%丙酮、50%丙酮、70%(加醋酸铀)丙酮、80%丙酮对细胞样品脱水, 每次5 min; (6)置换、浸透和包埋: 将细胞团包埋入环氧树脂中; (7)切片和染色: 细胞样品切片, 厚度为80 nm左右, 使用醋酸铀和柠檬酸铅双染. 细胞样品制备完毕后, 使用奥林巴斯透射电镜进行观察.
1.2.4 PCR鉴定: 取制备的病毒样品, 按照DNA抽提试剂盒的步骤提取总DNA, 分别使用2对引物进行PCR反应, 反应体系为20 μL, 其中含上、下游引物各0.2 μmol/L、DNA模板5 μL, PCR mix 10 μL, 加水至20 μL, 瞬时离心. 引物1反应条件[2]: 95 ℃预变性10 min、94 ℃变性20 s、60 ℃退火20 s、72 ℃延伸30 s, 共55个循环, 最后72 ℃延伸5 min. 引物2反应条件[3]: 95 ℃预变性10 min、94 ℃变性2 min、37 ℃退火2 min、72 ℃延伸3 min, 共55个循环, 最后72 ℃延伸5 min. 配制1%琼脂糖凝胶, 每孔加样5 μL, 设定标准DNA Marker, 100V电泳30-40 min, 然后在凝胶成像系统中记录条带.
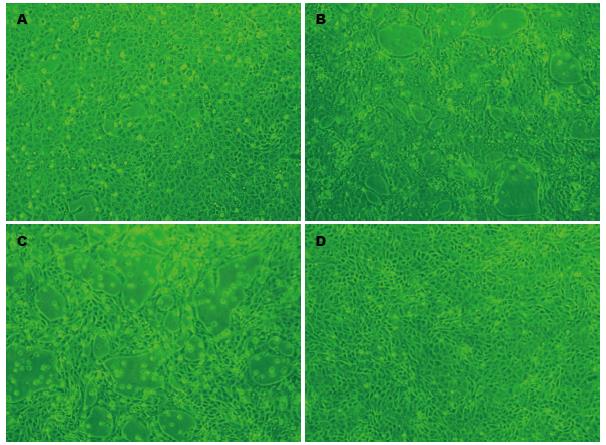
胃腺癌细胞首次接种病毒后, 96 h内细胞病变不典型, 仅出现细胞圆缩, 折光性增强、悬浮细胞增多等变化, 盲传3代后, 细胞病变稳定, 更加典型, 接毒后24-48 h细胞出现变圆、皱缩、脱落、形成小噬斑(图1A); 48-72 h, 脱落细胞数量明显增多, 形成较大噬斑(图1B); 至96 h时细胞病变比例高达80%以上(图1C). 同时对照组细胞贴壁生长, 呈多边形外观, 细胞胞质清亮, 细胞界限明显, 培养96 h不出现细胞病变(图1D).
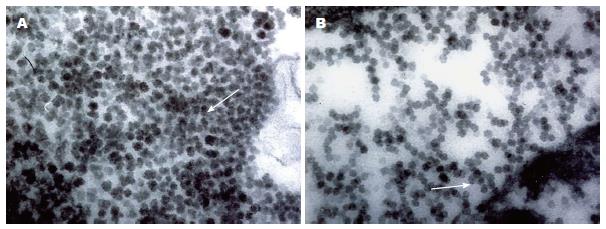
在感染SGC-7901细胞的胞浆和细胞核均观察到大量新生的病毒粒子, 病毒呈现致密球形外观, 直径20 nm左右, 无囊膜, 在胞浆内呈聚集分布, 如图2A箭头所示; 病毒也在细胞核内复制, 并且以串珠状的形式向核外进行扩散, 如图2B左侧箭头所示.
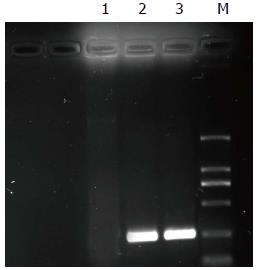
如图3所示, 引物1扩增结果阳性, 条带大小为198 bp, 与报道结果一致, 引物2扩增结果阴性, PCR检测结果显示微小病毒标本TTV病毒DNA检测阳性.
慢性胃炎是临床较为常见的一种消化系统疾病, 与消化性溃疡、胃癌和淋巴癌等有密切的相关性, 根据病理表现又进一步分为慢性浅表性胃炎和慢性萎缩性胃炎. 许多因素都与慢性胃炎有关, 如幽门螺杆菌菌感染[5]、EB病毒感染[6]、压力情绪、胆汁回流、酗酒甚至环境因素等. 本次试验中检测的标本均为幽门螺杆菌、EB病毒感染阴性[1].
TTV是细项圈病毒属(Anellovirus)主要成员之一[7], 1997年首次报道于日本, 随后多个国家的学者在肝炎患者体内均分离出TTV病毒, 确定该病毒在世界范围内流行[8,9]. TTV病毒是一种环状、单股、负链DNA病毒, 病毒基因组全长3739-3853 bp, 无囊膜, 氯化铯中的浮密度1.31-1.35 g/cm3, 病毒直径20 nm左右[10], 与本试验中微小病毒大小基本一致. 由于TTV病毒本身体积小, 在环境中的抵抗力强, 并且能够通过消化道传播, 具有在自然界中广泛存在, 流行无明显的季节性的特点. 在健康人群中具有较高的感染率, 但发病率较低, 临床表现为非甲-庚型肝炎[11,12]. 急性肝炎期, TTV弥漫分布于肝小叶内, 慢性肝炎则主要分布于汇管附近, 所以一般认为TTV为一种嗜肝病毒[13]. 我国学者骆抗先报道了一种新型肠传性病毒性肝炎, 患者临床症状轻微, 病理学表现为肝脏汇管区炎症, 作者使用TTV病毒的引物成功检测到血清和粪便中的病毒核酸[14]. 2009年英国学者Braham等[15]对胃肠炎患者的粪便样品进行病毒浓缩和纯化, 然后使用序列非依赖性单引物扩增法进行扩增, 结果显示通过基因移动(genome walking)的方法可以获得TTV病毒的全基因序列3260 bp. 2011年巴西学者Pinho-Nascimento等[16]对135例巴西胃肠炎患者的粪便样品进行TTV病毒DNA检测, 结果显示样品阳性率高达91.1%. 多项实验结果显示TTV病毒可经粪-口途径进行传播, 本试试验使用TTV病毒引物检测慢性浅表性胃炎患者的组织标本, PCR结果显示, 组织标本为TTV病毒DNA阳性, 证实了TTV病毒在人胃黏膜上皮细胞内存在, 并且在临床上表现出与慢性胃炎的相关性.
病毒的体外培养是研究病毒相关特性的基础, 本次试验采用的是胃腺癌细胞进行病毒增殖, 盲传3代后, 并取得了良好的增殖效果. 在前期试验过程中, 我们采用了人胃黏膜上皮细胞进行病毒增殖, 但效果不理想, TTV病毒表现出对人胃腺癌细胞的偏爱性. 我们使用电镜观察的方法在F3代细胞毒中观察到了TTV病毒粒子, 说明此时的病毒已经适应在胃腺癌细胞中增殖, 此外, 我们对该病毒的病原特性实验、超微结构观察以及基因组分析等相关工作正在进行.
输血传播病毒(transfusion transmitted virus, TTV), 1997年, 由日本学者首次报道, 认为是一种与输血后肝炎相关的病原, 现在世界范围内流行, 在健康人群中具有较高的感染率, 但发病率较低, 临床表现为非甲-庚型肝炎, 近期TTV病毒DNA也在胃肠炎患者的血清和粪便中相继检出, 证实其存在粪口传播的途径, 临床上表现与胃肠炎的相关性.
马欣, 主任医师, 甘肃省人民医院消化科
TTV病毒的感染与人类疾病的联系, 一直是学者们争论的重点内容, 尽管TTV病毒感染在肝病中的作用仍然存在争论, 但是TTV病毒最早是一种新型肝炎病毒的候选病毒. 自TTV在首次在各类肝炎患者中被确诊以来, 之后在肝癌、传染性胃肠炎、女性生殖系统疾病、输血性传播疾病以及结肠癌等多种疾病患者中均检测到TTV病毒的高感染率, 使其成为值得我们关注一种病原.
近期关于TTV病毒在胃肠炎患者体内分离的文献较多, 如2009年英国学者Braham等对胃肠炎患者的粪便样品进行病毒浓缩和纯化, 获得TTV病毒的全基因序列. 2011年巴西学者Pinho-Nascimento对135名巴西胃肠炎患者的粪便样品进行TTV病毒DNA检测, 结果显示样品阳性率高达91.1%, 本文参考相关文献, 设计了针对TTV病毒的特异性引物, 对慢性胃炎患者的组织标本检测, 结果呈阳性.
本试验使用PCR检测法检测慢性胃炎患者的组织标本, 结果显示TTV病毒核酸阳性, 证实了TTV病毒在感染者胃粘膜组织内存在, 此外, 本试验采用病毒在人胃腺癌SGC-7901传代细胞上传代的方法, 成功增殖了该病毒, 获得了适应体外培养的毒株.
本文整体阐述条理分明, 有系统的理论分析和有价值的科学结论. 文章的科学性、创新性和可读性能较好地反映我国或国际胃肠病学临床和基础研究的先进水平.
编辑:田滢 电编:鲁亚静
| 2. | Abe K, Inami T, Asano K, Miyoshi C, Masaki N, Hayashi S, Ishikawa Ki, Takebe Y, Win KM, El-Zayadi AR, Han KH, Zhang DY. TT virus infection is widespread in the general populations from different geographic regions. J Clin Microbiol. 1999;37:2703-2705. [PubMed] |
| 3. | Koch WC, Adler SP. Detection of human parvovirus B19 DNA by using the polymerase chain reaction. J Clin Microbiol. 1990;28:65-69. [PubMed] |
| 4. | 傅 继华, 张 静, 李 文, 尹 爱红, 黄 涛, 王 少军, 王 玫, 王 晓云, 赵 明远, 康 殿民. 病毒学实用实验技术. 第1版. 济南: 山东科学技术出版社 2001; 50-80. |
| 5. | Enomoto S, Oka M, Ohata H, Mukoubayashi C, Watanabe M, Moribata K, Muraki Y, Shingaki N, Deguchi H, Ueda K. Assessment of gastroesophageal reflux disease by serodiagnosis of Helicobacter pylori-related chronic gastritis stage. World J Gastrointest Endosc. 2011;3:71-77. [PubMed] [DOI] |
| 6. | Hisamatsu A, Nagai T, Okawara H, Nakashima H, Tasaki T, Nakagawa Y, Hashinaga M, Kai S, Yokoyama S, Murakami K. Gastritis associated with Epstein-Barr virus infection. Intern Med. 2010;49:2101-2105. [PubMed] [DOI] |
| 7. | Biagini P. Classification of TTV and related viruses (anelloviruses). Curr Top Microbiol Immunol. 2009;331:21-33. [PubMed] [DOI] |
| 8. | Hino S, Miyata H. Torque teno virus (TTV): current status. Rev Med Virol. 2007;17:45-57. [PubMed] [DOI] |
| 9. | Nishizawa T, Okamoto H, Konishi K, Yoshizawa H, Miyakawa Y, Mayumi M. A novel DNA virus (TTV) associated with elevated transaminase levels in posttransfusion hepatitis of unknown etiology. Biochem Biophys Res Commun. 1997;241:92-97. [PubMed] [DOI] |
| 10. | Mushahwar IK, Erker JC, Muerhoff AS, Leary TP, Simons JN, Birkenmeyer LG, Chalmers ML, Pilot-Matias TJ, Dexai SM. Molecular and biophysical characterization of TT virus: evidence for a new virus family infecting humans. Proc Natl Acad Sci U S A. 1999;96:3177-3182. [PubMed] [DOI] |
| 11. | Okamoto H, Akahane Y, Ukita M, Fukuda M, Tsuda F, Miyakawa Y, Mayumi M. Fecal excretion of a nonenveloped DNA virus (TTV) associated with posttransfusion non-A-G hepatitis. J Med Virol. 1998;56:128-132. [PubMed] [DOI] |
| 12. | Asim M, Singla R, Gupta RK, Kar P. Clinical & amp; molecular characterization of human TT virus in different liver diseases. Indian J Med Res. 2010;131:545-554. [PubMed] |
| 14. | 骆 抗先, 章 廉, 王 珊珊, 聂 军, 葛 娅, 陈 志英, 俞 守义, 刘 银燕, 杨 守昌, 梁 蔚芳. 一种新型肠传性病毒性肝炎的流行病学、临床、病理和病毒学的初步研究. 第一军医大学学报. 1998;18:87-90. |
| 15. | Braham S, Iturriza-Gómara M, Gray J. Detection of TT virus by single-primer sequence-independent amplification in multiple samples collected from an outbreak of gastroenteritis. Arch Virol. 2009;154:981-985. [PubMed] [DOI] |
| 16. | Pinho-Nascimento CA, Leite JP, Niel C, Diniz-Mendes L. Torque teno virus in fecal samples of patients with gastroenteritis: prevalence, genogroups distribution, and viral load. J Med Virol. 2011;83:1107-1111. [PubMed] [DOI] |