修回日期: 2013-06-08
接受日期: 2013-07-03
在线出版日期: 2013-07-28
目的: 探讨RASSF1A与CyclinA2在肝内胆管细胞癌(intrahepatic cholangiocarcinoma, ICC)的表达情况、与临床生物学行为的关系及二者的相关性.
方法: 收集2010-01/2011-09华中科技大学同济医学院附属协和医院肝胆外科中心手术切除的30例ICC组织与18例癌旁组织, 利用免疫组织化学两步法, 检测RASSF1A与CyclinA2分别在上述组织中的表达, 并分析其表达的意义及相关性.
结果: RASSF1A在ICC组织中的表达明显低于癌旁组织中的表达, 其在ICC组织中阳性表达率为36.67%(11/30), 在癌旁组织中阳性表达率为83.33%(15/18)(P<0.05); CyclinA2在ICC组织中的表达明显高于癌旁组织中的表达, 其在ICC组织中阳性表达率为73.33%(22/30), 在癌旁组织中阳性表达率为11.11%(2/18)(P<0.05); RASSF1A失活与CyclinA2高表达在ICC的发生过程具有相关性(P<0.01, r = 0.54).
结论: RASSF1A基因与CyclinA2蛋白可能参与ICC的发生发展过程, RASSF1A基因失活可能参与ICC的浸润转移过程, 且二者的作用机制可能存在一定的相关性.
核心提示: 本研究表明RASSF1A的失活参与了肝内胆管细胞癌(intrahepatic cholangiocarcinoma, ICC)的发生, 其作用机制可能与细胞周期蛋白A2(CyclinA2)有紧密的相关性. 而且发现RASSF1A失活的ICC患者更易发生淋巴结的转移, 临床分期也较晚, 可能预示着预后不良.
引文著录: 吴军卫, 李潼, 李锦锦, 孟元普, 柴新群. RASSF1A与CyclinA2在肝内胆管细胞癌中的表达与相关性. 世界华人消化杂志 2013; 21(21): 2038-2044
Revised: June 8, 2013
Accepted: July 3, 2013
Published online: July 28, 2013
AIM: To detect the expression of RASSF1A and CyclinA2 in intrahepatic cholangiocarcinoma (ICC) and to analyze their relationship with the biological behavior of ICC.
METHODS: Thirty ICC specimens and 18 tumor-adjacent tissue specimens were collected from January 2010 to September 2011 in Department of Hepatobiliary Surgery, Union Hospital, Tongji Medical College, Huazhong University of Science and Technology. The expression of RASSF1A and CyclinA2 in these specimens was detected by immunohistochemistry. The relationship between the expression of RASSF1A and CyclinA2 and clinicopathologic parameters of ICC was then analyzed.
RESULTS: The positive rate of expression of RASSF1A in ICC was significantly lower than that in tumor-adjacent tissue (36.67% vs 83.33%, P < 0.05), while the positive rate of expression of Cyclin A2 in ICC was significantly higher than that in tumor-adjacent tissue (73.33% vs 11.11%, P < 0.05). There was a negative correlation between the expression of RASSF1A and that of Cyclin A2 in ICC (P < 0.01, r = 0.54).
CONCLUSION: RASSF1A and CyclinA2 may be involved in the occurrence and development of ICC. Inactivation of RASSF1A may contribute to the invasion and metastasis of ICC. CyclinA2 may play a significant role in the tumor inhibition mechanism mediated by RASSF1A.
- Citation: Wu JW, Li T, Li JJ, Meng YP, Chai XQ. Expression of RASSF1A and Cyclin A2 in intrahepatic cholangiocarcinoma. Shijie Huaren Xiaohua Zazhi 2013; 21(21): 2038-2044
- URL: https://www.wjgnet.com/1009-3079/full/v21/i21/2038.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i21.2038
肝内胆管细胞癌(intrahepatic cholangiocarcinoma, ICC)是指发生于二级胆管以上的末梢侧肝内小胆管的胆管细胞癌, 起源于肝内胆管上皮细胞, 约占胆管细胞癌的5%-20%[1]. 与肝细胞肝癌(hepatocellular carcinoma, HCC)相比, ICC更容易发生早期淋巴结转移与术后复发[2]. 但是其与肝门胆管癌(hilar cholangiocarcinoma)相比也有不同[3], 肝门胆管癌比ICC更容易侵犯周围神经及淋巴结[1]. 近30年来, 在全世界范围内, 有数据表明: ICC的发病率和死亡率呈不断上升趋势[4,5]. RASSF1A是一个新型的抑癌基因, 其失活可以导致多种恶性肿瘤的发生, 其失活方式以启动子甲基化最为常见. RASSF1A作为抑癌基因, 可通过多种不同的途径发挥作用, 包括促进细胞凋亡、调节染色体和微管的稳定性和调控细胞周期等. 本文主要探讨RASSF1A基因与细胞周期蛋白A2(CyclinA2)在ICC组织与癌旁组织中的表达与临床意义, 并分析RASSF1A发挥抑癌作用是否同CyclinA2具有相关性.
收集华中科技大学同济医学附属协和医院肝胆外科2010-01/2011-09手术切除的ICC标本30例及癌旁组织18例, 所有标本的患者术前均未经过化疗和其他抗肿瘤治疗. 其中男性15例, 女性15例; 有血管癌栓者5例, 无癌栓者25例; 高、中分化胆管细胞癌20例, 低分化胆管细胞癌10例; 有淋巴结转移者11例, 无淋巴结转移者19例; 周围脏器转移者6例, 无转移者24例; Nathan分期[6]Ⅰ期、Ⅱ期17例, Ⅲ期、Ⅳ期13例. 所有组织均经脱水、石蜡包埋、4 μm连续切片后进行实验. RASSF1A兔抗人多克隆抗体、CyclinA2兔抗人多克隆抗体均购自北京博奥森生物公司, 即用型SV两步法试剂盒、DAB显色液均购自武汉博士德公司.
采用SV(Super Vision)免疫组织化学两步法的方法分别检测ICC组织和癌旁组织中的RASSF1A和CyclinA2的表达, 具体步骤严格按照说明书上进行. 兔抗人RASSF1A一抗及CyclinA2一抗的工作浓度均为1:100, RASSF1A和CyclinA2均用已知的正常乳腺组织阳性切片作为阳性对照; 用0.01 mol/L PBS(pH7.4)代替RASSF1A和CyclinA2的一抗做阴性对照. 判断标准: RASSF1A染色阳性主要定位于细胞质, CyclinA2染色阳性主要定位于细胞核. 用Mattern积分法[7]染色指数评定染色结果: 阳性细胞百分率: 每例标本中, 随机选择10个含有阳性细胞的高倍视野(×400), 每个视野计数100个肿瘤细胞, 取染色阳性细胞数的平均值计算阳性细胞百分率. 无阳性细胞定为0; 阳性细胞≤25%定为1; 阳性细胞≤50%定为2; 阳性细胞>50%定为3. 染色强度: 阴性定为0; 浅黄色定为1; 深黄色定为2; 棕黄色定为3. 以染色强度和阳性细胞百分率之和为染色指数, 0为最小值, 6为最大值. 染色阳性定为阳性表达指数>3, 染色阴性定为阳性表达指数≤3.
统计学处理 所有数据采用SPSS15.0进行统计学分析, 两组组间率的比较用χ2检验, 相关性比较用配对χ2检验, 看其是否具有一致性, 按α = 0.05检验标准, P<0.05为差异具有统计学意义.
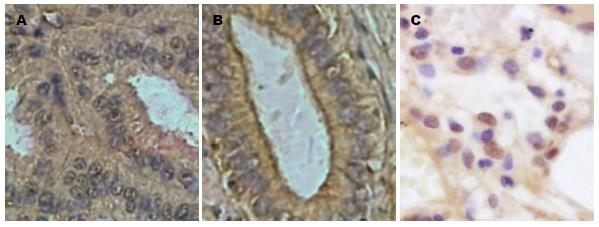
RASSF1A蛋白定位处染色呈棕黄或棕褐色, 主要表达于细胞质中, 细胞核中也有少量表达(图1A, B). 在18例癌旁组织中, RASSF1A阳性表达率为83.33%(15/18); 在30例ICC组织中, 其阳性表达率为36.67%(11/30), 二者结果比较差异具有统计学意义(P<0.05, 表1).
| 组织类型 | n | 阳性(n) | 阴性(n) | 阳性率(%) | χ2值 | P值 |
| 肝内胆管癌 | 30 | 11 | 19 | 36.67 | ||
| 癌旁组织 | 18 | 15 | 3 | 83.33 | 9.869 | 0.002 |
在30例ICC患者中, RASSF1A的表达与年龄、性别、CA199水平、有无血管癌栓等无相关性(P>0.05). 而与有无周围脏器转移、胆管癌分化程度、有无淋巴结转移、Nathan分期有关(P<0.05, 表2).
| 病理资料 | n | 阳性(n) | 阴性(n) | 阳性率(%) | χ2值 | P值 |
| 年龄(岁) | 0.287 | >0.05 | ||||
| <60 | 20 | 8 | 12 | 40.00 | ||
| ≥60 | 10 | 3 | 7 | 30.00 | ||
| 性别 | 1.292 | >0.05 | ||||
| 男 | 15 | 7 | 8 | 46.67 | ||
| 女 | 15 | 4 | 11 | 26.67 | ||
| CA199(U/mL) | 0.578 | >0.05 | ||||
| <100 | 19 | 6 | 13 | 31.58 | ||
| ≥100 | 11 | 5 | 6 | 45.45 | ||
| 周围脏器转移 | 4.342 | <0.05 | ||||
| 有 | 6 | 0 | 6 | 0.00 | ||
| 无 | 24 | 11 | 13 | 45.83 | ||
| 胆管癌分化程度 | 4.593 | <0.05 | ||||
| 高中分化 | 20 | 10 | 10 | 50.00 | ||
| 低分化 | 10 | 1 | 9 | 10.00 | ||
| 有无淋巴结 | 5.687 | <0.05 | ||||
| 有 | 11 | 1 | 10 | 9.09 | ||
| 无 | 19 | 10 | 9 | 52.63 | ||
| 有无血管癌栓 | 0.781 | >0.05 | ||||
| 有 | 5 | 1 | 4 | 20.00 | ||
| 无 | 25 | 10 | 15 | 40.00 | ||
| Nathan分期 | 4.474 | <0.05 | ||||
| Ⅰ-Ⅱ期 | 17 | 9 | 8 | 52.94 | ||
| Ⅲ-Ⅳ期 | 13 | 2 | 11 | 15.38 |
CyclinA2蛋白定位处染色呈棕黄或棕褐色, 主要表达于细胞核中, 细胞质也有少量分布(图1C). 在30例ICC组织中, CyclinA2阳性表达率为73.33%(22/30); 在18例癌旁组织中, 其阳性率为11.11%(2/18), 二者结果比较差异具有统计学意义(P<0.01)(表3).
| 组织类型 | n | 阳性(n) | 阴性(n) | 阳性率(%) | χ2值 | P值 |
| 肝内胆管癌 | 30 | 22 | 8 | 73.33 | ||
| 癌旁组织 | 18 | 2 | 16 | 11.11 | 17.422 | 0.000 |
在30例ICC组织中, RASSF1A失活与CyclinA2高表达的有18例, RASSF1A表达阳性与CyclinA2表达阴性有7例(表4). 经配对χ2检验, 两者比较χ2 = 12.139, P<0.01(表4), 表明RASSF1A失活和CyclinA2高表达在ICC中表达情况一致, 其相关性有统计学意义. 且r = 0.54, 其值>0.5, 表明RASSF1A发挥抑癌作用的过程可能同紧密CyclinA2相关.
| RASSF1A失活 | CyclinA2高表达 | 合计(n) | χ2值 | P值 | |
| 是(n) | 否(n) | ||||
| 是(n) | 18 | 1 | 19 | ||
| 否(n) | 4 | 7 | 11 | ||
| 合计(n) | 22 | 8 | 30 | 12.139 | 0.000 |
2000年, Dammann等[8]利用酵母双杂交筛选方法, 在染色体3p21.3区域克隆出一种新型的Ras因子-RASSF1A. 他属于RASSF1家族(Ras association domain family 1)(RASSF1A-RASSF1H)的一个亚型, 其cDNA全长1873 bp, 编码由340个氨基酸组成的蛋白质, 其表达蛋白的N'末端与一个富含半胱氨酸的甘油二脂/佛波酯(DAG)结合区高度同源, 即蛋白激酶C的保守域1, RASSF1A表达多肽链的氨基酸的第125到138位可能是ATM的磷酸化位点. 很多实验都表明RASSF1A的过量表达可以促进细胞凋亡、细胞周期停滞和减少癌细胞的发生. RASSF1A的减少会导致细胞周期失去控制, 增强基因的不稳定性, 增强细胞的移动性, 抵抗K-ras和肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)诱导的细胞凋亡[9-14]. 目前已有研究者证实RASSF1A失活参与了多种人类肿瘤如肺癌[15,16]、胃癌[17]、贲门癌与食管癌[18]、膀胱癌[19]、肾癌[20]、肝细胞癌[21]、宫颈癌与子宫内膜癌[22]等的发生, 但是目前国内外对RASSF1A与肝内胆管细胞癌关系的研究较少.
在人体内CyclinA2主要表达于人体的胚胎细胞和性腺生殖细胞(如精原细胞、精母细胞等)[23], 也常见于人类肿瘤[24,25], 在DNA合成以及细胞周期G1-S期与G2-M期的转换过程中起重要作用[11]. RASSF1A是否通过CyclinA2发挥抑癌作用一直是研究的热点, 但是其机制也存在诸多争议. Fenton等[26]研究表明RASSF1A可以通过与转录因子p120E4F相互作用而影响G1期的过渡. p120E4F可以通过下调CyclinA2的转录, 导致细胞周期停滞在G1期[27]. RASSF1A可以加强p120E4F抑制CyclinA2的能力并与p120E4F协同诱导细胞周期的停滞[12]. 所以若RASSF1A失活其抑制CyclinA2的能力减弱, 则CyclinA2会显著增多, 进而促进DNA的合成以及加速细胞有丝分裂的进程. 但是有研究表明RASSF1A也可以控制细胞分裂停滞在G2-M期. 2004年Song等[28]报道了RASSF1A通过细胞周期相关蛋白Cdc20抑制后期促进复合物(anaphase-promoting complex, APC), 诱导细胞停滞在G2向M期过渡的前中期. Cdc20可以绑定和激活大分子APC的泛素连接酶, 继而促进细胞周期蛋白CyclinA2和B的泛素化和降解. 与RASSF1A作用后, Cdc20激活APC泛素连接酶的作用被抑制, 因此APC不能降解CyclinA2和B, 稳定的CyclinA2和B会阻止细胞分裂的进行. 失活的RASSF1A导致细胞分裂的加速. 由此可以看出RASSF1A在CyclinA2的调节中的角色是极其复杂的, Fenton等[26]的实验发现RASSF1A的作用是减少CyclinA2蛋白的水平, 但是Song等[28]的实验却表明他可以稳定乃至增加CyclinA2蛋白的水平. 这种矛盾的现象有待于我们进一步研究去证实其发挥作用的真正机制, 本实验的目的之一就是探求RASSF1A同CyclinA2是否存在关联, 亦或是二者是相互独立的因素.
RASSF1A蛋白还是一种微管结合蛋白, 可以通过微管相关蛋白(microtubule-associated proteins, MAPs)与微管相互作用. 有研究表明RASSF1A可以通过调控微管蛋白的动力使其可以控制细胞的运动性和侵袭性. Dallol等[29]通过研究非小细胞肺癌发现过量表达RASSF1A可以抑制癌细胞的迁移, 改变癌细胞的形态. 通过研究敲除RASSF1A基因的鼠胚胎成纤维细胞(mouse embryonic fibroblasts, MEFs)及HeLa细胞的特性, 发现上述类型细胞与细胞之间的粘附力被弱化, 且细胞的变形能力增强, 这与微管分枝扩展增多和张力纤维肌动蛋白的形成有关. 因此, 上述实验表明RASSF1A功能的缺失可能在肿瘤的发生、发展阶段都起作用.
2002年Wong等[30]第一次发现13例肝外胆管癌(extrahepatic cholangiocarcinoma, ECC)中RASSF1A失活的概率为69%, 而且发现RASSF1A失活与ECC的发生、发展存在很大的相关性. Kim等[31]发现RASSF1A启动子甲基化的概率在ECC中高于其癌前病变胆管上皮内瘤变(P<0.05), 在正常胆管上皮、胆管上皮内瘤变、ECC中, 其甲基化的概率是逐渐增加的.
国内Chen等[32]采用RT-PCR方法发现RASSF1A基因与ECC的淋巴结转移、TNM分期相关, 也与其分化程度存在相关性. 他们用DNA甲基转移酶抑制剂5-氮-2-脱氧胞苷(5-Aza-CdR)对人胆管癌细胞株QBC-939进行干预后, 发现5-Aza-CdR能够诱导已经甲基化的RASSF1A基因启动子区域去甲基化, 并通过该机制诱导RASSF1A基因在人胆管癌细胞系QBC-939中重新表达, 这也充分说明了RASSF1A基因与ECC的发生存在很大相关性. 这也为胆管癌的基因治疗开辟一个新的方向, 因为在胆管癌中, RASSF1A基因是完整的, 因为甲基化而休眠, 如果通过对其启动子进行脱甲基化使其重新表达, 这将是一个新的肿瘤治疗方法.
以上研究结果表明, RASSF1A作为一种新型抑癌基因, 其失活与癌症的发生、发展有着必然联系, 与ECC的发生、发展、治疗、预后也息息相关. 但是RASSSF1A怎样通过相关机制调控CyclinA2的表达来调节细胞周期的进程还存在争议; RASSF1A失活与人非小细胞肺癌侵袭性增强有关, 但是其与ICC的侵袭力是否相关尚未见报道; RASSF1A失活与ECC的发生、发展、预后相关已被国内外许多研究证实, 但是其与ICC的关系却罕见报道. 本实验旨在通过研究RASSF1A的失活是否与ICC的发生相关, 若存在相关性其表达与CyclinA2的表达在ICC中是否有关联, 且其失活是否也与ICC侵袭力增强、分期较晚、预后较差相关.
本实验的研究结果表明RASSF1A在ICC和癌旁组织中的阳性表达率分别为36.67%、83.33%, 在癌旁组织中的表达率明显高于癌组织, 其差异具有显著性意义(P<0.05); CyclinA2在ICC和癌旁组织的阳性表达率分别为73.33%、11.11%, 在ICC组织中的表达强于癌旁组织, 其差异同样具有显著性(P<0.05); 而且二者在ICC的表达紧密相关(P<0.01, r = 0.54). 由此可以得出RASSF1A在ICC中的失活率为63.33%, 其在ICC中的表达减弱或消失, 而且发现RASSF1A失活或低表达的ICC组织中常伴有CyclinA2的高表达, 可以推测, 二者之间可能存在抑制表达的机制, RASSF1A发挥抑癌作用的机制可能与CyclinA2增多有关, 这与Fenton等[26]的研究结果相一致.
我们还发现RASSF1A蛋白的表达水平与年龄、性别、CA199水平及有无血管浸润无关, 与肿瘤分化程度、有无周围脏器转移、有无淋巴结转移、Nathan分期有关. 低分化、有淋巴结转移、有周围脏器转移、Nathan分期晚的ICC患者, 其RASSF1A的失活率较高, 提示RASSF1A的表达失活可能与ICC的分化低、侵袭力强及预后较差相关, 这与相关文献报道的结果相一致, 这在以后可能会作为判断胆管癌预后的一个指标.
总之, 在ICC患者中RASSF1A低表达与CyclinA2的高表达同ICC的发生发展相关; RASSF1A的失活可能参与了ICC的浸润转移过程. 进一步的研究需要证实RASSF1A与CyclinA2的作用机制, 及如何利用RASSF1A启动子去甲基化的方法使RASSF1A在人体内重新表达, 从而发挥其抑癌作用, 抑制肿瘤的转移和复发, 并有望为ICC的基因治疗提供一个新的研究方向或
靶点.
RASSF1A是一个新型的抑癌基因, 是属于RASSF1家族(Ras association domain family 1)(RASSF1A-RASSF1H)的一个亚型, 位于染色体3p21.3区域, 编码由340个氨基酸组成的蛋白质. 最先因其在人肺癌中常有纯合型缺失而被发现并被Dammann等克隆出来. 其失活可以导致多种恶性肿瘤的发生, 其失活方式有突变、杂合性缺失、纯合型缺失及启动子甲基化, 其中以启动子甲基化最为常见. RASSF1A作为抑癌基因,可通过多种不同的途径如促进细胞凋亡、调节染色体和微管的稳定性和调控细胞周期等发挥作用.
韩天权, 教授, 上海交通大学医学院附属瑞金医院外科, 上海消化外科研究所
在ICC发生发展过程中, 有许多分子机制参与其中, 但分子生物学研究并未能完全解释其发生发展浸润转移的过程, 故立足于每种细胞因子的体内或体外的研究, 仍有助于去揭示这些细胞因子在ICC发生发展中的作用, 并为今后临床上基因治疗提供新的思路.
国内外对RASSF1A作用研究多集中在肺癌与泌尿系统的肿瘤, 对肝外胆管细胞癌也有报道, 但对其在肝内胆管细胞癌的表达及作用机制则少见报道.
本研究表明ICC患者RASSF1A存在较高的失活率, RASSF1A失活或低表达的ICC组织多伴有CyclinA2的高表达, 二者表达可能存在负相关, 表明二者存在某种调节机制, 这给以后ICC的基因治疗提供了一个新的靶点.
本文研究对象为30例肝内胆管细胞癌和18例癌旁组织, 用免疫组织化学检测方法发现, RASSF1A在肝内胆管癌的表达降低, CyclinA2的表达升高, 并发现两者的表达相关, 具有一定指导意义.
编辑:田滢 电编:鲁亚静
| 1. | Sirica AE. Cholangiocarcinoma: molecular targeting strategies for chemoprevention and therapy. Hepatology. 2005;41:5-15. [PubMed] [DOI] |
| 2. | Yang J, Yan LN. Current status of intrahepatic cholangiocarcinoma. World J Gastroenterol. 2008;14:6289-6297. [PubMed] [DOI] |
| 3. | Berthiaume EP, Wands J. The molecular pathogenesis of cholangiocarcinoma. Semin Liver Dis. 2004;24:127-137. [PubMed] [DOI] |
| 4. | Patel T. Worldwide trends in mortality from biliary tract malignancies. BMC Cancer. 2002;2:10. [PubMed] [DOI] |
| 5. | Khan SA, Thomas HC, Davidson BR, Taylor-Robinson SD. Cholangiocarcinoma. Lancet. 2005;366:1303-1314. [PubMed] [DOI] |
| 6. | Nathan H, Aloia TA, Vauthey JN, Abdalla EK, Zhu AX, Schulick RD, Choti MA, Pawlik TM. A proposed staging system for intrahepatic cholangiocarcinoma. Ann Surg Oncol. 2009;16:14-22. [PubMed] [DOI] |
| 7. | Bittner M, Meltzer P, Chen Y, Jiang Y, Seftor E, Hendrix M, Radmacher M, Simon R, Yakhini Z, Ben-Dor A. Molecular classification of cutaneous malignant melanoma by gene expression profiling. Nature. 2000;406:536-540. [PubMed] [DOI] |
| 8. | Dammann R, Li C, Yoon JH, Chin PL, Bates S, Pfeifer GP. Epigenetic inactivation of a RAS association domain family protein from the lung tumour suppressor locus 3p21.3. Nat Genet. 2000;25:315-319. [PubMed] [DOI] |
| 9. | Vos MD, Martinez A, Elam C, Dallol A, Taylor BJ, Latif F, Clark GJ. A role for the RASSF1A tumor suppressor in the regulation of tubulin polymerization and genomic stability. Cancer Res. 2004;64:4244-4250. [PubMed] [DOI] |
| 10. | Ortiz-Vega S, Khokhlatchev A, Nedwidek M, Zhang XF, Dammann R, Pfeifer GP, Avruch J. The putative tumor suppressor RASSF1A homodimerizes and heterodimerizes with the Ras-GTP binding protein Nore1. Oncogene. 2002;21:1381-1390. [PubMed] [DOI] |
| 11. | Rabizadeh S, Xavier RJ, Ishiguro K, Bernabeortiz J, Lopez-Ilasaca M, Khokhlatchev A, Mollahan P, Pfeifer GP, Avruch J, Seed B. The scaffold protein CNK1 interacts with the tumor suppressor RASSF1A and augments RASSF1A-induced cell death. J Biol Chem. 2004;279:29247-29254. [PubMed] [DOI] |
| 12. | Dallol A, Cooper WN, Al-Mulla F, Agathanggelou A, Maher ER, Latif F. Depletion of the Ras association domain family 1, isoform A-associated novel microtubule-associated protein, C19ORF5/MAP1S, causes mitotic abnormalities. Cancer Res. 2007;67:492-500. [PubMed] [DOI] |
| 13. | Song MS, Chang JS, Song SJ, Yang TH, Lee H, Lim DS. The centrosomal protein RAS association domain family protein 1A (RASSF1A)-binding protein 1 regulates mitotic progression by recruiting RASSF1A to spindle poles. J Biol Chem. 2005;280:3920-3927. [PubMed] [DOI] |
| 14. | Vos MD, Dallol A, Eckfeld K, Allen NP, Donninger H, Hesson LB, Calvisi D, Latif F, Clark GJ. The RASSF1A tumor suppressor activates Bax via MOAP-1. J Biol Chem. 2006;281:4557-4563. [PubMed] [DOI] |
| 15. | Tan S, Sun C, Wei X, Li Y, Wu Y, Yan Z, Feng F, Wang J, Wu Y. Quantitative assessment of lung cancer associated with genes methylation in the peripheral blood. Exp Lung Res. 2013;39:182-190. [PubMed] [DOI] |
| 16. | Ko E, Lee BB, Kim Y, Lee EJ, Cho EY, Han J, Shim YM, Park J, Kim DH. Association of RASSF1A and p63 with poor recurrence-free survival in node-negative stage I-II non-small cell lung cancer. Clin Cancer Res. 2013;19:1204-1212. [PubMed] [DOI] |
| 17. | Zheng-Hao D, Ji-Fang W, De-Sheng X, Jian-Hua Z. Galectin-1 is up-regulated by RASSF1A gene in human gastric carcinoma cell line SGC7901. APMIS. 2012;120:582-590. [PubMed] [DOI] |
| 18. | Zhou SL, Cui J, Fan ZM, Li XM, Li JL, Liu BC, Zhang DY, Liu HY, Zhao XK, Song X. Polymorphism of A133S and promoter hypermethylation in Ras association domain family 1A gene (RASSF1A) is associated with risk of esophageal and gastric cardia cancers in Chinese population from high incidence area in northern China. BMC Cancer. 2013;13:259. [PubMed] [DOI] |
| 19. | Zhong X, Isharwal S, Naples JM, Shiff C, Veltri RW, Shao C, Bosompem KM, Sidransky D, Hoque MO. Hypermethylation of genes detected in urine from Ghanaian adults with bladder pathology associated with Schistosoma haematobium infection. PLoS One. 2013;8:e59089. [PubMed] [DOI] |
| 20. | Kawai Y, Sakano S, Suehiro Y, Okada T, Korenaga Y, Hara T, Naito K, Matsuyama H, Hinoda Y. Methylation level of the RASSF1A promoter is an independent prognostic factor for clear-cell renal cell carcinoma. Ann Oncol. 2010;21:1612-1617. [PubMed] [DOI] |
| 21. | Mohamed NA, Swify EM, Amin NF, Soliman MM, Tag-Eldin LM, Elsherbiny NM. Is serum level of methylated RASSF1A valuable in diagnosing hepatocellular carcinoma in patients with chronic viral hepatitis C? Arab J Gastroenterol. 2012;13:111-115. [PubMed] [DOI] |
| 22. | Kim GE, Kweon SS, Lee JS, Lee JH, Nam JH, Choi C. Quantitative assessment of DNA methylation for the detection of cervical and endometrial adenocarcinomas in liquid-based cytology specimens. Anal Quant Cytol Histol. 2012;34:195-203. [PubMed] |
| 23. | Ravnik SE, Wolgemuth DJ. The developmentally restricted pattern of expression in the male germ line of a murine cyclin A, cyclin A2, suggests roles in both mitotic and meiotic cell cycles. Dev Biol. 1996;173:69-78. [PubMed] [DOI] |
| 24. | Haferlach T, Bacher U, Haferlach C, Kern W, Schnittger S. Insight into the molecular pathogenesis of myeloid malignancies. Curr Opin Hematol. 2007;14:90-97. [PubMed] [DOI] |
| 25. | Schick V, Majores M, Fassunke J, Engels G, Simon M, Elger CE, Becker AJ. Mutational and expression analysis of CDK1, cyclinA2 and cyclinB1 in epilepsy-associated glioneuronal lesions. Neuropathol Appl Neurobiol. 2007;33:152-162. [PubMed] [DOI] |
| 26. | Fenton SL, Dallol A, Agathanggelou A, Hesson L, Ahmed-Choudhury J, Baksh S, Sardet C, Dammann R, Minna JD, Downward J. Identification of the E1A-regulated transcription factor p120 E4F as an interacting partner of the RASSF1A candidate tumor suppressor gene. Cancer Res. 2004;64:102-107. [PubMed] [DOI] |
| 27. | Fajas L, Paul C, Vié A, Estrach S, Medema R, Blanchard JM, Sardet C, Vignais ML. Cyclin A is a mediator of p120E4F-dependent cell cycle arrest in G1. Mol Cell Biol. 2001;21:2956-2966. [PubMed] [DOI] |
| 28. | Song MS, Song SJ, Ayad NG, Chang JS, Lee JH, Hong HK, Lee H, Choi N, Kim J, Kim H. The tumour suppressor RASSF1A regulates mitosis by inhibiting the APC-Cdc20 complex. Nat Cell Biol. 2004;6:129-137. [PubMed] [DOI] |
| 29. | Dallol A, Agathanggelou A, Tommasi S, Pfeifer GP, Maher ER, Latif F. Involvement of the RASSF1A tumor suppressor gene in controlling cell migration. Cancer Res. 2005;65:7653-7659. [PubMed] |
| 30. | Wong N, Li L, Tsang K, Lai PB, To KF, Johnson PJ. Frequent loss of chromosome 3p and hypermethylation of RASSF1A in cholangiocarcinoma. J Hepatol. 2002;37:633-639. [PubMed] [DOI] |
| 31. | Kim BH, Cho NY, Shin SH, Kwon HJ, Jang JJ, Kang GH. CpG island hypermethylation and repetitive DNA hypomethylation in premalignant lesion of extrahepatic cholangiocarcinoma. Virchows Arch. 2009;455:343-351. [PubMed] [DOI] |
| 32. | Chen YJ, Tang QB, Zou SQ. Inactivation of RASSF1A, the tumor suppressor gene at 3p21.3 in extrahepatic cholangiocarcinoma. World J Gastroenterol. 2005;11:1333-1338. [PubMed] |