修回日期: 2013-06-24
接受日期: 2013-07-03
在线出版日期: 2013-07-28
目的: 骨髓间充质干细胞分泌的因子(mesenchymal stem cell-derived molecules, MSC-CM)对急性肝衰竭小鼠高迁移率族蛋白B1(high mobility group box 1, HMGB1)肝细胞胞浆移位和释放的影响.
方法: D-氨基半乳糖(D-galactosamine, D-GaIN) 和脂多糖(lipopolysaccharides, LPS)诱导建立Balb/c小鼠急性肝衰竭模型; 贴壁筛选法培养纯化小鼠BMSCs, 传至第2-3代更换0.05%胎牛血清培养液24 h获得MSC-CM. 36只健康Balb/c小鼠随机均分为肝衰竭对照组和MSC-CM治疗组. Kaplan-meier法进行生存分析, 生化检测1 wk内不同时间点各实验组丙氨酸转氨酶(alanine aminotransferase, ALT)/谷草转氨酶(aspartate transaminase, AST), 24 h取肝脏进行肝脏病理检测. ELISA检测血清HMGB1、白介素-1β(interleukin-1β, IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、IL-6和IL-10水平, 免疫组织化学分析HMGB1的肝细胞表达和胞浆移位.
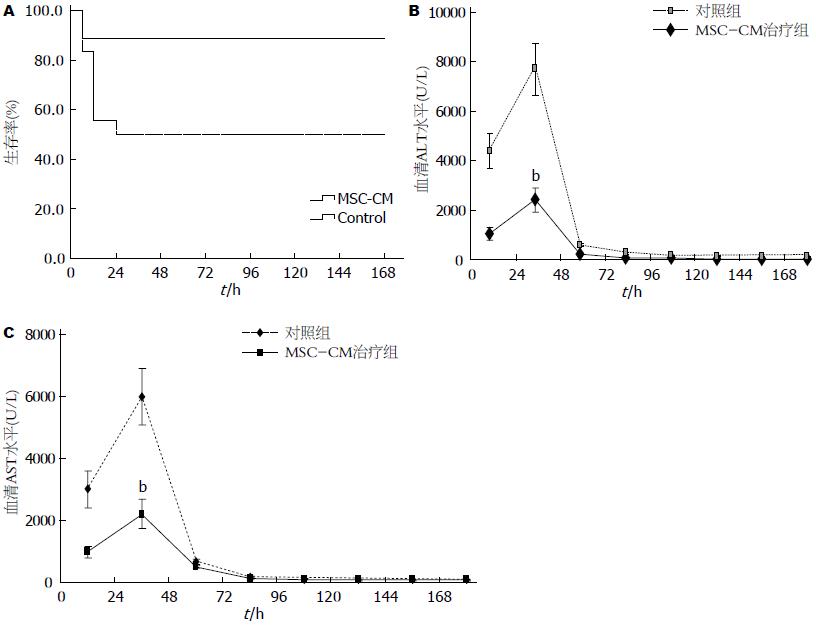
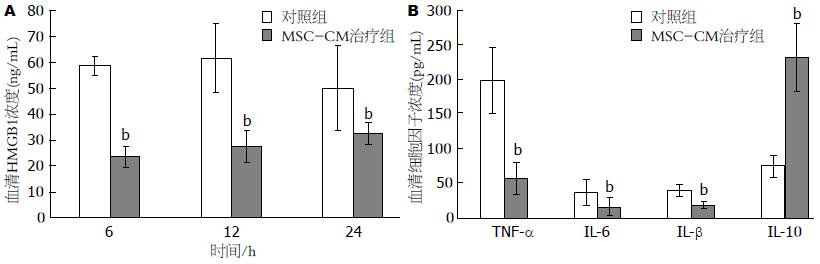
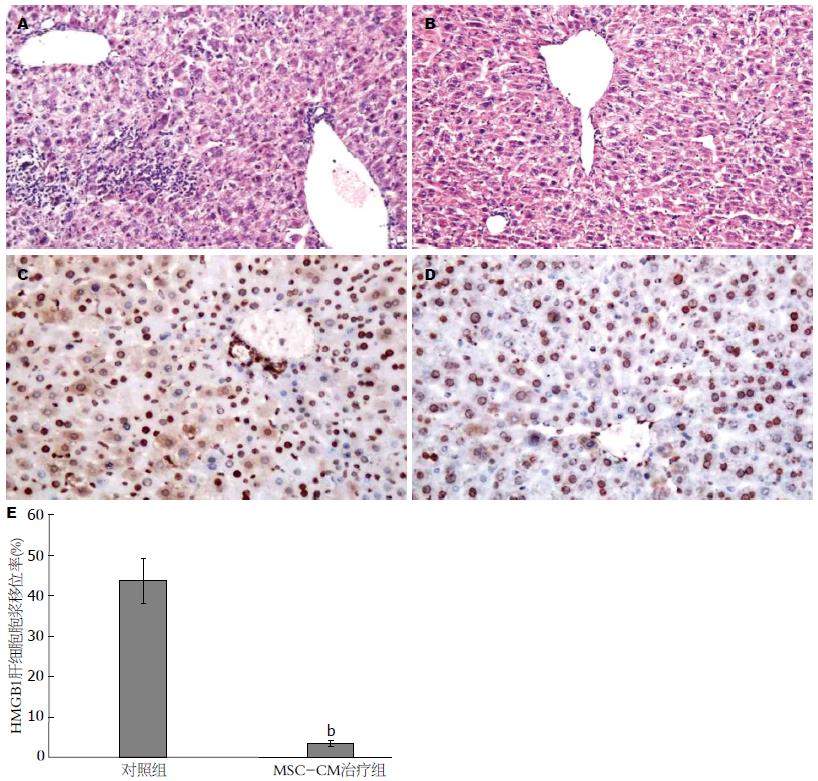
结果: MSC-CM治疗组1 wk生存率为88.9%, 显著高于对照组的16.7%(P<0.05), MSC-CM治疗组24 h的ALT/AST峰值显著低于对照组(P<0.01). MSC-CM治疗组在6、12和24 h HMGB1水平以及24 h的TNF-α、IL-1β、IL-6水平显著低于肝衰竭对照组(P<0.01), 而抗炎因子IL-10显著高于对照组(P<0.01). MSC-CM治疗组肝脏炎症坏死和肝细胞HMGB1胞浆移位较对照组明显减轻.
结论: MSC-CM治疗抑制急性肝衰竭肝细胞HMGB1胞浆移位和释放, 减轻肝脏炎症反应, 降低死亡率.
核心提示: 本研究发现, 骨髓间充质干细胞分泌因子(mesenchymal stem cell-derived molecules)治疗抑制急性肝衰竭肝细胞高迁移率族蛋白B-1(high mobility group box 1)胞浆移位和释放, 减轻肝脏炎症反应, 降低死亡率. 进一步阐明骨髓间充质干细胞(bone marrow mesenchymal stem cells)治疗急性肝衰竭的分子机制, 具有重要的基础和临床应用价值.
引文著录: 雷延昌, 梁青, 罗盼, 肖影群. 骨髓间充质干细胞分泌因子抑制急性肝衰竭肝细胞HMGB1的胞浆移位. 世界华人消化杂志 2013; 21(21): 2009-2015
Revised: June 24, 2013
Accepted: July 3, 2013
Published online: July 28, 2013
AIM: To explore the influence of mesenchymal stem cell-derived molecules (MSC-CM) on cytoplasmic translocation of HMGB1 in hepatocytes in an animal model of acute live failure.
METHODS: D-galactosamine (D-GaIN) and lipopolysaccharide (LPS) were used to induce acute liver failure in Balb/c mice. BMSCs were cultured, purified and passaged to 2-3 generations, and the medium was replaced with DMEM containing 0.05% fetal bovine serum. After further culture for 24 h, the medium containing MSC-CM was obtained. Thirty-six healthy BALB/c mice were randomly divided into two groups: an acute liver failure group (control group) and a MSC-CM treatment group. The Kaplan-Meier method was used for survival analysis. Serum ALT/AST levels were measured at different time points, and liver tissue pathological examination was performed. Serum levels of HMGB1, interleukin (IL)-1β, tumor necrosis factor (TNF)-α, IL-6 and IL-10 were detected by ELISA. HMGB1 expression and cytoplasmic translocation in hepatocytes were detected by immunohistochemistry.
RESULTS: The survival rate was significantly higher in the MSC-CM treatment group than in the control group (89.9% vs 50%, P < 0.05). MSC-CM treatment decreased the peak levels of AST/ALT at 24 h compared to the control group (P < 0.01). Serum levels of HMGB1 at 6, 12, and 24 h and TNF-α, IL-1β, IL-6 at 24 h were also decreased in the MSC-CM treatment group (all P < 0.01); however, IL-10 level was increased in MSC-CM treatment group (P < 0.01). Inflammation or necrosis in liver tissue and cytoplasm translocation of HMGB1 in hepatocytes were decreased in the MSC-CM treatment group compared to the control group (both P < 0.01).
CONCLUSION: MSC-CM treatment decreases cytoplasm translocation of HMGB1 in hepatocytes and attenuates liver inflammation and mortality in acute liver failure.
- Citation: Lei YC, Liang Q, Luo P, Xiao YQ. Mesenchymal stem cell-derived molecules attenuate cytoplasmic translocation of HMGB1 in hepatocytes in a mouse model of acute live failure. Shijie Huaren Xiaohua Zazhi 2013; 21(21): 2009-2015
- URL: https://www.wjgnet.com/1009-3079/full/v21/i21/2009.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i21.2009
骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)具有高度自我更新和多向分化潜能, 已经用于多种组织器官损伤的修复. 急性肝衰竭是各种诱因导致肝细胞短期大量坏死, 出现肝功能严重受损和多脏器功能衰竭的临床综合症, 病情凶险, 目前的人工肝和抗病毒护肝综合内科治疗有效降低病死率, 其死亡率仍高达60%以上, 严重患者除非实施紧急肝移植无其他特效治疗措施. 因肝移植难以普遍开展, BMSCs给急性肝衰竭治疗开辟新的思路. 研究显示, BMSCs能在特定环境下分化为类肝细胞样细胞[1-3], 并能够抑制肝脏炎症反应和促进受损肝脏细胞再生降低肝衰竭动物死亡率[4,5]. 后来又发现BMSCs分泌的因子(mesenchymal stem cell-derived molecules, MSC-CM)可减轻肝衰竭动物肝细胞坏死, 促进肝细胞再生, 从而提高动物生存率[6,7], 其作用机制目前知之较少. 高迁移率族蛋白B-1(high mobility group box 1, HMGBl)是一种非组蛋白核内结构蛋白, 因比其他促炎因子出现相对较晚、持续时间长, 因此被称为晚期炎症介质[8]. 临床和实验研究表明肝衰竭时HMGB1水平显著升高, 参与急性肝衰竭的炎症反应综合症病理生理过程[9-11]. 最近的研究发现, 脂多糖(lipopolysaccharides, LPS)刺激肝细胞HMGB1从胞核转移至胞浆, 发生HMGB1的细胞内移位, 肝衰竭患者和D-GaIN/LPS动物模型同样发生HMGB1的肝细胞内移位[12]. 我们前期的研究发现BMSCs移植降低肝衰竭动物模型血清HMGB1水平, 提高生存率[13], 其作用机制尚不明了. 本研究探讨MSC-CM治疗对急性肝衰竭肝细胞HMGB1胞浆移位的影响, 进一步了解BMSCs对急性肝衰竭HMGB1释放和参与的炎症反应的机制, 为BMSCs对抗肝衰竭炎症反应提供新的理论依据.
2-3周龄Balb/c小鼠, 体质量10 g±2 g(清洁级)用于MSCs提取和培养上清MSC-CM获取. 6-8周龄♂Balb/c小鼠, 体质量20 g±2 g, 用于D-GaIN/LPS诱导急性肝衰竭模型. 上述动物由南昌大学医学院动物科学部提供, 动物饲养和处理严格按照美国国立卫生研究院实验动物饲养和使用指南. 主要试剂及仪器: 胎牛血清、胰蛋白酶(GIBCO公司, 美国), DMEM低糖培养基(Hyclone公司, 美国), 细菌脂多糖(Sigma公司, 美国), D-氨基半乳糖(Solarbio公司, 中国), HMGB1兔抗鼠单抗(ABGENT公司, 美国), HMGB1和白介素-1β(interleukin-1β, IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、IL-6和IL-10试剂盒(NEB公司, 美国).
1.2.1 MSCs提取纯化和MSC-CM获取: 拉颈处死2-3周龄♂Balb/c小鼠, 放入750 mL/L的乙醇中浸泡, 消毒5-10 min. 无菌条件下取双股骨和胫骨, 用生理盐水冲洗, 剔除骨表面的组织, 用手术剪从股骨或胫骨的中间剪断, 暴露骨髓腔, DMEM培养基冲洗骨髓腔和骨骺端. 吸管将骨髓组织吹打成细胞悬液, 离心1000 r/min×10 min, 去上清, 用10%胎牛血清DMEM培养液重悬细胞接种于25 cm2塑料培养瓶中. 48 h全量更换培养液, 弃去悬浮细胞, 倒置显微镜下观察细胞生长状态. 贴壁法培养法获得MSCs, 每2-3 d换液1次, 直至长至80%-90%融合时, 用0.25%胰酶消化1:2传代. 取第二或三代MSCs弃去完全培养基, 无血清培养基洗涤3次, 更换为含有0.05%胎牛血清培养液培养24 h, 上清为MSC-CM用于本研究.
1.2.2 小鼠MSCs的鉴定: 细胞盖玻片风干后用4%多聚甲醛固定细胞15 min, 0.01 mol/L PBS液洗3遍, 每次5 min; 风干后滴加1%BSA封闭抗原, 于37 ℃下孵育30 min; 滴加CD34/CD29抗体(1:200), 37 ℃下孵育1.5 h后用0.01 mol/L PBS液洗3遍, 每次5 min; 滴加FITC标记的山羊抗兔IgG(1:400), 37 ℃下避光孵育40 min后用0.01 mol/L PBS液洗3遍, 每次5 min. 用50%甘油缓冲液封片, 置于荧光显微镜下观察.
1.2.3 动物模型及分组: 将36只6-8周龄♂Balb/c小鼠, 体质量20 g±2 g, 常规喂养2 d, 实验前禁食12 h, 不禁水. 将动物随机分为2组: 急性肝衰竭组(对照组, n = 18)给予600 mg/kg D-氨基半乳糖和40 μg/kg细菌脂多糖, 0.9%氯化钠稀释至0.2 mL腹腔注射. MSC-CM治疗组(n = 18)在腹腔注射D-GaIN/LPS前后1 h分别尾静脉注射来源于1×107个细胞的24 h培养上清1 mL, 对照组在相应时间点尾静脉注射等量生理盐水.
1.2.4 标本收集: 二组分别于腹腔注射D-GaIN/LPS后12、24、48 h至1 wk眼眶采血分离血清置于-80 ℃保存. 24 h处死, 肝组织用40 g/L的甲醛固定, 进行HE染色和免疫组织化学检测.
1.2.5 血清生化和细胞因子检测: 全自动生化分析仪检测丙氨酸氨基转移酶(alanine aminotransferase, ALT)和天冬氨酸氨基转移酶(aspartate aminotransferase, AST). 血清HMGB1和细胞因子检测按照生产厂家说明书进行, 根据标准曲线计算结果.
1.2.6 免疫组织化学: 肝组织切片常规脱蜡, 3%过氧化氢室温孵育10 min, 清除内源性过氧化氢酶, PBS洗3次, 3 min/次. 10%山羊血清封闭30 min, PBS稀释一抗(HMGB1, 1:100), 甩掉封闭液, 每片滴加100 μL一抗, 4 ℃过夜, PBS洗3次, 滴加羊抗兔辣根过氧化物酶标记二抗室温孵育20 min, PBS振洗后滴加DAB显色剂充分显色, 自来水洗终止反应, 苏木素复染细胞核, 再脱水、透明、晾干中性树胶封片.
统计学处理 所有数据用SPSS18.0软件作统计学分析, 数据资料以mean±SD表示, SPSS18.0绘制生存曲线, 生存率比较采用Log-rank检验, 两组样本均数的比较应用t检验, 两个样本率的比较采用χ2检验, P<0.05为统计学显著性差异.
D-GalN/LPS腹腔注射肝衰竭组小鼠1 wk生存率为50%, 死亡集中发生在腹腔注射后12-24 h之间, 而MSC-CM治疗组小鼠1 wk生存率为88.9%. Kaplan-Meier法对小鼠生存率分析, Log-rank检验结果显示, MSC-CM治疗组生存率显著高于肝衰竭对照组(P<0.05, 图1A). 肝衰竭小鼠血清ALT/AST水平在12 h开始升高, 24 h达高峰, 48 h开始下降, 并逐渐恢复正常, MSC-CM治疗组血清ALT/AST水平在12 h和24 h较对照组降低, 其中24 h水平有显著性差异(P<0.01, 图1B, C).
近年来发现HMGB1在急性肝衰竭炎症反应中十分重要, 研究者前期发现BMSC移植降低肝衰竭小鼠HMGB1水平, 提高生存率. ELISA检测不同时间点血清HMGB1水平发现, D-GalN/LPS诱导肝衰竭Balb/c小鼠血清HMGB1在6 h已开始升高, 12 h达高峰, 24 h开始下降, 48 h接近正常水平. 为了解MSC-CM治疗对肝衰竭HMGB1的影响, 比较6、12和24 h血清HMGB1水平, 结果显示MSC-CM治疗组在上述3个时间点HMGB1水平显著低于肝衰竭对照组(P<0.01)(图2A). 为了解MSC-CM治疗对急性肝衰竭炎症因子的影响, ELISA检测血清不同时间点炎症性细胞因子和抗炎因子水平的结果显示, MSC-CM治疗组TNF-α、IL-1β、IL-6水平显著低于肝衰竭对照组(P<0.01)(图2B), 而抗炎因子IL-10显著高于对照组(P<0.01)(图2B).
本研究应用♂ Balb/c小鼠腹腔注射D-GalN/LPS建立急性肝衰竭模型, 小鼠1 wk生存率为50%, 动物死亡发生在给药后12-24 h, 与作者之前的研究一致[13]. MSC-CM治疗组小鼠1 wk生存率为88.9%显著高于肝衰竭对照组. 检测外周血ALT/AST水平可反映肝脏损伤程度, 肝衰竭小鼠血清ALT/AST水平在12 h开始升高, 24 h达高峰, 48 h开始下降并逐渐恢复正常. 与国外的研究一致[6,7], MSC-CM治疗组血清ALT/AST水平24 h峰值较对照组显著降低, 表明MSC-CM治疗减轻肝细胞损伤, 对肝衰竭保护作用和BMSCs相似.
肝衰竭大面积肝组织损伤引起局部甚至全身炎症反应综合征, 最终导致多器官功能衰竭. 近年来发现HMGB1在急性肝衰竭炎症反应中十分重要, 研究者前期发现BMSC移植降低肝衰竭小鼠HMGB1水平, 提高生存率. 肝衰竭小鼠血清HMGB1在6 h已开始升高, 12 h达高峰, 24 h开始下降, MSC-CM治疗组在6、12和24 h 3个时间点HMGB1水平显著低于对照组. 与之相一致, MSC-CM治疗组血清TNF-α、IL-1β、IL-6水平显著低于肝衰竭对照组, 而抗炎因子IL-10显著高于对照组. 此外, MSC-CM治疗组肝脏炎症坏死程度较对照组明显减轻. 提示MSC-CM治疗增加抗炎因子IL-10水平, 降低HMGB1和多种炎症因子水平减轻肝脏炎症坏死.
目前认为, 内毒素血症和巨噬细胞活化释放的HMGB1和TNF-α等炎症因子在急性肝衰竭发病中具有重要作用. 急性肝衰竭枯否细胞对内毒素灭活能力降低, 内毒素血症发生率可高达90%-100%. 研究显示, 急性肝衰竭Toll样受体(Toll-like receptors, TLRs)在各种免疫细胞表达增加[14]. 内毒素, 主要是革兰氏阴性菌的LPS, 与TLR4结合, 通过活化核转录因子NF-κB, 刺激大量炎症因子释放, 导致继发性全身性炎症反应综合症, 导致肝衰竭发生发展[15,16]. HMGB1被证明为是一个炎症因子[17,18], 既可以通过活化的单核细胞/巨噬细胞, 中心粒白细胞和内皮细胞主动释放, 也可以通过坏死的细胞被动释放[19,20]. HMGB1可以直接促进炎症因子的释放(TNF-α、IL-1β、IL-6和IL-8等)和外周血单核细胞释放趋化因子[20-22], 募集更多炎症细胞放大炎症反应, 加重肝组织损伤. 动物模型和临床研究显示, HMGB1与急性肝衰竭发生和疾病的严重程度密切相关[23,24]. 在本研究中, MSC-CM治疗降低HMGB1和炎症因子(TNF-α、IL-1β和IL-6)水平, 有效抑制炎症反应和肝组织损伤, 表现为血清ALT/AST水平下降、肝脏炎症坏死减轻和生存率提高.
研究证明, MSCs治疗下调肾脏和肺缺血再灌注损伤局部炎症因子和上调抗炎因子IL-10水平对抗组织炎症坏死[25,26]. 最近的结果显示, MSCs分泌的因子上调IL-10水平逆转急性肾损伤[27]. 表明, MSC-CM有可能通过上调IL-10水平对抗急性肝衰竭肝脏炎症反应, 发挥治疗效应. 本研究显示, MSC-CM同时具有上调抗炎炎因子IL-10水平和下调包括HMGB1在内的促炎因子水平, 可能是MSC-CM治疗急性肝衰竭的机制之一.
最近研究显示[12], LPS刺激肝细胞HMGB1从胞核转移至胞浆, 发生HMGB1的细胞内移位并主动释放HMGB1, 但与肝细胞坏死被动释放有显著差别, 该过程并不依赖肝细胞坏死. 与之相一致, 肝衰竭患者和D-GaIN/LPS急性肝衰竭模型都存在HMGB1的肝细胞胞浆移位. 我们前期的研究发现BMSCs移植降低肝衰竭动物模型血清HMGB1水平, 提高生存率[13]. 本研究发现, MSC-CM治疗减轻急性肝衰竭肝组织炎症坏死, 同时伴有HMGB1的胞浆移位减少, 从而降低肝细胞释放HMGB1. 在正常情况下, 虽然肝细胞不是释放HMGB1的主要细胞, 但由于肝细胞数量巨大, 在急性肝损伤情况下, LPS等刺激肝细胞HMGB1移位和主动释放, 进一步加重肝损伤. MSC-CM治疗降低肝细胞HMGB1胞浆移位可达到及早对抗急性肝衰竭炎症反应和疾病进展.
总之, MSC-CM治疗与BMSCs移植同样可以降低急性肝衰竭HMGB1和TNF-α、IL-1β、IL-6等炎症因子水平, 减轻肝脏炎症坏死, 提高生存率. 抑制急性肝衰竭肝细胞HMGB1的胞浆移位减少HMGB1释放, 可能是MSC-CM治疗急性肝衰竭的机制之一. 上述结果为BMSCs抗肝衰竭炎症反应治疗提供了新的理论基础, 具有重要的理论和应用价值.
髓间充质干细胞分泌因子(mesenchymal stem cell-derived molecules, MSC-CM)可以逆转小鼠急性肝功能衰竭, 后期炎症因子高迁移率族蛋白B1(high mobility group box 1, HMGB1)及其肝细胞内移位在急性肝衰竭的发生中有重要作用. 然而, MSC-CM治疗急性肝衰竭的机制尚不十分清楚.
刘亮明, 副教授, 副主任医师, 上海交通大学附属第一人民医院松江分院肝病科
相关研究表明, MSC-CM下调肿瘤坏死因子-α、白介素-1β(interleukin, IL-1β)、IL-6和上调抗炎因子IL-10等抑制过激的炎症反应, MSC-CM是否影响肝细胞HMGB1的细胞内移位, 值得进一步探讨.
近来发现, MSC-CM与骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)同样可以逆转急性肝衰竭, 作者前期的研究发现BMSCs抑制急性肝衰竭HMGB1水平, 减轻肝脏炎症反应, 其作用机制待进一步研究.
MSC-CM抑制急性肝衰竭炎症反应的机制众多, 本文从MSC-CM能抑制HMGB1水平入手, 探讨MSC-CM对急性肝衰竭小鼠肝细胞HMGB1胞浆移位的作用进行研究, 为BMSCs治疗急性肝衰竭提供新的理论基础.
自体BMSCs移植对急性肝衰竭患者具有治疗作用, 本研究显示MSC-CM具有逆转急性肝衰竭作用, 值得进一步临床研究. 由于MSC-CM可反复大量获得, 直接通过静脉注射而不需移植, 具有较好的应用前景.
本文具有一定的基础和临床应用价值.
编辑:田滢 电编:鲁亚静
| 1. | Schwartz RE, Reyes M, Koodie L, Jiang Y, Blackstad M, Lund T, Lenvik T, Johnson S, Hu WS, Verfaillie CM. Multipotent adult progenitor cells from bone marrow differentiate into functional hepatocyte-like cells. J Clin Invest. 2002;109:1291-1302. [PubMed] |
| 2. | Mohamadnejad M, Namiri M, Bagheri M, Hashemi SM, Ghanaati H, Zare Mehrjardi N, Kazemi Ashtiani S, Malekzadeh R, Baharvand H. Phase 1 human trial of autologous bone marrow-hematopoietic stem cell transplantation in patients with decompensated cirrhosis. World J Gastroenterol. 2007;13:3359-3363. [PubMed] |
| 3. | Anzalone R, Lo Iacono M, Corrao S, Magno F, Loria T, Cappello F, Zummo G, Farina F, La Rocca G. New emerging potentials for human Wharton's jelly mesenchymal stem cells: immunological features and hepatocyte-like differentiative capacity. Stem Cells Dev. 2010;19:423-438. [PubMed] [DOI] |
| 4. | Kuo TK, Hung SP, Chuang CH, Chen CT, Shih YR, Fang SC, Yang VW, Lee OK. Stem cell therapy for liver disease: parameters governing the success of using bone marrow mesenchymal stem cells. Gastroenterology. 2008;134:2111-2121, 2111-2121. [PubMed] |
| 5. | Campard D, Lysy PA, Najimi M, Sokal EM. Native umbilical cord matrix stem cells express hepatic markers and differentiate into hepatocyte-like cells. Gastroenterology. 2008;134:833-848. [PubMed] [DOI] |
| 6. | van Poll D, Parekkadan B, Cho CH, Berthiaume F, Nahmias Y, Tilles AW, Yarmush ML. Mesenchymal stem cell-derived molecules directly modulate hepatocellular death and regeneration in vitro and in vivo. Hepatology. 2008;47:1634-1643. [PubMed] [DOI] |
| 7. | Parekkadan B, van Poll D, Suganuma K, Carter EA, Berthiaume F, Tilles AW, Yarmush ML. Mesenchymal stem cell-derived molecules reverse fulminant hepatic failure. PLoS One. 2007;2:e941. [PubMed] [DOI] |
| 8. | Erlandsson Harris H, Andersson U. Mini-review: The nuclear protein HMGB1 as a proinflammatory mediator. Eur J Immunol. 2004;34:1503-1512. [PubMed] [DOI] |
| 9. | Zhou RR, Liu HB, Peng JP, Huang Y, Li N, Xiao MF, Wang H, Fan XG. High mobility group box chromosomal protein 1 in acute-on-chronic liver failure patients and mice with ConA-induced acute liver injury. Exp Mol Pathol. 2012;93:213-219. [PubMed] [DOI] |
| 12. | Zhou RR, Zhao SS, Zou MX, Zhang P, Zhang BX, Dai XH, Li N, Liu HB, Wang H, Fan XG. HMGB1 cytoplasmic translocation in patients with acute liver failure. BMC Gastroenterol. 2011;11:21. [PubMed] [DOI] |
| 14. | 陈 煜, 时 红波, 张 帆, 丁 美, 赵 军, 刘 旭华, 段 钟平. TLR2、TLR4和TLR9在慢性重型肝炎患者及肝衰竭大鼠中的表达. 世界华人消化杂志. 2010;18:1320-1325. [DOI] |
| 16. | Rolando N, Wade J, Davalos M, Wendon J, Philpott-Howard J, Williams R. The systemic inflammatory response syndrome in acute liver failure. Hepatology. 2000;32:734-739. [PubMed] [DOI] |
| 17. | Tsung A, Sahai R, Tanaka H, Nakao A, Fink MP, Lotze MT, Yang H, Li J, Tracey KJ, Geller DA. The nuclear factor HMGB1 mediates hepatic injury after murine liver ischemia-reperfusion. J Exp Med. 2005;201:1135-1143. [PubMed] [DOI] |
| 18. | Wang H, Bloom O, Zhang M, Vishnubhakat JM, Ombrellino M, Che J, Frazier A, Yang H, Ivanova S, Borovikova L. HMG-1 as a late mediator of endotoxin lethality in mice. Science. 1999;285:248-251. [PubMed] [DOI] |
| 19. | Scaffidi P, Misteli T, Bianchi ME. Release of chromatin protein HMGB1 by necrotic cells triggers inflammation. Nature. 2002;418:191-195. [PubMed] [DOI] |
| 20. | Bonaldi T, Talamo F, Scaffidi P, Ferrera D, Porto A, Bachi A, Rubartelli A, Agresti A, Bianchi ME. Monocytic cells hyperacetylate chromatin protein HMGB1 to redirect it towards secretion. EMBO J. 2003;22:5551-5560. [PubMed] [DOI] |
| 21. | Andersson U, Wang H, Palmblad K, Aveberger AC, Bloom O, Erlandsson-Harris H, Janson A, Kokkola R, Zhang M, Yang H. High mobility group 1 protein (HMG-1) stimulates proinflammatory cytokine synthesis in human monocytes. J Exp Med. 2000;192:565-570. [PubMed] [DOI] |
| 22. | Raucci A, Palumbo R, Bianchi ME. HMGB1: a signal of necrosis. Autoimmunity. 2007;40:285-289. [PubMed] [DOI] |
| 25. | Tögel F, Hu Z, Weiss K, Isaac J, Lange C, Westenfelder C. Administered mesenchymal stem cells protect against ischemic acute renal failure through differentiation-independent mechanisms. Am J Physiol Renal Physiol. 2005;289:F31-F42. [PubMed] [DOI] |
| 26. | Ortiz LA, Dutreil M, Fattman C, Pandey AC, Torres G, Go K, Phinney DG. Interleukin 1 receptor antagonist mediates the antiinflammatory and antifibrotic effect of mesenchymal stem cells during lung injury. Proc Natl Acad Sci U S A. 2007;104:11002-11007. [PubMed] [DOI] |
| 27. | Milwid JM, Ichimura T, Li M, Jiao Y, Lee J, Yarmush JS, Parekkadan B, Tilles AW, Bonventre JV, Yarmush ML. Secreted factors from bone marrow stromal cells upregulate IL-10 and reverse acute kidney injury. Stem Cells Int. 2012;2012:392050. [PubMed] |