修回日期: 2012-12-24
接受日期: 2013-01-05
在线出版日期: 2013-01-18
目的: 探讨白介素-28B(interleukin-28B, IL-28B)单核苷酸多态性位点rs8099917与中国丙型肝炎易感性的关系.
方法: 采用TaqMan SNP基因分型的方法检测中国天津地区263名丙型肝炎患者和244名健康人IL-28B rs8099917基因型和等位基因分布情况, 并统计分析rs8099917基因型和等位基因在2组中分布的差异.
结果: 在263名丙型肝炎患者中, TT基因型223人(84.8%), TG基因型39人(14.8%), GG基因型1人(0.4%). T等位基因频率为92.2%. 244名健康对照者中, TT基因型222人(91.0%) , TG 21人(8.60%), GG 1人(0.40%), T等位基因频率为95.3%. 丙型肝炎患者和健康人群TG/GG基因型频率差异有统计学意义(OR = 1.810, 95%CI: 1.042-3.145; P = 0.033). 丙型肝炎患者G等位基因频率也高于健康人(OR = 1.709, 95%CI: 1.010-2.893; P = 0.044).
结论: 中国人群IL-28B rs8099917基因多态性与丙型肝炎病毒(hepatitis C virus, HCV)感染易感性相关联. G为HCV感染的风险等位基因.
引文著录: 米寅, 高英堂, 焦晓磊, 杜智. IL-28B基因多态性与丙型肝炎易感性的关系. 世界华人消化杂志 2013; 21(2): 182-187
Revised: December 24, 2012
Accepted: January 5, 2013
Published online: January 18, 2013
AIM: To study the association between interleukin-28B (IL-28B) single nucleotide polymorphism (SNP) rs8099917 and susceptibility to hepatitis C virus (HCV) infection in Chinese patients.
METHODS: The IL-28B rs8099917 locus was genotyped in 263 patients infected with HCV and 244 healthy controls using TaqMan SNP genotyping assay. The differences in rs8099917 genotypes and allele frequencies between the two groups were analyzed by statistics.
RESULTS: Among 263 patients with chronic HCV, 223 (84.8%) had the TT genotype, 39 (14.8%) had the TG genotype, and 1 (0.40%) carried GG genotype. The frequency of T allele was 0.922. Of 244 healthy controls, the numbers of people who carried TT, TG and GG genotypes were 222 (91.0%), 21 (8.6%) and 1 (0.4%), respectively. T allele frequency was 0.953. TG/GG genotype frequencies differed significantly between patients with chronic HCV and healthy controls (OR = 1.810, 95% CI: 1.042-3.145; P = 0.033). Patients with HCV infection had a higher G allele frequency than healthy controls (OR = 1.709, 95% CI: 1.010-2.893; P = 0.044).
CONCLUSION: The IL-28B rs8099917 gene polymorphism correlates with susceptibility to HCV infection in Chinese patient. G allele is associated with a higher risk of HCV infection.
- Citation: Mi Y, Gao YT, Jiao XL, Du Z. Association between an IL-28B gene polymorphism and susceptibility to hepatitis C virus infection. Shijie Huaren Xiaohua Zazhi 2013; 21(2): 182-187
- URL: https://www.wjgnet.com/1009-3079/full/v21/i2/182.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i2.182
丙型病毒性肝炎是由丙型肝炎病毒(hepatitis C virus, HCV)引起的一种传染病, 主要通过静脉毒品注射、输血、器官移植和血液透析等途径传播[1]. 目前全球丙型肝炎患者约有1.3至1.7亿人, 每年因HCV感染而死亡者高达35万人[2]. 相对乙型肝炎, 丙型肝炎更容易慢性化, 他已经成为导致肝硬化和肝癌的主要原因之一[3], 严重危害着人类健康, 所以对丙型肝炎进行积极预防以及有效的治疗是十分必要的. HCV感染的具体机制尚不清楚, 除与病毒本身有关, 更重要的是与不同个体的遗传易感性有关. 白细胞介素-28B(interleukin-28B, IL-28B)又称为IFN-λ3, 属于IFN-λs干扰素家族, 亦即Ⅲ型干扰素(interferon, IFN)家族, 该家族另外2个成员是IL-29、IL-28A, 分别又称为IFN-λ1、IFN-λ2. 编码人IFN-λs的基因均位于19号染色体(19q13.13), 其中rs8099917位于IL-28B基因上游约8 kb处[4,5]. 近年研究表明, IL-28B rs8099917基因多态性与HCV自然清除以及抗病毒治疗应答密切相关, TT基因型较TG/GG更利于HCV的清除[4-7]. 然而在中国人群中, 是否rs8099917基因多态性与HCV感染存在易感性还鲜有研究报道. 本研究检测了天津地区慢性丙型肝炎患者和健康人群IL-28B rs8099917基因型和等位基因分布情况, 以探讨IL-28B rs8099917基因多态性与丙型肝炎易感性的关系.
研究选取2005-2011年于天津市第三中心医院就诊的丙型肝炎患者263名. 参照《丙型肝炎防治指南》诊治标准[8], 所有患者均确诊为慢性丙型病毒性肝炎, 且抗HCV抗体(通过酶联免疫吸附实验测定)与HCV-RNA均为阳性. 排除有乙型病毒性肝炎、人类免疫缺陷病毒感染、精神疾病、自身免疫性肝炎、肝移植的患者. 其中男132人(50.2%), 女131人(49.8%), 平均年龄54.0岁±11.7岁. 另外选取在天津市第三中心医院预防保健科进行健康查体的健康对照者244人. 健康对照组人群均无HCV感染史. 其中男136人(55.7%), 女108人(44.3%), 平均年龄52.1岁±10.7岁. 所研究对象均为天津地区汉族人群, 一般资料来自门诊或病房的病历记录. 本研究所有血液样本的收集、处理和rs8099917基因型检测均经患者本人同意, 并经天津市第三中心医院伦理委员会批准.
1.2.1 HCV-RNA检测: 采用HCV核酸定量检测试剂盒(上海科华生物工程股份有限公司)检测丙型肝炎患者HCV-RNA, 最低检测值为500 IU/mL.
1.2.2 基因组DNA提取: 从患者和健康对照者外周静脉血分离出血凝块, 利用酚-氯仿-异戊醇抽提法提取基因组DNA, 并用1.5%琼脂糖凝胶电泳检测提取结果[9].
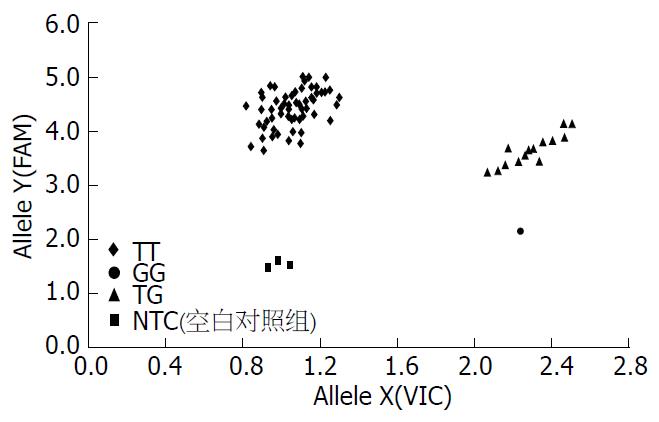
1.2.3 IL-28B rs8099917基因型检测: 首先采用ABI PRISM® 7000 SDS对所提取的DNA进行PCR扩增, 扩增体系为10 µL, 含DNA模板1.5 µL、2×TaqMan Genotyping Master Mix 5 µL、40×TaqMan SNP Genotyping Assay Mix(rs8099917, C_11710096_10)0.25 µL和超纯水3.25 µL. 每96孔板设置3个空白对照(NTC). 反应条件为: 95 ℃热变性5 min, 92 ℃变性20 s, 60 ℃退火1 min, 共50个循环. 在上述PCR基础上, 利用ABI PRISM® 7000 SDS通过读取荧光信号进行等位基因的SNP分析, 并根据散点图的分布情况分析各样品的基因型和等位基因(图1).
统计学处理 采用SPSS17.0软件进行统计学分析. 对丙型肝炎患者组和健康对照组rs8099917基因型分布进行哈迪温伯格平衡检验. 用Mann-Whitney U检验比较两组人群年龄的差异. 两组人群性别的差异以及IL-28B rs8099917基因型和等位基因在两组人群中的分布情况用四格表χ2检验分析, 并计算比值比(odds ratio, OR)及95%可信区间(confidential interval, CI). 检验均为双侧, P<0.05表示差异有统计学意义.
在263名慢性丙型肝炎患者中, 男132人(50.2%), 女131人(49.8%), 平均年龄54.0岁±11.7岁. 在244名健康人中, 男136人(55.7%), 女108人(44.3%), 平均年龄52.1岁± 10.7岁. 统计发现丙型肝炎患者组与健康对照组在性别、年龄上的差异均无统计学意义(χ2 =1.563, P = 0.211; Z = 1.842, P = 0.065). 两组人群之间显示良好的匹配性(表1).
本研究对丙型肝炎患者组和健康对照组IL-28B rs8099917基因多态性进行遗传平衡检验. 结果显示, 丙型肝炎患者组和健康对照组均符合哈迪温伯格遗传平衡定律, χ2值分别为0.26和0.43, 均P>0.05, 具有人群代表性(表2).
| 分组 | Hardy-Weinberg | |
| χ2值 | P值 | |
| 丙型肝炎患者组 | 0.26 | 0.5<P<0.75 |
| 健康对照组 | 0.43 | 0.5<P<0.75 |
丙型肝炎患者组263人, 基因型TT 223人(84.8%), TG 39人(14.8%), GG 1人(0.40%), T等位基因频率92.2%. 健康对照组244人, 基因型TT 222人(91.0%), TG 21人(8.60%), GG 1人(0.40%), T等位基因频率95.3%. 丙型肝炎患者TG/GG基因型频率高于健康人(15.2% vs 9.0%; OR = 1.810, 95%CI: 1.042-3.145; P = 0.033), 丙型肝炎患者G等位基因频率比例高于健康人(7.8% vs 4.7%; OR = 1.709, 95%CI: 1.010-2.893; P = 0.044), 差异均有统计学意义(表3). 结果显示G等位基因为HCV感染的风险等位基因.
| 健康人群(n = 244) | 丙型肝炎患者(n = 263) | OR(95%CI) | χ2值 | P值 | |
| rs8099917基因型 | |||||
| TT | 222(91.0) | 223(84.8) | 1 | ||
| TG | 21(8.6) | 39(14.8) | |||
| GG | 1(0.4) | 1(0.4) | |||
| TG/GG | 22(9.0) | 40(15.2) | 1.810(1.042-3.145) | 4.522 | 0.033 |
| rs8099917等位基因 | |||||
| T | 465(95.3) | 485(92.2) | 1 | ||
| G | 23(4.7) | 41(7.8) | 1.709(1.010-2.893) | 4.065 | 0.044 |
如表4所示, TT基因型频率从高到低依次是台湾(89.6%)、韩国(86.2%)、中国(84.8%)、日本(70.4%)、欧洲(58.0%). 中国丙型肝炎患者rs8099917基因型分布与韩国相似(P= 0.783), 亚洲国家和地区中, 日本患者TT基因型频率低于中国、台湾和韩国; 欧洲患者TT基因型频率则明显低于亚洲丙型肝炎患者.
HCV急性感染后, 只有不到30%的人发生病毒自然清除, 其余患者会持续感染, 大大增加了发展为肝硬化和肝癌的风险[10]. 除了病毒因素, 宿主因素(年龄、性别、种族、宿主基因等)与丙型肝炎的发生发展也密切相关[11]. 近年有研究发现, 位于人19号染色体上编码IFN-λ的基因IL-28B与HCV自然清除以及治疗应答密切相关. rs8099917位于IL-28B基因上游约8 kb处, 研究发现TT基因型能够预测病毒自然清除和治疗应答[4-7]. 有关中国人群rs8099917与HCV感染相关性的研究还较少. 本研究检测了中国慢性丙型肝炎患者和健康人群IL-28B rs8099917基因型、等位基因的分布情况, 以分析rs8099917与HCV感染易感性的关系.
IFN-λs干扰素家族亦即Ⅲ型IFN家族, 包括IL-29、IL-28A、IL-28B, 此3种白细胞介素是由外周血单核细胞、树突状细胞和HeLa细胞等经病毒或双链RNA激活而产生的细胞因子[12]. 与IFN信号途径相似, IL-28/29与受体结合后, 启动信号级联反应, 经过多步磷酸化反应, 激活JAK-STAT信号通路, 导致干扰素激活基因因子3复合物(IFN stimulated gene factor 3 complex, ISGF3)与干扰素激活反应元件(IFN stimulated response element, ISRE)相互作用, 从而调节基因的转录, 最终发挥抗病毒效应[10]. 有实验已经证明IFN-λs在体内体外均能发挥抗病毒的作用[13-15]. 虽然rs8099917基因多态性在抗HCV感染中的具体机制还不明确, 有研究发现rs8099917 G等位基因与IFN-λ的低表达相关[5,7].
本研究选取的健康对照人群与慢性丙型肝炎患者在年龄和性别上均没有明显差异(均P>0.05), 并且同为天津地区汉族人群, 因此可以排除性别、年龄、民族对HCV感染易感性的干扰. 本研究发现, rs8099917基因型在两组的分布存在明显差异. 健康人群TT基因型频率(91.0%)高于丙型肝炎患者(84.8%), 而TG/GG基因型频率(9.0%)明显低于丙型肝炎患者(15.2%). 同样, 研究还发现丙型肝炎患者G等位基因频率(7.8%)高于健康人群(4.7%). 由此可以推测, TG/GG基因型人群比TT更易发展为慢性HCV感染, G为HCV持续感染的风险等位基因. IL-28B rs8099917基因多态性与HCV感染易感性相关联.
之前的学者在研究IL-28B rs8099917基因多态性与丙型肝炎相关性时, 多关注HCV自然清除和基于干扰素治疗的病毒清除, 较少与健康人群对照, 关注丙型肝炎易感性. Rauch等[4]研究了欧洲1 015名慢性丙型肝炎患者和347名HCV自然清除患者, 发现与rs8099917 TT基因型相比, TG(OR = 2.24, 95%CI: 1.63-3.07; P = 6.63×10-7)和GG(OR = 6.02, 95%CI: 2.10-17.21; P = 8.10×10-4)发展为慢性丙型肝炎的风险更高. Ochi等[16]研究发现, 在1b型HCV感染的日本丙型肝炎患者中, T等位基因频率明显低于健康人(86.8% vs 91.7%; P = 2.9×10-3). 然而这种差异在日本2a型HCV感染者中却不明显(89.9% vs 91.7%; P = 0.41). 与1型HCV感染者相比, 2型HCV丙型肝炎患者保护等位基因频率较高, 风险等位基因频率较低[16]. 由此判断, 由于亚洲2型HCV患者与健康人群基因型分布很接近, rs8099917与2型HCV感染易感性的关联可能不显著. 与本研究的发现不同, Chen等[17]在台湾人群中的研究发现, 台湾健康男性GG基因型频率是男性慢性丙型肝炎患者的21.5倍. 是否存在其他作用更强的宿主基因影响HCV感染, 还需要进一步研究.
此外, 本研究还比较了中国汉族与其他民族慢性丙型肝炎患者rs8099917基因型分布的差异. 本研究发现, 在亚洲一些国家或地区中, 中国丙型肝炎患者rs8099917基因型分布与韩国相似(P = 0.783), 保护基因型频率介于台湾和日本之间[17-19]. 日本健康人群TT基因型频率(83.7%)也低于中国健康人群(91%). 这种差异可能与遗传基因与环境的长期相互选择有关. 然而在欧洲丙型肝炎患者中, TT基因型频率为58%[4]. 可见, 亚洲人群TT基因型频率高于白种人, 这种现象也许可以在某种程度上解释亚洲丙型肝炎患者抗病毒治疗应答效果好于白种人的原因[20].
总之, IL-28B rs8099917基因多态性与中国慢性丙型肝炎感染的易感性相关, G等位基因可能增加HCV持续感染的风险. 这些发现可能有助于预测HCV感染的风险, 使部分易感人群在一定程度上加强对HCV的预防. IL-28B在抗HCV感染中的具体机制仍然是未来研究的重点.
丙型病毒性肝炎是由丙型肝炎病毒(HCV)引起的一种传染病, 是导致肝硬化和肝癌的主要原因之一, 每年因HCV感染而死亡者高达35万人. HCV感染的具体机制尚不清楚, 除与病毒本身有关, 更重要的是与不同个体的遗传易感性有关.
刘绍能, 主任医师, 中国中医科学院广安门医院消化科
近年研究表明, 白介素-28B(IL-28B)rs8099917基因多态性与HCV自然清除以及抗病毒治疗应答密切相关, TT基因型较TG/GG更利于HCV的清除. 然而在中国人群中, 是否rs8099917基因多态性与HCV感染存在易感性还鲜有研究报道.
Rauch等研究了欧洲1015名慢性丙型肝炎患者和347名HCV自然清除患者, 发现HCV自然清除患者TT基因型频率高于慢性丙型肝炎患者, 与rs8099917 TT基因型相比, TG和GG发展为慢性丙型肝炎的风险更高.
本研究检测了天津地区慢性丙型肝炎患者和健康人群IL-28B rs8099917基因型和等位基因的分布情况, 发现中国人群IL-28B rs8099917基因多态性与HCV感染易感性相关联, G为HCV感染的风险等位基因.
IL-28B rs8099917基因多态性与中国慢性丙型肝炎感染的易感性相关, G等位基因可能增加HCV持续感染的风险. 这些发现可能有助于预测HCV感染的风险, 使部分易感人群在一定程度上加强对HCV的预防. IL-28B在抗HCV感染中的具体机制仍然是未来研究的重点.
本研究设计合理, 资料详细, 结果可信, 有一定的参考价值.
编辑: 田滢 电编: 闫晋利
| 1. | Martins T, Narciso-Schiavon JL, Schiavon Lde L. [Epidemiology of hepatitis C virus infection]. Rev Assoc Med Bras. 2011;57:107-112. [PubMed] |
| 2. | World Health Organization. Available from: http: //www.who.int/mediacentre/factsheets/fs164/zh/. (2011). |
| 3. | Seeff LB. Natural history of chronic hepatitis C. Hepatology. 2002;36:S35-S46. [PubMed] |
| 4. | Rauch A, Kutalik Z, Descombes P, Cai T, Di Iulio J, Mueller T, Bochud M, Battegay M, Bernasconi E, Borovicka J. Genetic variation in IL28B is associated with chronic hepatitis C and treatment failure: a genome-wide association study. Gastroenterology. 2010;138:1338-1345, 1345. e1-e7. [PubMed] [DOI] |
| 5. | Suppiah V, Moldovan M, Ahlenstiel G, Berg T, Weltman M, Abate ML, Bassendine M, Spengler U, Dore GJ, Powell E. IL28B is associated with response to chronic hepatitis C interferon-alpha and ribavirin therapy. Nat Genet. 2009;41:1100-1104. [PubMed] [DOI] |
| 6. | Grebely J, Petoumenos K, Hellard M, Matthews GV, Suppiah V, Applegate T, Yeung B, Marks P, Rawlinson W, Lloyd AR. Potential role for interleukin-28B genotype in treatment decision-making in recent hepatitis C virus infection. Hepatology. 2010;52:1216-1224. [PubMed] [DOI] |
| 7. | Tanaka Y, Nishida N, Sugiyama M, Kurosaki M, Matsuura K, Sakamoto N, Nakagawa M, Korenaga M, Hino K, Hige S. Genome-wide association of IL28B with response to pegylated interferon-alpha and ribavirin therapy for chronic hepatitis C. Nat Genet. 2009;41:1105-1109. [PubMed] [DOI] |
| 9. | 刘 娟娟, 高 英堂, 杜 智, 杨 斌, 经 翔, 王 毅军, 王 凤梅, 刘 彤. IL-10基因启动子区单核苷酸多态性与乙型肝炎病毒感染后疾病转归的关系. 世界华人消化杂志. 2010;18:1656-1663. [DOI] |
| 10. | Balagopal A, Thomas DL, Thio CL. IL28B and the control of hepatitis C virus infection. Gastroenterology. 2010;139:1865-1876. [PubMed] [DOI] |
| 11. | Ghany MG, Strader DB, Thomas DL, Seeff LB. Diagnosis, management, and treatment of hepatitis C: an update. Hepatology. 2009;49:1335-1374. [PubMed] [DOI] |
| 12. | Sheppard P, Kindsvogel W, Xu W, Henderson K, Schlutsmeyer S, Whitmore TE, Kuestner R, Garrigues U, Birks C, Roraback J. IL-28, IL-29 and their class II cytokine receptor IL-28R. Nat Immunol. 2003;4:63-68. [PubMed] |
| 13. | Melchjorsen J, Sirén J, Julkunen I, Paludan SR, Matikainen S. Induction of cytokine expression by herpes simplex virus in human monocyte-derived macrophages and dendritic cells is dependent on virus replication and is counteracted by ICP27 targeting NF-kappaB and IRF-3. J Gen Virol. 2006;87:1099-1108. [PubMed] |
| 14. | Hou W, Wang X, Ye L, Zhou L, Yang ZQ, Riedel E, Ho WZ. Lambda interferon inhibits human immunodeficiency virus type 1 infection of macrophages. J Virol. 2009;83:3834-3842. [PubMed] [DOI] |
| 15. | Hong SH, Cho O, Kim K, Shin HJ, Kotenko SV, Park S. Effect of interferon-lambda on replication of hepatitis B virus in human hepatoma cells. Virus Res. 2007;126:245-249. [PubMed] |
| 16. | Ochi H, Maekawa T, Abe H, Hayashida Y, Nakano R, Imamura M, Hiraga N, Kawakami Y, Aimitsu S, Kao JH. IL-28B predicts response to chronic hepatitis C therapy--fine-mapping and replication study in Asian populations. J Gen Virol. 2011;92:1071-1081. [PubMed] [DOI] |
| 17. | Chen JY, Lin CY, Wang CM, Lin YT, Kuo SN, Shiu CF, Chang SW, Wu J, Sheen IS. IL28B genetic variations are associated with high sustained virological response (SVR) of interferon-α plus ribavirin therapy in Taiwanese chronic HCV infection. Genes Immun. 2011;12:300-309. [PubMed] [DOI] |
| 18. | Lyoo K, Song MJ, Hur W, Choi JE, Hong SW, Kim CW, Bae SH, Choi JY, Choi SW, Shin EC. Polymorphism near the IL28B gene in Korean hepatitis C virus-infected patients treated with peg-interferon plus ribavirin. J Clin Virol. 2011;52:363-366. [PubMed] [DOI] |
| 19. | Ito K, Higami K, Masaki N, Sugiyama M, Mukaide M, Saito H, Aoki Y, Sato Y, Imamura M, Murata K. The rs8099917 polymorphism, when determined by a suitable genotyping method, is a better predictor for response to pegylated alpha interferon/ribavirin therapy in Japanese patients than other single nucleotide polymorphisms associated with interleukin-28B. J Clin Microbiol. 2011;49:1853-1860. [PubMed] [DOI] |
| 20. | Imazeki F, Yokosuka O, Omata M. Impact of IL-28B SNPs on control of hepatitis C virus infection: a genome-wide association study. Expert Rev Anti Infect Ther. 2010;8:497-499. [PubMed] [DOI] |