修回日期: 2012-12-31
接受日期: 2013-01-05
在线出版日期: 2013-01-18
目的: 了解食管癌发生过程中的炎症改变.
方法: 采用100 μg/mL的4NQO通过饮水作用于C57BL/6小鼠, 分别通过食管拉网脱落细胞法、碘染色法及病理组织学观察第12、16、20、24周等时间段的C57BL/6小鼠食管鳞状细胞癌建模病理的改变.
结果: 食管拉网脱落细胞法、碘染色法均未观察到小鼠早期食管病变, 在实验第12周, 纵向解剖食管, 通过病理组织学观察到食管上皮不典型增生, 第16、20、24周分别观察到原位癌、浸润性鳞癌的发生, 在整个肿瘤的发生、发展过程中伴随炎症细胞浸润.
结论: 食管拉网脱落细胞法、碘染色法不适用于C57BL/6小鼠食管鳞癌建模形态学观察, 只能通过病理组织学才能够在不同的时间段观察到食管癌的发生、发展及其炎症改变过程.
引文著录: 杜展, 王超, 张勇, 马继伟, 闫雍容, 王绍祥, 钟雪云. C57BL/6小鼠食管鳞状细胞癌早期病变的形态学改变. 世界华人消化杂志 2013; 21(2): 116-121
Revised: December 31, 2012
Accepted: January 5, 2013
Published online: January 18, 2013
AIM: To dynamically observe the morphology of early lesions of esophageal squamous cell carcinoma (ESCC) in C57BL/6 mice.
METHODS: ESCC was induced in C57BL/6 mice by giving drinking water containing 100 μg/mL of 4-nitroquinoline-1-oxide. During the experiment period, the morphology of early lesions of ESCC was observed by esophageal exfoliated cytology, iodine staining, observation with naked eyes, and histological assessment at weeks 12, 16, 20 and 24 after induction of ESCC.
RESULTS: Early esophageal lesions could not be observed by esophageal exfoliated cytology or iodine staining. Esophageal epithelial dysplasia was observed by longitudinally dissecting the esophagus at week 12. In situ carcinoma and invasive cancer were observed at weeks 16, 20, and 24. Inflammation existed during the entire process of the development of ESCC.
CONCLUSION: Histopathological techniques, not esophageal exfoliated cytology or iodine staining, are suitable for observing the morphology of early ESCC lesions in C57BL/6 mice.
- Citation: Du Z, Wang C, Zhang Y, Ma JW, Yan YR, Wang SX, Zhong XY. Morphology of early lesions of esophageal squamous cell carcinoma in C57BL/6 mice. Shijie Huaren Xiaohua Zazhi 2013; 21(2): 116-121
- URL: https://www.wjgnet.com/1009-3079/full/v21/i2/116.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i2.116
食管癌是最常见的八大恶性肿瘤之一[1], 2008年全球新增病例482 300例, 死亡406 800例[2,3]. 由于早期症状不明显, 大多数食管癌患者确诊时已经是中晚期, 失去最佳治疗时机, 预后极差[4]. 因此, 食管癌的早期诊断对于改善预后非常必要. 在动物整体水平建立真实模拟人类疾病的动物模型, 对理解疾病发生发展至关重要[5,6]. 食管癌的动物模型是研究肿瘤发生的病因、发病机制、药物新靶点发现及药物干预的重要手段[7-10]. 已证实多种亚硝胺能诱发大鼠食管癌, 时间需1年以上, 但未能成功诱发小鼠食管癌. 有报道[11,12]采用水溶性化合物4-硝基喹啉-1-氧化物(4-nitroquinoline-1-oxide, 4NQO)成功诱导小鼠食管鳞状细胞癌发生, 但未能观察到食管浸润性癌发生前的早期病理改变. 食管拉网脱落细胞涂片在食管癌普查中应用广泛[13,14]、碘染色法结合胃镜检查在食管癌早期诊断中发挥重要作用[15,16]. 为此, 我们尝试模拟人食管癌筛查手段, 探讨能够更早期观察到小鼠食管癌病理形态学改变的方法, 同时进一步揭示肿瘤发生过程中的炎症变化情况.
6周龄♀C57BL/6小鼠60只, 体质量16-20 g(广东省实验动物中心提供, 实验动物质量合格证明号: 0097337), SPF级. 在室温20 ℃-25 ℃, 湿度40%-60%, 24 h自然光暗循环条件下以标准固体饲料喂养(广东省实验动物中心提供), 自制微型棉签. 试剂4-硝基喹啉-1-氧化物(4-nitroquinoline-1-oxide, 4NQO)(日本TCI公司 CAS: 56-57-5); 丙二醇(propylene glycol)(天津富宇); 2.5%碘溶液(广州齐云).
1.2.1 溶液配制: 4NQO溶解于丙二醇配制成5 mg/mL浓度作为储存液, 避光保存于4 ℃. 喂养小鼠时, 1 mL 4NQO储存液(5 mg/mL)和49 mL灭菌蒸馏水混合配制成100 μg/mL 4NQO水溶液, 置于避光饮水瓶中. 1 mL丙二醇和49 mL灭菌蒸馏水混合配制成丙二醇水溶液, 每周一换. 对照组: 在暴露期内饮用含相同浓度的丙二醇水溶液.
1.2.2 食管癌模型建立: 参考文献[12], 60只小鼠随机分为2组, 处理组50只, 对照组10只. 处理组小鼠在致癌原暴露期内自由饮用100 μg/mL 4NQO水溶液16 wk, 之后改用普通灭菌水喂养. 于第12、16、20周处死小鼠3只, 至第24周全部处死, 对照组小鼠饮用含相同浓度的丙二醇水溶液16 wk, 之后改用普通灭菌水喂养, 于第12、16、20周各处死1只, 至第24周全部处死.
1.2.3 食管拉网脱落细胞涂片: 用灌胃器结合自制微型棉签模拟食管拉网方法, 在食管采集脱落细胞进行涂片, 滴加950 mL/L乙醇固定, 进行HE染色后镜下观察.
1.2.4 碘染色: 处死小鼠取食管纵向剖开, 2.5%碘溶液滴至全段食管1 min后流水冲洗.
1.2.5 病理组织学: 通过肉眼及镜下观察食管的病理改变.
1.2.6 一般情况: 每天观察室内温度、湿度变化, 小鼠活动度、对刺激的反应灵敏度, 进食、饮水量及毛色、粪便等情况, 每周记录小鼠的进食、饮水量、体质量.
1.2.7 脱落细胞涂片观察: 各时间点采集食管脱落细胞涂片固定, HE染色后镜下观察.
1.2.8 碘染色观察: 各时间点处死小鼠后, 分离食管, 从食管起始部位用眼科剪纵向剖开食管, 并用碘溶液对全段食管染色.
1.2.9 大体观察: 各时间点处死小鼠后, 完整分离舌、食管、胃, 心、肝、脾、肺、肾等脏器, 观察食管全段外观、纵向剖开后管腔内部黏膜以及各脏器的变化.
1.2.10 组织病理学: 10%的中性甲醛溶液固定24 h, 常规脱水, 石蜡包埋, 4 μm切片, 采用HE染色, 进行组织病理学观察.
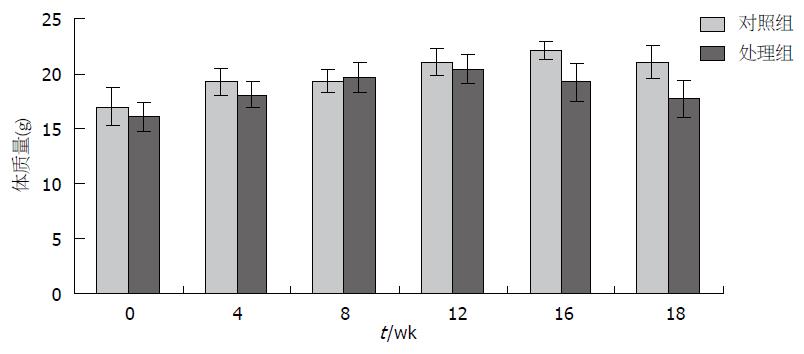
实验小鼠共60只, 分别在第12、16、20周处死小鼠4只, 5只小鼠实验过程中意外死亡, 余下43只小鼠于第24周全部处死. 实验进行至第12周时, 处理组与对照组在活动度、毛发光泽度、进食、饮水无明显差异. 随着时间延长, 处理组小鼠活动度逐渐弱于对照组, 毛发失去光泽, 呈微黄色(4NQO为黄色), 粪便颜色微黄, 尿液呈深黄色. 12、16、20、24 wk对照组体质量分别为21.0 g±1.2 g、22.1 g±0.8 g、21.3 g±1.7 g、23.3 g±0.9 g; 处理组体质量分别为20.3 g±1.4 g; 19.4 g±2.0 g、16.4 g±2.6 g、15.2 g±1.5 g(图1). 图中12 wk以前对照组与处理组小鼠体质量均呈增加趋势, 12 wk后对照组体质量持续增加, 而处理组小鼠体质量在第12周达到峰值, 之后体质量下降, 第16-20周体质量降幅最大. 16 wk后两组小鼠体质量差异有统计学意义(P<0.01).
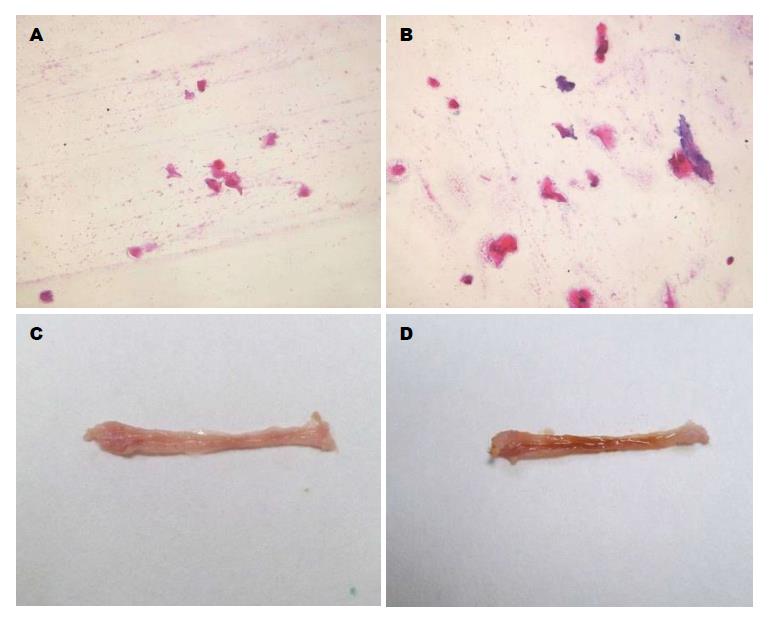
镜下各个视野无细胞, 见零散分布的均质、红染片状物, 考虑为角化物(图2).
经染色、流水冲洗后, 食管正常黏膜及病变部位均染色较深, 无明显色差(图2).
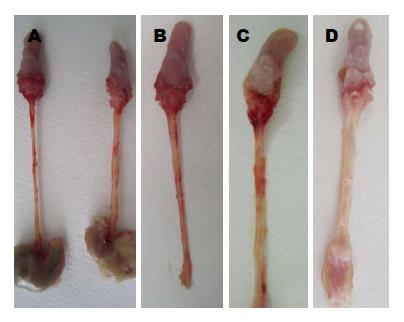
对照组及处理组小鼠食管大体形态(图3). 对照组小鼠食管长2.5-3.0 cm, 食管上段管径约0.1 cm, 下段稍粗, 管径约0.15 cm, 黏膜光滑呈半透明状, 无充血, 皱襞无中断, 食管中上部黏膜薄, 近贲门处管壁略厚, 第12周, 处理组小鼠食管无增粗, 纵向剖开可见食管下段黏膜粗糙, 少许黏膜皱襞中断, 部分区域充血, 管腔内无新生物生成; 16 wk时, 食管增粗, 平均直径0.2 cm, 黏膜区域性增厚、粗糙, 无坏死及出血. 20 wk时处理组小鼠食管明显增粗, 黏膜弥漫性增厚, 管腔内可见1-3个新生物散在分布, 直径0.1-0.2 cm 24 wk时, 食管下段管径平均0.2-0.3 cm, 管壁僵硬、变形, 局部可见膨隆, 眼科剪不能顺利伸入管腔, 管腔内充满一至数个乳头状、菜花状、突向管腔或向管壁浸润生长的灰白色新生物, 质硬, 触之出血, 新生物直径最小0.1 cm, 最大者约0.4 cm, 部分小鼠管腔完全堵塞, 见出血及溃疡形成.
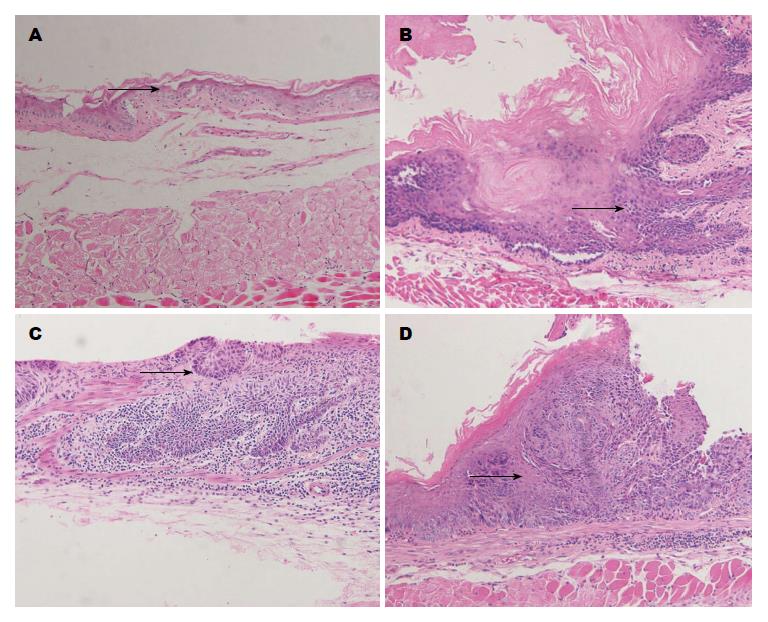
小鼠食管黏膜被覆鳞状上皮, 角化层厚, 由浅至深依次为角化层, 颗粒细胞层、棘细胞层, 基底细胞层, 黏膜下有少量淋巴细胞、浆细胞浸润. 随着4NQO摄入时间延长, 处理组小鼠食管在不同时期经历单纯性上皮增生-非典型增生-原位癌-浸润性鳞癌的病理变化(图4). 12 wk时出现单纯性上皮增生, 上皮钉突延长, 表现为棘细胞层及细胞数增多, 细胞无异型性, 基底细胞单层, 排列整齐, 间质淋巴细胞增多. 16 wk时可见异常增生, 棘细胞层肥厚, 细胞大小不一、排列紊乱. 局部区域角化层中断, 基底细胞增生, 排列紊乱, 细胞异型程度加重, 胞核呈多形性, 病理性核分裂增多, 基膜尚完整, 表现为原位癌的病理改变. 间质出现中性粒细胞、浆细胞、淋巴细胞浸润. 实验进行至第24周时食管鳞状细胞癌发生率为100%. 其中3例为原位癌、30例浸润至黏膜下, 3例浸润至肌层. 肿瘤外生性和/或浸润性生长, 形成癌巢, 中心可见角化珠. 细胞重度异型, 层次紊乱, 核染色质增多、粗糙, 出现多种病理性核分裂. 间质血管丰富, 大量炎细胞浸润. 不典型增生和原位癌时期可见淋巴细胞、中性粒细胞浸润, 发展至浸润性癌时炎症细胞浸润以淋巴细胞、浆细胞为主.
对处理组小鼠其他脏器包括: 胃、胰腺、心、肝、脾、肺、肾进行大体及组织学观察, 未发现原发性肿瘤及转移病灶.
4NQO是一种水溶性的喹啉衍生物[17], 摄入体内后, 在4NQO还原酶的作用下通过氧化还原反应, 形成近致癌物4-羟氨基喹啉-1-氧化物, 经脯氨酰基化作用代谢为终致癌物4-乙酰氨基喹啉-1-氧化物, 最后与靶器官DNA亲核结构结合, 形成DNA加成物, 使鼠第7号染色体上H-ras1基因第12位密码子发生G→A转换, 致组织发生癌变[18-21]. 其中4NQO还原酶起关键作用, 该酶在舌、食管黏膜分布较多[19], 使得4NQO具有对舌、食管的特异靶向性. 早期4NQO多用于口腔癌模型构建中[22], Tang等[11]利用4NQO构建了舌癌和食管癌模型, 研究4NQO对CBA和C57BL/6小鼠致瘤率的差异; 我国陈慧等[12]用类似方法建立舌癌及食管癌模型, 但未能观察致癌过程中食管管腔内部的大体形态变化. 我们尝试无创模拟人食管癌筛查方法, 利用食管拉网脱落细胞涂片以及对小鼠离体食管纵向剖开后采用碘染色法, 观察早期食管黏膜病变, 从病理形态学角度对食管癌的发生过程及伴随的炎症改变进行深入研究.
食管拉网是利用网囊食管细胞采取器获得食管黏膜脱落细胞进行病理细胞学检查的一种简便可靠方法[23], 是我国食管癌高发区普查的重要手段[24]; 内镜下食管黏膜碘染色, 有助于发现早期食管癌[25-28], 机制为: 正常人食管鳞状上皮细胞内及细胞间隙含有大量糖原, 糖原遇碘后呈棕色的着色反应. 若因肿瘤、炎症等造成食管黏膜细胞内的糖原丧失或减少, 呈现不染色或染色不良的区域[29,30], 利用此特点可以鉴别轻微的食管黏膜病变. 实验中我们拟通过模拟人食管拉网无创方式及剖开食管进行碘染色以发现小鼠早期食管病变, 但由于小鼠食管上皮为很厚的角化鳞状上皮这一有别于人食管的特殊结构, 导致棉签无法采集到上皮细胞, 涂片结果为红染的角化物; 此外, 我们以自制微型棉签代替网囊食管细胞采取器进行细胞采集, 操作难度较大, 不利于细胞采集. 在后续的研究中, 如能开发动物微型内窥镜技术, 更直观观察食管病变情况, 将对食管癌动物模型研究具有深远意义. 碘染色实验同样因为食管角化, 无法通过碘的着色区分出正常黏膜和病变部位. 提示食管拉网脱落细胞法、碘染色法不适用于观察小鼠食管鳞癌的早期病变过程.
我们在不同时间点处死小鼠, 对食管纵向解剖, 肉眼及镜下观察肿瘤的动态发生过程. 实验中我们观察到第12周时处理组小鼠体质量开始下降, 第16-20周降幅最为明显. 第12周处死小鼠, 纵向解剖食管后肉眼观察到小鼠食管黏膜粗糙、增厚, 镜下可见食管上皮已经发生不典型增生, 第16周和第20周我们进一步观察到了小鼠食管经历了原位癌-浸润性鳞癌逐步进展的经典上皮肿瘤发生过程, 至第24周时小鼠食管出现肉眼可见的肿物, 组织学诊断鳞癌发生率为100%, 在整个过程中伴随炎症细胞的浸润, 随着时间延长, 炎症细胞浸润加剧. 陈慧等[12]仅在第24周时观察到食管早期浸润性鳞癌的发生, 而我们提前4 wk观察到食管早期癌前病变的发生, 这可能与我们纵向解剖食管, 更直观的观察到食管管腔内部的变化有关. 结合小鼠一般情况、体质量、肉眼及组织学变化, 该模型在整体水平生动反应出小鼠体内肿瘤的发展过程, 以上结果可能提示第12周之前是4NQO在体内不断诱导DNA发生突变的过程, 当突变累积到一定程度时, 便启动肿瘤产生, 从而真实再现了食管癌发生的动态过程.
正常食管黏膜存在一定数量淋巴细胞、浆细胞等以发挥正常的免疫作用, 通过该模型我们发现在不典型增生和原位癌时期舌和食管病变区域出现大量炎细胞浸润, 发展至浸润性癌时炎症细胞浸润以淋巴细胞为主, 随着病变加重, 炎症细胞浸润越明显, 提示我们肿瘤发生的同时启动了机体免疫系统. 大量研究表明[31-33]: 炎症是肿瘤发展的重要因素, 炎症细胞通过为肿瘤微环境提供多种生物活性分子促进肿瘤进程, 因而成为肿瘤发生早期的证据之一.
食管癌动物模型的建立为食管癌治疗提供了重要的研究平台. 给药方式的选择对药物的疗效可能会产生不同的后果. 值得一提的是, 我们在随后的研究中, 进行了尾静脉注射给药, 但成功率不高, 分析其原因, 可能因为C57BL/6小鼠尾部角化明显, 随着鼠龄延长, 角化增厚; 且尾静脉行走于尾骨中间. 由于其尾巴特殊的生理结构, 对幼鼠尚可行尾静脉注射, 而成年鼠尾静脉注射比较困难. 故进行药物实验时, 对需要静脉注射药物的给药方式提出了挑战, 需要较高的尾静脉注射技术, 这是实验设计必须考虑的问题之一.
总之, 利用4NQO构建的C57BL/6小鼠食管鳞状细胞癌疾病动物模型, 建模时间短、方法简单、成瘤率高. 食管拉网脱落细胞法、碘染色法不适用于食管鳞癌的早期病变观察, 病理组织学能更早期观察到食管癌的发生及其炎症改变, 从而为以后的动物模型研究提供经验和借鉴.
通过建立小鼠食管癌模型, 探讨观察早期小鼠食管癌病理形态学改变的方法及肿瘤的发生过程, 对研究食管癌发生早期的分子机制及对肿瘤的预防、阻断起到桥梁作用.
张志坚, 教授, 福州总医院消化内科
4NQO诱导的小鼠食管癌模型建模方法简单、诱导过程自然, 能模拟人食管癌发生的动态过程, 已广泛应用于食管癌发生机制及预防的研究中, 开展无创方法对肿瘤模型进行动态追踪并进行早期诊断, 在食管癌研究领域具有广阔前景.
Fong等利用4NQO建立小鼠食管癌模型对Zn在肿瘤发生中的作用进行了深入研究, 发现充足的Zn摄入在食管癌建模过程对小鼠具有保护作用, 阐明了Zn缺乏通过激活S100A8炎症通路, 参与小鼠食管癌的发生发展.
本文将人食管癌筛查方法引入动物模型研究中, 对食管进行纵向解剖, 结合病理形态学, 更早期、动态观察到食管癌的发生发展, 并揭示食管癌发生过程中伴随的炎症改变.
食管拉网脱落细胞法、碘染色法不适用于小鼠食管鳞癌的早期病变观察.通过纵向解剖食管, 病理组织学, 更直观、早期地观察到食管癌的发生过程, 提出小鼠与人的食管在生理结构上的差别以及实验设计时需注意的问题, 为以后的食管癌动物模型研究提供经验和借鉴.
本文实验方法较科学, 结果可信, 结论客观, 具有一定指导价值.
编辑: 田滢 电编: 闫晋利
| 2. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 3. | Wheeler JB, Reed CE. Epidemiology of esophageal cancer. Surg Clin North Am. 2012;92:1077-1087. [PubMed] [DOI] |
| 4. | Holmes RS, Vaughan TL. Epidemiology and pathogenesis of esophageal cancer. Semin Radiat Oncol. 2007;17:2-9. [PubMed] |
| 6. | Opitz OG, Quante M, von Werder A, Heeg S, Blum HE. A mouse model of oral-esophageal carcinogenesis. Onkologie. 2005;28:44-48. [PubMed] |
| 7. | Miyamoto S, Yasui Y, Kim M, Sugie S, Murakami A, Ishigamori-Suzuki R, Tanaka T. A novel rasH2 mouse carcinogenesis model that is highly susceptible to 4-NQO-induced tongue and esophageal carcinogenesis is useful for preclinical chemoprevention studies. Carcinogenesis. 2008;29:418-426. [PubMed] [DOI] |
| 8. | Fong LY, Jiang Y, Rawahneh ML, Smalley KJ, Croce CM, Farber JL, Huebner K. Zinc supplementation suppresses 4-nitroquinoline 1-oxide-induced rat oral carcinogenesis. Carcinogenesis. 2011;32:554-560. [PubMed] [DOI] |
| 9. | Wan SG, Taccioli C, Jiang Y, Chen H, Smalley KJ, Huang K, Liu XP, Farber JL, Croce CM, Fong LY. Zinc deficiency activates S100A8 inflammation in the absence of COX-2 and promotes murine oral-esophageal tumor progression. Int J Cancer. 2011;129:331-345. [PubMed] [DOI] |
| 10. | Fong LY, Zhang L, Jiang Y, Farber JL. Dietary zinc modulation of COX-2 expression and lingual and esophageal carcinogenesis in rats. J Natl Cancer Inst. 2005;97:40-50. [PubMed] |
| 11. | Tang XH, Knudsen B, Bemis D, Tickoo S, Gudas LJ. Oral cavity and esophageal carcinogenesis modeled in carcinogen-treated mice. Clin Cancer Res. 2004;10:301-313. [PubMed] |
| 12. | 陈 慧, 高 鑫, 李 刚, 王 凤鸣, 孙 静, 刘 柳, 卢 斌峰, 张 学光. 4NQO诱发C57BL/6小鼠舌癌及食管鳞状细胞癌模型的建立. 苏州大学学报(自然科学版). 2010;30:972-974. |
| 13. | Greenebaum E, Schreiber K, Shu YJ, Koss LG. Use of the esophageal balloon in the diagnosis of carcinomas of the head, neck and upper gastrointestinal tract. Acta Cytol. 1984;28:9-15. [PubMed] |
| 16. | Fukuhara T, Hiyama T, Tanaka S, Oka S, Yoshihara M, Arihiro K, Chayama K. Natural course of lugol-voiding lesions in patients with superficial esophageal squamous cell carcinoma. Digestion. 2010;82:60-65. [PubMed] [DOI] |
| 17. | Hawkins BL, Heniford BW, Ackermann DM, Leonberger M, Martinez SA, Hendler FJ. 4NQO carcinogenesis: a mouse model of oral cavity squamous cell carcinoma. Head Neck. 1994;16:424-432. [PubMed] |
| 18. | Silva RN, Ribeiro DA, Salvadori DM, Marques ME. Placental glutathione S-transferase correlates with cellular proliferation during rat tongue carcinogenesis induced by 4-nitroquinoline 1-oxide. Exp Toxicol Pathol. 2007;59:61-68. [PubMed] |
| 19. | Booth DR. A relationship found between intra-oral sites of 4NQO reductase activity and chemical carcinogenesis. Cell Tissue Kinet. 1990;23:331-340. [PubMed] |
| 20. | Kanojia D, Vaidya MM. 4-nitroquinoline-1-oxide induced experimental oral carcinogenesis. Oral Oncol. 2006;42:655-667. [PubMed] |
| 21. | Makita H, Tanaka T, Fujitsuka H, Tatematsu N, Satoh K, Hara A, Mori H. Chemoprevention of 4-nitroquinoline 1-oxide-induced rat oral carcinogenesis by the dietary flavonoids chalcone, 2-hydroxychalcone, and quercetin. Cancer Res. 1996;56:4904-4909. [PubMed] [DOI] |
| 22. | Ohne M, Omori K, Kobayashi A, Sakurada Y, Sekigawa K, Mochizuki A, Takaki T, Tachikawa T, Muramatsu H, Nagai Y. Induction of squamous cell carcinoma in the oral cavity of rats by oral administration of 4-nitroquinoline-1-oxide (4NQO) in drinking water. A preliminary report. Bull Tokyo Dent Coll. 1981;22:85-98. [PubMed] |
| 23. | Bird-Lieberman EL, Fitzgerald RC. Early diagnosis of oesophageal cancer. Br J Cancer. 2009;101:1-6. [PubMed] [DOI] |
| 24. | 王 凤荣, 张 祥宏, 严 霞, 王 俊灵, 李 绍森, 林 培中, 路 灵敏, 孙 旭明, 杨 永滨, 李 月红. 食管癌高发区居民口腔细胞学状况及其与食管脱落细胞学相关性的研究. 肿瘤研究与临床. 2006;18:779-781. |
| 26. | McMahon J, Devine JC, McCaul JA, McLellan DR, Farrow A. Use of Lugol's iodine in the resection of oral and oropharyngeal squamous cell carcinoma. Br J Oral Maxillofac Surg. 2010;48:84-87. [PubMed] [DOI] |
| 27. | Tincani AJ, Brandalise N, Andreollo NA, Lopes LR, Montes CG, Altemani A, Martins AS. [Importance of upper digestive endoscopy using lugol dye solution for the diagnosis of superficial esophageal cancer and dysplasia in patients with head and neck neoplasms]. Arq Gastroenterol. 2000;37:107-113. [PubMed] |
| 29. | Ghotli ZA, Serra S, Chetty R. Clear cell (glycogen rich) gastric adenocarcinoma: a distinct tubulo-papillary variant with a predilection for the cardia/gastro-oesophageal region. Pathology. 2007;39:466-469. [PubMed] |
| 30. | Micev M, Cosić-Micev M. [Pathology and pathobiology of the oesophageal carcinoma]. Acta Chir Iugosl. 2010;57:15-26. [PubMed] |
| 31. | Liu L, Wang S, Shan B, Shao L, Sato A, Kawamura K, Li Q, Ma G, Tagawa M. IL-27-mediated activation of natural killer cells and inflammation produced antitumour effects for human oesophageal carcinoma cells. Scand J Immunol. 2008;68:22-29. [PubMed] [DOI] |