修回日期: 2013-04-08
接受日期: 2013-04-12
在线出版日期: 2013-05-18
目的: 探讨胃液、血清中层黏连蛋白(laminin, LN)、Ⅲ型前胶原氨端(N-terminal procollagen Ⅲ peptide, PⅢNP)含量的检测在胃癌辅助诊断中的价值.
方法: 采用放射免疫法测定50例胃癌患者、25例癌前病变患者胃液和血清中PⅢNP和LN含量, 以46例浅表性胃炎患者作为对照.
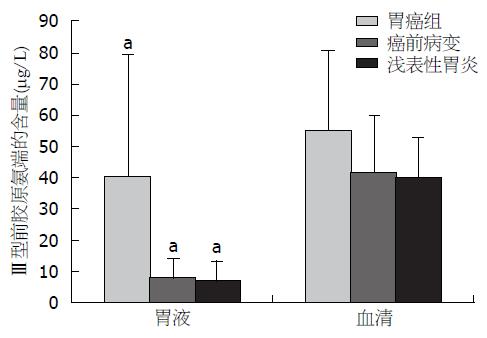
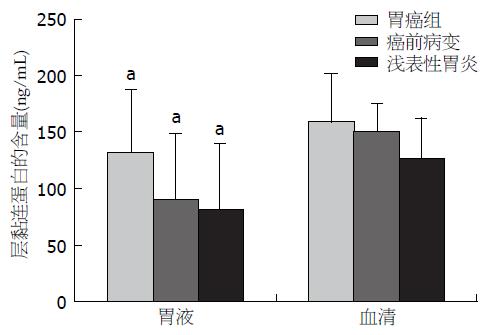
结果: 胃癌组患者胃液中PⅢNP含量显著高于癌前病变组和对照组(40.49 μg/L±39.07 μg/L vs 8.49 μg/L±5.45 μg/L, 7.38 μg/L±6.13 μg/L, 均P<0.01), LN的水平也显著高于癌前病变组和对照组(131.61 ng/mL±55.71 ng/mL vs 90.92 ng/mL±58.36 ng/mL, 80.65 ng/mL±59.43 ng/mL, P<0.05; P<0.01); 胃癌组血清中PⅢNP含量明显高于癌前病变组和对照组(55.38 μg/L±25.13 μg/L vs 41.56 μg/L±18.27 μg/L, 39.89 μg/L±13.07 μg/L, 均P<0.05), LN的水平亦显著高于对照组(158.62 ng/mL±42.70 ng/mL vs 126.25 ng/mL±36.18 ng/mL, P<0.01). 胃液PⅢNP和LN单独检测对胃癌诊断的敏感性分别为68.00%、66.00%, 二者联合检测其敏感性为86.00%. 进一步分析显示, 伴有淋巴结或器官转移的患者胃液和血清中PⅢNP和LN水平高于不伴有转移的患者; PⅢNP和LN水平与病理分级相关, 低分化腺癌患者胃液、血清中PⅢNP和LN含量高于高分化腺癌患者.
结论: 胃液及血清PⅢNP和LN含量的检测在胃癌的辅助诊断中有一定临床价值.
核心提示: 联合检测胃液中Ⅲ型前胶原氨端(N-terminal procollagen Ⅲ peptide)和层黏连蛋白(laminin, LN)含量可提高对胃癌诊断的敏感性, 故可用于胃癌的筛查. 同时, 由于这两项标志物与肿瘤的浸润、分化、转移之间有一定的联系, 故对研究胃癌的活动有一定的指示意义.
引文著录: 高源, 洪汝涛. 血清和胃液PⅢNP、LN在胃癌辅助诊断中的价值. 世界华人消化杂志 2013; 21(14): 1315-1320
Revised: April 8, 2013
Accepted: April 12, 2013
Published online: May 18, 2013
AIM: To investigate the clinical significance of laminin (LN) and procollagen Ⅲ N-terminal peptide (PⅢNP) levels in serum and gastric juice in the diagnosis of gastric cancer.
METHODS: Fifty patients with gastric cancer, 25 patients with gastric precancerous lesions, and 46 patients with mild superficial gastritis were included in this study. The levels of PⅢNP and LN in gastric juice and serum were determined by radioimmunoassay and compared among different groups of patients.
RESULTS: The levels of PⅢNP in gastric juice and serum were significantly higher in patients with gastric cancer than in those with precancerous lesion or mild superficial gastritis (gastric juice: 40.49 μg/L ± 39.07 μg/L vs 8.49 μg/L ± 5.45 μg/L, 7.38 μg/L ± 6.13 μg/L, both P < 0.01; serum: 55.38 μg/L ± 25.13 μg/L vs 41.56 μg/L ± 18.27 μg/L, 39.89 μg/L ± 13.07 μg/L, both P < 0.05). The levels of LN in gastric juice were significantly higher in patients with gastric cancer than in patients with precancerous lesion or mild superficial gastritis (131.61 ng/mL ± 55.71 ng/mL vs 90.92 ng/mL ± 58.36 ng/mL, 80.65 ng/mL ± 59.43 ng/mL, P < 0.05, P < 0.01), and the levels of LN in serum were significantly higher in patients with gastric cancer than in patients with mild superficial gastritis (158.62 ng/mL ± 42.70 ng/mL vs 126.25 ng/mL ± 36.18 ng/mL, both P < 0.01). The sensitivity of PⅢNP and LN in gastric juice for the diagnosis of gastric cancer was 68.00% and 66.00%, respectively, and the sensitivity of combined detection of PⅢNP and LN was 86.00%. The levels of LN and PⅢNP in serum and gastric juice were higher in gastric cancer patients with lymph node metastasis than in those without metastasis. The levels of PⅢNP and LN were related to histologic grade of carcinoma, and patients with poorly differentiated adenocarcinoma had higher levels of PⅢNP and LN in serum and gastric juice than those with well differentiated adenocarcinoma.
CONCLUSION: The levels of LN and PⅢNP in serum and gastric juice can be considered as an adjunct in the diagnosis of gastric cancer.
- Citation: Gao Y, Hong RT. Laminin and procollagen Ⅲ N-terminal peptide in serum and gastric juice as potential tumor markers for gastric cancer. Shijie Huaren Xiaohua Zazhi 2013; 21(14): 1315-1320
- URL: https://www.wjgnet.com/1009-3079/full/v21/i14/1315.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i14.1315
层黏连蛋白(laminin, LN)主要存在于基底膜结构中, 是基底膜主要成分[1]. Ⅲ型前胶原氨端(N-terminal procollagen Ⅲ peptide, PⅢNP)是由分泌到细胞外的Ⅲ型前胶原在向Ⅲ型胶原转化的过程中经氨基端肽酶裂解所产生的氨基端多肽[2]. LN和PⅢNP在临床上常用于肝纤维化的评估, 有文献报道血清中LN和PⅢNP在胃癌辅助诊断和预后中的价值, 但目前尚缺乏胃癌、癌前病变患者胃液中LN和PⅢNP的相关资料. 为此, 我们联合检测胃癌、癌前病变患者胃液、血清中LN和PⅢNP水平, 以浅表性胃炎患者作为对照, 以探讨这两种标志物在胃癌辅助诊断中的意义.
选取2011-09/2012-01就诊于我院消化科门诊的患者, 胃镜结合病理证实为胃癌或癌前病变(包括萎缩性胃炎、不典型增生和肠上皮化生), 且在胃镜检查前均未接受内镜治疗、外科手术、放疗、化疗、生物疗法等相关治疗. 对照组选择为有轻微的消化系症状, 胃镜显示浅表性胃炎者. 对于有肿瘤病史、上消化道出血、慢性肝病、慢性炎症性疾病(如关节炎等)患者均被排除. 最后共121例入组, 分别为50例胃癌患者, 男42例, 女8例, 年龄为35-80岁(61.02岁±13.36岁); 25例癌前病变患者, 男11例, 女14例, 年龄为45-76岁(60.57岁±7.23岁); 46例浅表性胃炎患者, 男18例, 女28例, 年龄为25-65岁(40.35岁±20.57岁).
1.2.1 抽样: 受检者于清晨空腹时接受胃镜检查. 操作者经胃镜的活检孔吸取胃液5 mL, 并立即放入一次性离心管中. 剔除混有血液或胆汁的标本. 用精确pH试纸测量胃液的pH值, 然后用1 mol/L的NaOH将其pH调整至7-8之间. 胃镜检查后, 收集患者静脉血5 mL. 胃液和血液标本经3000 r/min离心10 min后取上清液并存于-80 ℃冰箱待测.
1.2.2 LN和PⅢNP含量的测量: 采用放射性免疫法测定胃液和血清中LN和PⅢNP含量, 试剂盒由北京北方生物技术研究所提供, 125I标记, 所有标本均由我院核医学科同一专业人员用同一批次试剂严格按说明书检测.
统计学处理 采用SPSS13.0统计软件分析, 计量资料以mean±SD表示. 3组数据进行比较时, 采用方差分析, 若方差是齐性时应用LSD法, 方差不齐时应用Dunnett's T3检验. 两组间的比较用t检验. 变量间相关性分析采用Pearson相关分析. P<0.05视为有统计学意义.
胃癌组PⅢNP含量明显高于癌前病变组和对照组(均P<0.01); 胃癌组LN水平也显著高于癌前病变组和对照组(分别为P<0.05; P<0.01); 癌前病变组和对照组之间的差异无统计学意义(P>0.05)(表1).
胃癌组PⅢNP含量明显高于癌前病变组和对照组(均P<0.05); 胃癌组LN的水平也显著高于对照组(P<0.01), 但LN水平在胃癌组和癌前病变组中尚未见显著差异, 癌前病变组和对照组差异亦无统计学意义(P>0.05)(表2).
无论是在胃癌组、癌前病变组还是对照组, 血清中PⅢNP和LN的水平均高于胃液(均P<0.05)(图1, 2). 以对照组总体均数的95%可信区间上限作为阳性, 确定血清和胃液PⅢNP和LN阳性参考阈值, 计算出胃液中PⅢNP和LN浓度分别为12.61 μg/L、98.30 ng/mL, 胃液PⅢNP和LN检测对胃癌的敏感性分别为68.00%和66.00%, 联合检测的敏感性比PⅢNP和LN单独检测有所提高, 差异具有统计学意义(P<0.05), 而特异性下降, 差异无统计学意义(P>0.05)(表3).
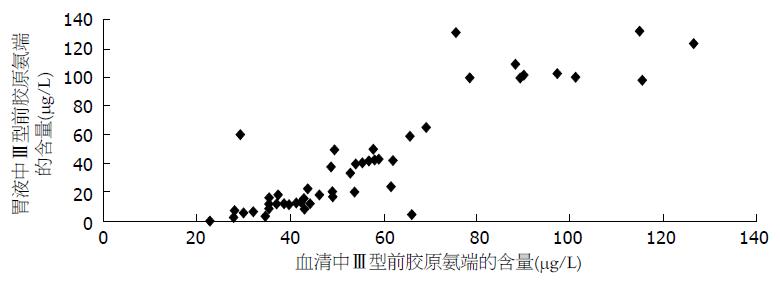
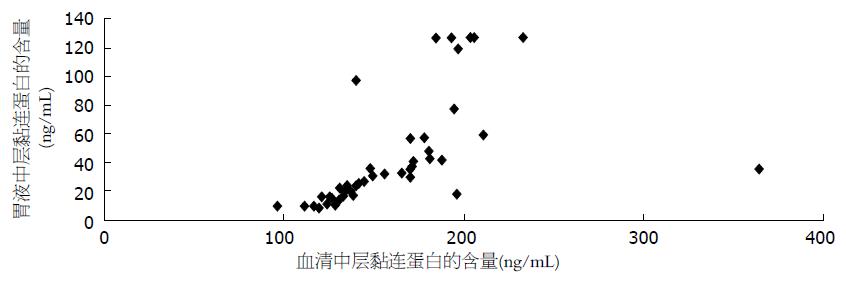
胃癌患者胃液中的PⅢNP水平与血清中PⅢNP水平呈正线性相关, Pearson相关系数为0.893, P<0.01(图3). 胃癌患者胃液中的LN水平与血清中LN水平亦呈正线性相关, Pearson相关系数为0.750, P<0.01(图4). 可见, 胃液中的PⅢNP、LN水平高者, 血清中PⅢNP、LN水平可能也随之升高.
如表4所示, 伴有淋巴结或器官转移的患者胃液中PⅢNP和LN水平高于不伴有转移的患者. 同时PⅢNP和LN水平与病理分级相关, 低分化腺癌较高分化腺癌而言, PⅢNP和LN含量更高. 而这两种标志物与患者的年龄和性别之间未发现明显相关性. 表5显示了血清中PⅢNP和LN与以上因素之间的关系, 结果与胃液的检测结果相似, 血清中PⅢNP和LN水平也与肿瘤的病理分级和有无转移有关, 而与年龄、性别无明显关联.
| 临床特征 | n | PⅢNP(μg/L) | P值 | LN(ng/mL) | P值 |
| 年龄(岁) | 0.406 | 0.869 | |||
| <60 | 25 | 35.86±35.57 | 130.30±56.29 | ||
| ≥60 | 25 | 45.16±42.51 | 132.93±56.25 | ||
| 性别 | 0.409 | 0.276 | |||
| 男 | 42 | 38.48±38.26 | 135.40±56.76 | ||
| 女 | 8 | 51.07±44.27 | 111.77±48.18 | ||
| 病理分级 | 0.0001(低、中) | 0.057(低、中) | |||
| 0.0001(低、高) | 0.0001(低、高) | ||||
| 低分化 | 26 | 64.76±44.22 | 156.34±52.77 | ||
| 中分化 | 11 | 21.24±16.98 | 109.47±50.90 | ||
| 高分化 | 7 | 10.33±6.47 | 75.18±20.88 | ||
| 有无转移 | 0.0001 | 0.004 | |||
| 有 | 23 | 65.90±45.06 | 153.63±52.23 | ||
| 无 | 13 | 24.14±15.73 | 99.31±45.80 |
| 临床特征 | n | PⅢNP(μg/L) | P值 | LN(ng/mL) | P值 |
| 年龄(岁) | 0.62 | 0.618 | |||
| <60 | 25 | 57.18±23.11 | 161.68±51.85 | ||
| ≥60 | 25 | 53.57±27.37 | 155.78±31.86 | ||
| 性别 | 0.356 | 0.962 | |||
| 男 | 42 | 58.83±26.09 | 158.49±44.96 | ||
| 女 | 8 | 47.78±18.92 | 159.30±30.38 | ||
| 病理分级 | 0.044(低、中) | 0.130(低、中) | |||
| 0.0001(低、高) | 0.041(低、高) | ||||
| 低分化 | 26 | 66.95±23.51 | 171.25±48.51 | ||
| 中分化 | 11 | 43.53±24.58 | 147.44±29.95 | ||
| 高分化 | 7 | 35.36±7.76 | 132.78±35.32 | ||
| 有无转移 | 0.045 | 0.027 | |||
| 有 | 23 | 66.63±25.07 | 170.63±50.60 | ||
| 无 | 13 | 48.30±21.74 | 135.63±26.22 |
基底膜(basement membrane)是肿瘤细胞入侵到达周围组织基质必须通过的屏障[3], 肿瘤细胞可能通过释放某些溶解细胞膜和细胞外基质(extracellular matrix, ECM)的酶达到此目的, 而LN作为基底膜的主要成分[1], 可随着基底膜的降解而释放导致体内LN水平升高[4]. 同时, 肿瘤细胞可以产生LN和基底膜其他成分[5], 这也在一定程度解释了LN的升高. 有报道发现, LN的升高不仅见于胃癌, 还可见于结肠癌、直肠癌、肝癌等多种恶性肿瘤, 并认为这与肿瘤的进展相关[6-8]. 肿瘤的转移需通过血管基底膜入血到达靶器官, 同时常常伴有大量新生血管的形成, 这些血管在肿瘤进展中起重要作用, 而LN作为血管基底膜的重要成分, 某种意义上参与了肿瘤的生长和转移[9]. Gao等[7]曾对胃癌患者血清中LN水平进行了分析, 发现伴有转移的患者LN水平高于无转移的患者, 这与我们的研究结果是一致的. 有报道显示, 肿瘤在手术切除后可引起体内LN水平的下降[10]. 因此, 考虑LN对评价肿瘤的发生、浸润及是否转移有一定的指导意义.
胶原是细胞外基质的主要组成部分, 在细胞黏附、迁移、血管生成、组织形态的维持及组织的生长和修复中起重要作用[11]. PⅢNP是由分泌到细胞外的Ⅲ型前胶原(PcⅢ)在向Ⅲ型胶原转化的过程中, 经内肽酶的作用, 被切去后直接释放入血. 因此, PⅢNP能特异地反映Ⅲ型胶原合成和降解情况, 是胶原纤维合成的间接标志[2]. 肿瘤进展过程中常常伴有胶原合成的增加, Kadler等[12]在胃癌组织中发现成纤维细胞数目有所增加, 且其水平与肿瘤的大小、浸润深度、转移及TNM分期呈正相关, 考虑其对胃癌预后可能有一定指导意义. 由于成纤维细胞是合成胶原的主要细胞, 而PⅢNP是胶原纤维合成的间接标志[2], 故不难解释肿瘤患者体内PⅢNP水平的升高. Plebani也曾指出PⅢNP是细胞外基质合成的标志之一, 而肿瘤入侵首先便是侵犯细胞外基质, 这也一定程度上解释了PⅢNP浓度的升高. PⅢNP升高除了见于胃癌外, 还可见于其他多种恶性肿瘤如肝癌、乳腺癌、结肠癌、胰腺癌、肺癌等[13]. 我们的研究发现, 血清和胃液中PⅢNP含量的高低与胃癌有无转移有一定联系, Akazawa也曾通过实验证实, 当胃癌伴有转移时, 血清PⅢNP水平进一步升高, 其含量随着胃癌的临床分期的升高而升高, 晚期胃癌往往有更高的PⅢNP水平, 且血清中PⅢNP敏感性高于CEA和CA19-9, 三者联合检测的阳性率高于单一检测[14,15].
同时, 我们的研究发现胃液和血液中PⅢNP、LN的水平与胃癌的分化程度相关, 即其水平在低分化腺癌高于高分化腺癌. 推测可能由于低分化腺癌一般生长更为迅速, 且更易发生转移, 一旦发生侵袭和转移则会造成PⅢNP和LN水平的进一步升高, 故在低分化腺癌患者体内PⅢNP和LN含量往往更高.
目前, 关于胃液中PⅢNP、LN含量和胃癌的关系未见报道, 为此, 我们联合检测血清和胃液中PⅢNP和LN含量以探讨其与胃癌的关系. 研究表明胃癌患者胃液中的PⅢNP、LN水平与血清中PⅢNP、LN水平之间呈较强的正线性相关, 由于胃液与肿瘤直接接触, 胃液中PⅢNP和LN浓度的变化有可能更加确切地反应病变的情况, 另一方面由于血清中肿瘤标志物的含量的高低取决于生成的量及机体代谢的快慢, 而胃液中这些标志物不需要通过一系列代谢, 故能较直观地反映胃部的病变. 因此联合检测胃液中PⅢNP和LN含量可提高对胃癌诊断的敏感性, 可用于胃癌的筛查. 同时, 由于这两项标志物与肿瘤的浸润、分化、转移之间有一定的联系, 故对胃癌的活动有一定的指示意义. 然而, 我们的实验尚存在一些不足, 如样本数偏小, 缺乏胃癌患者临床分期的详细资料等, 这些需要在将来的研究中进一步完善.
基底膜(basement membrane, BM)和细胞外基质(extracellular matrix, ECM)作为胃癌浸润的第1道屏障, 在胃癌活动的过程中必然受到不同程度的破坏. 层黏连蛋白(laminin, LN)和PⅢNP与ECM、BM关系密切, 也必然表现出一定的变化, 而这一变化可动态地反映胃癌的活动. 有文献报道血清中LN和Ⅲ型前胶原氨端(N-terminal procollagen Ⅲ peptide, PⅢNP)在胃癌辅助诊断中的价值, 但目前尚缺乏胃癌、癌前病变患者胃液中LN和PⅢNP的相关资料.
葛海燕, 教授, 同济大学附属第十人民医院普通外科
肿瘤标志物在血清中含量的高低一方面取决于生成的量, 另一方面也取决于机体代谢的快慢. 而胃液中这些胃癌标志物不需要通过一系列代谢, 所以能较直观地反映胃部的病变, 因此, 胃液中某些成分可能作为胃癌筛查较为特异性的肿瘤标志物, 加之胃液的检查较胃镜较为简便经济, 近几年关于胃液方面的研究越来越多.
Duraker曾对胃癌患者胃液中CA19-9和CEA进行了研究, 发现CA19-9和CEA水平的高低在胃癌的诊断和预后方面并无确切的价值, 而雷长喜等人认为CA19-9、CEA及CA72-4对胃癌诊断有指导价值, 且各标志物针对肿瘤的不同分型敏感性有所差异, 可见胃液中各肿瘤标志物的研究已成为热点.
已有较多文献报道血清中LN和PⅢNP在胃癌辅助诊断中的价值, 但关于胃液中PⅢNP、LN含量和胃癌的关系未见报道. 为此, 我们联合检测血清和胃液中PⅢNP和LN含量以探讨其与胃癌的关系, 尤其是与胃癌的发生和各临床病理因素的相关性.
本文研究了胃癌与癌前病变患者的胃液与血液中PⅢNP、LN水平的变化, 探讨他们与临床病理之间的关系, 具有一定的临床意义.
编辑: 田滢 电编: 闫晋利
| 1. | Yamada Y, Hozumi K, Nomizu M. Construction and activity of a synthetic basement membrane with active laminin peptides and polysaccharides. Chemistry. 2011;17:10500-10508. [PubMed] |
| 2. | Risteli J, Niemi S, Trivedi P, Mäentausta O, Mowat AP, Risteli L. Rapid equilibrium radioimmunoassay for the amino-terminal propeptide of human type III procollagen. Clin Chem. 1988;34:715-718. [PubMed] |
| 3. | Kulasekara KK, Lukandu OM, Neppelberg E, Vintermyr OK, Johannessen AC, Costea DE. Cancer progression is associated with increased expression of basement membrane proteins in three-dimensional in vitro models of human oral cancer. Arch Oral Biol. 2009;54:924-931. [PubMed] [DOI] |
| 4. | Skubitz AP, Bast RC, Wayner EA, Letourneau PC, Wilke MS. Expression of alpha 6 and beta 4 integrins in serous ovarian carcinoma correlates with expression of the basement membrane protein laminin. Am J Pathol. 1996;148:1445-1461. [PubMed] |
| 5. | Benton G, Kleinman HK, George J, Arnaoutova I. Multiple uses of basement membrane-like matrix (BME/Matrigel) in vitro and in vivo with cancer cells. Int J Cancer. 2011;128:1751-1757. [PubMed] [DOI] |
| 6. | Saito N, Kameoka S. Serum laminin is an independent prognostic factor in colorectal cancer. Int J Colorectal Dis. 2005;20:238-244. [PubMed] |
| 7. | Gao ZL, Zhang C, Du GY, Lu ZJ. Clinical significance of changes in tumor markers, extracellular matrix, MMP-9 and VEGF in patients with gastric carcinoma. Hepatogastroenterology. 2007;54:1591-1595. [PubMed] |
| 8. | Qin LX, Tang ZY. Recent progress in predictive biomarkers for metastatic recurrence of human hepatocellular carcinoma: a review of the literature. J Cancer Res Clin Oncol. 2004;130:497-513. [PubMed] |
| 9. | Mori T, Kariya Y, Komiya E, Higashi S, Miyagi Y, Sekiguchi K, Miyazaki K. Downregulation of a newly identified laminin, laminin-3B11, in vascular basement membranes of invasive human breast cancers. Cancer Sci. 2011;102:1095-1100. [PubMed] [DOI] |
| 10. | Aghcheli K, Parsian H, Qujeq D, Talebi M, Mosapour A, Khalilipour E, Islami F, Semnani S, Malekzadeh R. Serum hyaluronic acid and laminin as potential tumor markers for upper gastrointestinal cancers. Eur J Intern Med. 2012;23:58-64. [PubMed] [DOI] |
| 11. | Kadler KE, Baldock C, Bella J, Boot-Handford RP. Collagens at a glance. J Cell Sci. 2007;120:1955-1958. [PubMed] |
| 12. | Kadler KE, Baldock C, Bella J, Boot-Handford RP. Collagens at a glance. J Cell Sci. 2007;120:1955-1958. [PubMed] [DOI] |
| 13. | Hatahara T, Igarashi S, Funaki N. High concentrations of N-terminal peptide of type III procollagen in the sera of patients with various cancers, with special reference to liver cancer. Gan. 1984;75:130-135. [PubMed] |
| 14. | Akazawa S, Harada A, Futatsuki K. [Diagnostic values of type III Procollagen N-terminal peptide and combination assay of type III procollagen N-terminal peptide with CEA and CA 19-9 in gastric cancer]. Gan To Kagaku Ryoho. 1984;11:1434-1438. [PubMed] |
| 15. | Akazawa S, Fujiki T, Kanda Y, Kumai R, Yoshida S. [Diagnostic values of serum type III procollagen N-terminal peptide in type IV gastric cancer]. Gan To Kagaku Ryoho. 1985;12:861-866. [PubMed] |