修回日期: 2013-04-08
接受日期: 2013-04-12
在线出版日期: 2013-05-18
目的: 探讨橙皮苷(hesperidin, HDN)预处理对扑热息痛(acetaminophen, APAP)导小鼠急性肝损伤的保护作用及凋亡相关基因的影响.
方法: ♂Balb/c小鼠60只, 随机均分为正常组、模型组、联苯双酯组、HDN高、中、低剂量组. 分别给予相应干预10 d后腹腔注射APAP造模, 16 h后处死小鼠, 测定肝、脾指数, 血清谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)及肝匀浆超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-PX)、丙二醛(malondialdehyde, MDA)水平, 光镜观察肝组织病理学变化和TUNEL法检测肝脏细胞凋亡情况, RT-PCR法测肝组织Bcl-2 mRNA、Bax mRNA转录水平.
结果: 与正常组比较, 模型组小鼠肝指数、ALT、AST、MDA均显著升高, SOD、GSH-PX均明显降低(5.41%±0.68% vs 4.38%±0.17%, 1456.49 U/L±413.45 U/L vs 45.36 U/L±11.98 U/L, 1929.34 U/L±810.19 U/L vs 78.49 U/L±10.22 U/L, 32.04 nmol/mgprot±9.32 nmol/mgprot vs 11.83 nmol/mgprot±1.72 nmol/mgprot, 119.29 U/mgprot±33.02 U/mgprot vs 327.22 U/mgprot±26.66 U/mgprot, 75.89 μmol/L±20.21 μmol/L vs 122.73 μmol/L±6.70 μmol/L, 均P<0.01). 与模型组相比, 联苯双酯组和HDN高、中剂量组小鼠肝指数、ALT、AST、MDA均显著降低, SOD、GSH-PX均明显升高(4.65%±0.61%, 4.59%±0.57%, 4.73%±0.63% vs 4.38%±0.17%; 66.36 U/L±13.43 U/L, 225.29 U/L±53.02 U/L, 773.06 U/L±251.27 U/L vs 1456.49 U/L±413.45 U/L; 105.75 U/L±17.02 U/L, 540.92 U/L±170.57 U/L, 906.78 U/L±226.38 U/L vs 1929.34 U/L±810.19 U/L; 15.74 nmol/mgprot±2.98 nmol/mgprot, 16.04 nmol/mgprot±4.92 nmol/mgprot, 20.85 nmol/mgprot±6.04 nmol/mgprot vs 32.04 nmol/mgprot±9.32 nmol/mgprot; 222.52 U/mgprot±56.11 U/mgprot, 245.95 U/mgprot±41.90 U/mgprot, 198.12 U/mgprot±68.09 U/mgprot vs 119.29 U/mgprot±33.02 U/mgprot; 108.70 μmol/L±25.96 μmol/L, 107.39 μmol/L±32.60 μmol/L, 98.90 μmol/L±10.71 μmol/L vs 75.89 μmol/L±20.21 μmol/L, P<0.01或0.05). 各实验组脾指数无明显变化, 差异不具有统计学意义(P>0.05). 肝脏病理学切片显示模型组肝组织明显围绕中央静脉的大片坏死, 并伴有细胞肿胀变性和大量炎性细胞浸润, 细胞凋亡程度明显加重; 联苯双酯组和HDN各剂量组肝组织片状坏死明显减轻, 炎性细胞浸润程度明显减轻, 凋亡程度减轻, 以联苯双酯和HDN高剂量组效果最为显著, 接近正常肝组织. RT-PCR结果显示, APAP可以上调Bax mRNA转录水平, 下调Bcl-2 mRNA转录水平, Bcl-2/Bax比值降低(0.68±0.03 vs 0.28±0.02, 0.21±0.04 vs 0.58±0.01, P<0.01); 联苯双酯和HDN高、中剂量组Bcl-2 mRNA转录水平均显著升高, Bax mRNA转录水平明显降低, Bcl-2/Bax比值升高(0.22±0.04, 0.56±0.01, 0.75±0.01 vs 0.21±0.04; 0.67±0.06, 0.26±0.005, 0.28±0.02 vs 0.68±0.03, P<0.05).
结论: HDN预处理对APAP诱导小鼠急性肝损伤具有保护作用, 其机制可能与其抑制肝细胞脂质过氧化反应及调控凋亡相关基因的表达有关.
核心提示: 橙皮苷(hesperidin)预处理对扑热息痛(acetaminophen)诱导小鼠急性肝损伤具有保护作用, 其机制可能与其抑制肝细胞脂质过氧化反应及调控凋亡相关基因的表达有关.
引文著录: 陈秀娟, 王超, 舒克钢, 雷焦, 聂浩, 张燕翔, 龚权. 橙皮苷预处理对APAP诱导小鼠急性肝损伤的保护作用及凋亡相关基因的影响. 世界华人消化杂志 2013; 21(14): 1278-1285
Revised: April 8, 2013
Accepted: April 12, 2013
Published online: May 18, 2013
AIM: To investigate the protective effect of hesperidin (HDN) pretreatment on the expression of apoptosis-related genes in the liver of mice with acetaminophen (APAP)-induced acute liver injury.
METHODS: Sixty male Balb/c mice were randomly divided into six groups, including normal group, model group, bifendate group, low-, medium-, and high-dose HDN groups. The HDN groups were intragastrically given different doses of hesperidin for 10 d. The bifendate group was given bifendate. Acute liver injury was induced by injecting APAP in all mice except those in the normal group. After 16 h, all mice were sacrificed. Liver index was calculated. Serum levels of alanine aminotransferase (ALT) and aspartate aminotransferase (AST) were measured. The activity of superoxide dismutase (SOD) and the contents of glutathione peroxidase (GSH-PX) and malondialdehyde (MDA) in liver homogenates were determined. Pathological changes in hepatic tissue were observed under an optical microscope. Apoptosis of hepatic cells was detected by TUNEL assay. The expression of Bcl-2 and Bax mRNAs in hepatic tissue was measured by reverse transcription polymerase chain reaction (RT-PCR).
RESULTS: Compared to the normal group, liver index, serum levels of ALT and AST, and the contents of MDA were significantly increased, and the activity of SOD and contents of GSH-PX in liver homogenates were significantly decreased in the model group (5.41% ± 0.68% vs 4.38% ± 0.17%, 1456.49 U/L ± 413.45 U/L vs 45.36 U/L ± 11.98 U/L, 1929.34 U/L ± 810.19 U/L vs 78.49 U/L ± 10.22 U/L, 32.04 nmol/mgprot ± 9.32 nmol/mgprot vs 11.83 nmol/mgprot ± 1.72 nmol/mgprot, 119.29 U/mgprot ± 33.02 U/mgprot vs 327.22 U/mgprot ± 26.66 U/mgprot, 75.89 μmol/L ± 20.21 μmol/Lvs 122.73 μmol/L ± 6.70 μmol/L, all P < 0.01). However, liver index, serum levels of ALT and AST, and the contents of MDA were significantly lower, and the activity of SOD and contents of GSH-PX were significantly higher in the bifendate group, high- and medium-dose HDN groups than in the model group (4.65% ± 0.61%, 4.59% ± 0.57%, 4.73% ± 0.63%vs 4.38% ± 0.17%; 66.36 U/L ± 13.43 U/L, 225.29 U/L ± 53.02 U/L, 773.06 U/L ± 251.27 U/L vs 1456.49 U/L ± 413.45 U/L; 105.75 U/L ± 17.02 U/L, 540.92 U/L ± 170.57 U/L, 906.78 U/L ± 226.38 U/L vs 1929.34 U/L ± 810.1 U/L; 15.74 nmol/mgprot ± 2.98 nmol/mgprot, 16.04 nmol/mgprot ± 4.92 nmol/mgprot, 20.85 nmol/mgprot ± 6.04 nmol/mgprot vs 32.04 nmol/mgprot ± 9.32 nmol/mgprot; 222.52 U/mgprot ± 56.11 U/mgprot, 245.95 U/mgprot ± 41.90 U/mgprot, 198.12 U/mgprot ± 68.09 U/mgprot vs 119.29 U/mgprot ± 33.02 U/mgprot; 108.70 μmol/L ± 25.96 μmol/L, 107.39 μmol/L ± 32.60 μmol/L, 98.90 μmol/L ± 10.71 μmol/L vs 75.89 μmol/L ± 20.21 μmol/L, all P < 0.01 or 0.05). The spleen index showed no significant differences among each group (all P > 0.05). Massive patchy necrosis surrounding the central vein, cellular swelling, massive inflammatory cell infiltration, and significant liver cell apoptosis were observed in liver tissues of mice in the model group; however, these pathological changes and cell apoptosis were significantly alleviated in the bifendate group and HDN groups. Such improvement was most obvious in the bifendate group and high-dose HDN group. APAP could significantly up-regulate Bax mRNA expression, down-regulate Bcl-2 mRNA expression, and decrease the Bcl-2/Bax ratio (0.68 ± 0.03 vs 0.28 ± 0.02, 0.21 ± 0.04 vs 0.58 ± 0.01; both P < 0.01). However, Bcl-2 mRNA expression was significantly up-regulated, Bax mRNA expression was significantly down-regulated and the Bcl-2/Bax ratio was significantly increased in the bifendate group, high- and medium-dose HDN groups (0.22 ± 0.04, 0.56 ± 0.01, 0.75 ± 0.01 vs 0.21 ± 0.04; 0.67 ± 0.06, 0.26 ± 0.005, 0.28 ± 0.02 vs 0.68 ± 0.03, all P < 0.05).
CONCLUSION: HDN pretreatment protects mice from acetaminophen-induced liver injury possibly via mechanisms associated with inhibiting lipid peroxidation and regulating the expressions of apoptosis-related genes.
- Citation: Chen XJ, Wang C, Shu KG, Lei J, Nie H, Zhang YX, Gong Q. Effect of hesperidin pretreatment on the expression of apoptosis-related genes in the liver of mice with acetaminophen-induced acute liver injury. Shijie Huaren Xiaohua Zazhi 2013; 21(14): 1278-1285
- URL: https://www.wjgnet.com/1009-3079/full/v21/i14/1278.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i14.1278
橙皮苷(hesperidin, HDN)为橙皮素与芸香糖形成的二氢黄酮苷类化合物, 大量研究证实HDN存在于多种植物中, 在柑桔类植物的果皮中含量尤其丰富[1,2]. 既往研究表明, HDN具有抗炎、抗氧化、抗过敏和消除自由基[3-5]、调节心血管系统的功能[6,7]、抗肿瘤[8-10]、抗辐射损伤[11-13]、对神经系统的保护[14,15]、基因毒性[16]及提高其他药物生物利用度[17,18]等多方面生物活性. Kaur等[19]研究发现, HDN可能通过抗氧化效应和抑制一氧化氮(nitrogen monoxide, NO)的性质而有效地保护脂多糖(lipopolysaccharide, LPS)诱导的大鼠肝细胞损伤、氧化应激和组织学的变化. 在CCl4诱导的大鼠肝损伤中, HDN也能改善增加的脂质过氧化反应, 减弱氧化应激. 这些保护作用与HDN的抗氧化剂特性直接相关[20]. 扑热息痛(acetaminophen, APAP)是临床上应用最广泛的解热镇痛药物, 过量使用或蓄积时可以造成严重的肝损害[21]. 本文通过建立APAP诱导的小鼠急性肝损伤模型, 探讨HDN预处理对急性肝损伤的保护作用及机制.
60只SPF级♂Balb/c小鼠, 体质量22 g±2 g, 购自武汉大学动物实验中心; HDN、APAP均购自Sigma公司; 羧甲基纤维素钠(Sodium salt of caboxymethylcellulose, CMC-Na)购自天津市科密欧化学试剂有限公司; 肝匀浆超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-PX)、丙二醛(malondialdehyde, MDA)、考马斯亮兰蛋白测定试剂盒均购自南京建成生物工程研究所; TRIzol试剂购自Invitrogen公司; 总RNA提取试剂盒购自天根生化科技(北京)有限公司; RT-PCR试剂盒购自宝生物工程(大连)有限公司; PCR引物由上海生工生物工程技术服务公司合成.
1.2.1 造模及分组: 60只♂Balb/c小鼠随机均分为6组: 正常组、模型组、联苯双酯组、HDN高剂量组、中剂量组和低剂量组. HDN高(500 mg/kg)、中(250 mg/kg)、低(125 mg/kg)剂量组将HDN混悬于0.5%CMC-Na溶液中按0.1 mL/10 g灌胃, 联苯双酯组(100 mg/kg)给予等量联苯双酯溶液, 正常组和模型组给予等量的0.5%CMC-Na溶液, 各组1次/d, 连续10 d. 末次灌胃后2 h禁食不禁水, 除正常组外其余各组腹腔注射150 mg/kg APAP溶液造模, 正常组腹腔注射同体积的0.5%CMC-Na溶液. 16 h后称质量, 留取血液标本, 肝脏、脾脏称质量后计算脏器指数, 脏器指数 = 脏器质量(g)/体质量(g). 肝脏部分-80 ℃冻存, 后期检测相关指标; 部分10%中性甲醛固定, 病理形态学观察.
1.2.2 生化指标检测: 取血后静置30 min, 4 ℃离心3000 r/min×15 min, 取上清液, 运用自动生化分析仪检测谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST). 取一定量的肝组织, 加9倍重量冷生理盐水制成10%肝匀浆, 所有操作均在冰浴中进行. 4 ℃离心3000 r/min×15 min, 取上清液严格按照按试剂盒说明用黄嘌呤氧化酶法检测肝匀浆中SOD活力、化学比色法测GSH-PX活力、TBA法检测MDA含量.
1.2.3 肝脏组织病理形态学改变: 取小鼠肝右叶组织用10%中性甲醛固定后常规石蜡包埋切片, 苏木精-伊红(HE)染色, 光镜下观察肝脏组织形态学改变.
1.2.4 TUNEL染色: 小鼠肝组织石蜡切片, 用细胞凋亡检测试剂盒, 严格按说明书操作, 3,3'-二氨基联苯胺显色, 光镜下观察肝脏细胞凋亡变化.
1.2.5 Bcl-2 mRNA、Bax mRNA的测定: 用总RNA提取试剂盒(北京天根生化科技有限公司)提取总RNA后, 用紫外分光光度计测定总RNA浓度和纯度. RT-PCR半定量法测定Bcl-2 mRNA、Bax mRNA, 以β-actin作为内参照. Bcl-2引物序列: 上游5'-GGCATCTTCTCCTTCCAG-3', 下游5'-CTACCCAGCCTCCGTTAT-3'; Bax引物序列: 上游5'-TTTCATCCAGGATCGAGCAGG-3', 下游5'-GCAAAGTAGAAGAGGGCAACCAC-3'; β-actin引物序列: 上游5'-CTGTCCCTGTATGCCTCTG-3', 下游5'-CATCGTACTCCTGCTTGCT-3'. Bcl-2和Bax反应条件为94 ℃预变性5 min, 94 ℃变性45 s, 50 ℃(Bcl-2)、48 ℃(Bax)退火45 s, 72 ℃延伸45 s, 共35个循环, 再72 ℃延伸5 min, 10 ℃保存. 取RT-PCR产物在2%琼脂糖凝胶电泳, 用BIO-Rad凝胶成像系统分析电泳带面积和光密度值, Bax、Bcl-2与内参照基因β-actin的比值, 代表组织Bax、Bcl-2相对表达量.
统计学处理 采用SPSS13.0软件进行数据分析, 各项检测结果以mean±SD表示, 组间比较采用t检验, 半定量资料采用Ridit分析. P<0.05具有统计学意义.
与正常组相比, 模型组肝指数显著增加(P<0.01); 与模型组相比, 联苯双酯组和HDN高、中剂量组肝指数均明显降低, 差异具有统计学意义(P<0.05); 低剂量组肝指数无明显变化(P>0.05). 各实验组脾指数均无明显变化, 差异不具有统计学意义(P>0.05)(表1).
与正常组相比, 模型组ALT、AST水平有显著的升高(P<0.01); 与模型组相比, 联苯双酯组和HDN高、中、低剂量组ALT、AST水平明显降低(P<0.01), 其中HDN高剂量组ALT、AST水平明显优于低剂量组, 差异具有统计学意义(P<0.01)(表2).
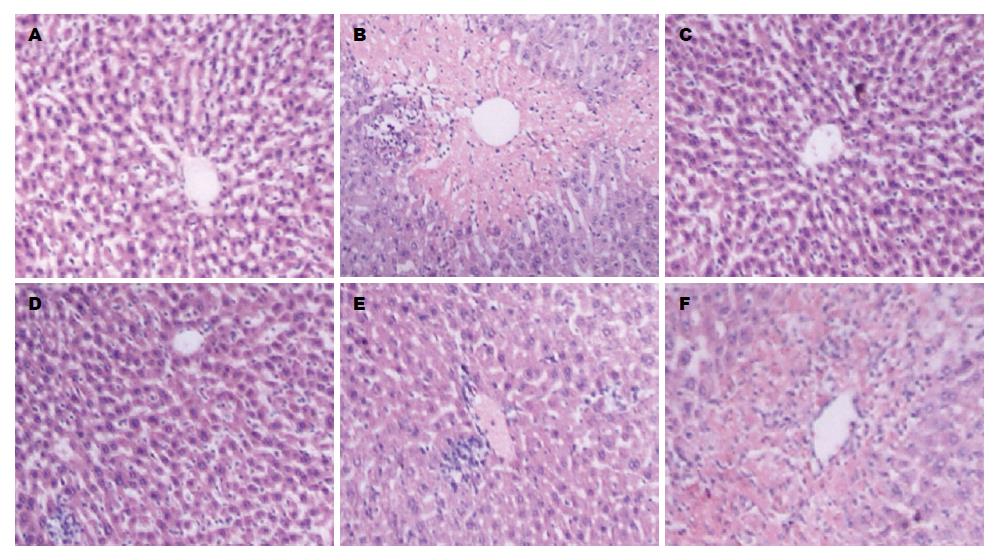
光镜下正常组小鼠肝组织结构清晰, 肝小叶完整, 肝细胞索围绕中央静脉呈放射状排列, 肝细胞无变性坏死, 不伴炎性细胞浸润. 模型组肝组织病理损伤严重, 可见明显围绕中央静脉的大片状坏死, 并伴有肝细胞肿胀变性及大量炎性细胞浸润; HDN高、中剂量组和联苯双酯组肝细胞片状坏死均显著减轻, 炎性细胞浸润程度明显减轻, 尤以高剂量组和联苯双酯组保护效果最好, 接近正常组肝组织. 低剂量组肝细胞部分片状坏死, 汇管区伴有大量的炎性细胞浸润, 程度较模型组略有减轻(图1).
SOD、GSH-PX、MDA与正常组比较, 模型组肝组织中SOD、GSH-PX活力显著降低(P<0.05), MDA含量显著升高(P<0.01). 与模型组比较, HDN高、中、低剂量组和联苯双酯组肝组织SOD、GSH-PX活力明显升高(P<0.05), MDA含量明显降低(P<0.05), 尤以高剂量组变化最为显著(P<0.01)(表3).
| 分组 | 超氧化物歧化酶(U/mgprot) | 谷胱甘肽过氧化物酶(μmol/L) | 丙二醛(nmol/mgprot) |
| 正常组 | 327.22±26.66 | 122.73±6.70 | 11.83±1.72 |
| 模型组 | 119.29±33.02b | 75.89±20.21b | 32.04±9.32b |
| 联苯双酯组 | 222.52±56.11d | 108.70±25.96d | 15.74±2.98d |
| HDN高剂量组 | 245.95±41.90dh | 107.39±32.60c | 16.04±4.92dh |
| HDN中剂量组 | 198.12±68.09d | 98.90±10.71dg | 20.85±6.04deg |
| HDN低剂量组 | 173.33±57.30c | 86.26±9.43e | 26.21±4.61f |
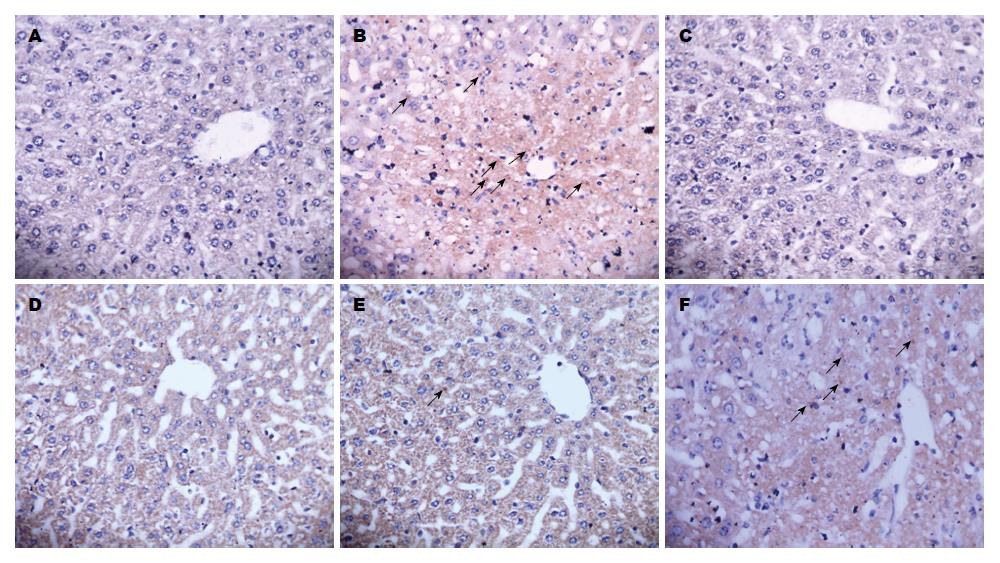
正常肝细胞核呈蓝色, 而凋亡肝细胞核呈棕黄色或棕褐色. 相比于正常组, 模型组小鼠肝组织凋亡肝细胞核明显增多; 相比于模型组, 联苯双酯组和HDN各剂量组凋亡肝细胞核显著减少, 以联苯双酯组和HDN高、中剂量组效果最为显著(图2). 根据同一视野中观察到的凋亡小体数目的多少, 共分为4级, 拟定标准如下: "-": 肝细胞中无凋亡小体者; "+": 在肝细胞同一个视野中观察到1个凋亡小体者; "++": 在肝细胞同一个视野中观察到2-4个凋亡小体者;"+++": 在肝细胞同一个视野中观察到5个以上(含5个)凋亡小体者(表4).
由图2和表4可知, 正常组小鼠肝细胞凋亡程度轻微, 模型组小鼠肝细胞凋亡程度严重, 经Ridit分析, 与正常组比较差异有显著性意义(P<0.01); 联苯双酯组和HDN各剂量组小鼠肝细胞凋亡程度均有所减轻, 其中尤以联苯双酯组和HDN高剂量组效果最为明显, 经Ridit分析, 与模型组比较差异有显著性意义(P<0.01), 相比于HDN低剂量组, HDN高、中剂量组肝细胞凋亡程度明显减轻(P<0.01)(图2).
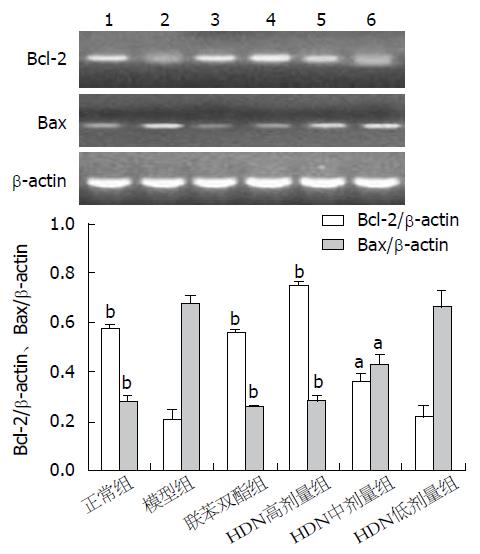
与正常组相比, 模型组Bcl-2 mRNA转录明显降低, Bax mRNA则明显升高(均P<0.01), Bcl-2/Bax比值降低; 与模型组相比较, 联苯双酯组和HDN高、中剂量组Bcl-2 mRNA转录水平均显著升高而Bax mRNA转录水平明显降低(P<0.01或0.05), 以联苯双酯组和HDN高剂量组变化最为显著, Bcl-2/Bax比值升高(P<0.01), HDN低剂量组Bcl-2 mRNA和Bax mRNA均无明显变化(P>0.05)(图3).
APAP是临床上应用广泛的解热镇痛药物, 在正常治疗剂量下(<25 mg/d)应用是安全的, 过量使用或蓄积则会对人和动物造成严重的肝脏损害. APAP(>90%)主要经葡萄糖醛酸化或硫酸化进而排出体外, 少量经肝脏细胞色素P450代谢, 其所致肝损害主要与其中间毒性代谢产物N-乙酰-对-苯醌亚胺(N-acetyl-p-benzoquinone imine, NAPQI)有关. NAPQI可使谷胱甘肽(glutathione, GSH)耗竭, 并与大分子蛋白结合[3,22], 从而诱发氧化应激和脂质过氧化反应[3-5]、线粒体呼吸抑制和ATP耗竭[23,24]、细胞凋亡[17]、DNA损伤[25,26]等, 引起肝细胞损伤. 本实验中模型组肝指数升高, 血清ALT、AST显著升高, 肝脏病理切片显示肝细胞大片变性、坏死, 表明本实验成功建立APAP所致急性肝损伤动物模型.
SOD是体内非常重要的抗氧化酶和氧自由基清除剂, 对机体的氧化与抗氧化平衡起重要作用. GSH-PX是灭活氧自由基的一种酶, 并能阻断体内脂质过氧化的进程. 测定肝匀浆SOD和GSH-PX能够直观的反应肝脏的受损情况, 其活力的大小反映机体抗氧化和清除自基的能力. 体内SOD、GSH-PX活性越高, 自由基清除的速度越快. MDA是脂质过氧化反应的产物, 可严重破坏细胞膜结构, 导致细胞肿胀、坏死. 因此MDA不仅是反映脂质过氧化的敏感指标, 还可间接反映出细胞损伤的程度. 实验结果显示, 与正常组相比, 模型组肝匀浆SOD、GSH-PX活力显著降低(P<0.01), MDA含量显著升高(P<0.01), 表明机体内氧化与抗氧化系统已经失衡, 机体抗氧化和清除自由基的能力显著降低, 并且肝细胞受到严重损害. 与模型组相比, HDN高、中剂量组肝匀浆SOD、GSH-PX活力均显著升高(P<0.05), MDA含量明显降低(P<0.01), 表明HDN可能通过提高SOD、GSH-PX活性, 增强机体抗氧化和清除自由基的能力, 降低肝细胞脂质过氧化作用, 维持细胞质膜的正常结构, 从而降低肝细胞的损伤程度.
关于APAP所致肝细胞死亡方式, 目前意见尚未统一. Ferret等[27]认为, 过量的APAP既可以引起肝细胞坏死也可以引起肝细胞凋亡, 肝损害中的细胞死亡40%以上是通过凋亡, 而非坏死. Gujral等[28]认为, APAP肝损害可引起肝细胞凋亡的明显增加, 但90%以上的肝细胞死亡仍然是通过坏死, 而非凋亡. 田丰等[29]认为, APAP肝损害, 早期以凋亡为主, 后期以坏死为主, 两者是共存的. Bcl-2家族蛋白的表达和调控是影响细胞凋亡的关键因素之一. Bcl-2和Bax分别是Bcl-2家族中最有代表性的抑制凋亡和促进凋亡基因,并且Bax是Bcl-2活性的主要调控因子. 近年来研究表明[30,31], Bcl-2和Bax调节细胞凋亡, 不仅取决于自身表达的高低, 还与Bax/Bcl-2的比率有关. Bax表达水平高于Bcl-2时, 则形成Bax和Bax同源二聚体, 细胞凋亡增加; Bcl-2水平高于Bax时, Bcl-2和Bax形成异源二聚体, 细胞凋亡受抑制. 实验结果显示, 模型组小鼠肝细胞凋亡严重, 肝脏中Bcl-2 mRNA表达减少, Bax mRNA表达增多; 通过HDN预处理, 小鼠肝细胞凋亡减轻, 肝脏Bcl-2 mRNA表达显著升高, Bax mRNA表达显著降低(P<0.01), 表明HDN可以调控凋亡相关基因的表达, 抑制肝脏细胞凋亡, 从而减轻肝组织损伤.
总之, HDN预处理对APAP所致小鼠急性肝损伤具有一定的保护作用, 其机制可能与其抑制肝细胞脂质过氧化反应, 提高机体抗氧化和清除自由基的能力, 调控凋亡相关基因Bcl-2和Bax的表达、升高Bcl-2/Bax比值有关, 但其具体机制尚需进一步研究.
橙皮苷(hesperidin, HDN)具有抗氧化、抗炎症、维持血管正常渗透压、增强毛细血管韧性、降血脂、保护心血管和抗肿瘤等多种功效. 随着对其药效学研究的深入, HDN已成为天然保健食品和药物学研究的热点.
张进祥, 副教授, 华中科技大学同济医学院附属协和医院
随着对HDN生理活性功能、营养学价值的逐步认识, 当前及今后急需开发新型有效的工艺来提取和纯化HDN, 进一步阐明HDN在生物体内代谢过程中含量变化、代谢途径、生物活性及利用效率的研究很有必要, 其有效浓度、给药途径、作用机制、稳定性及安全性、与其他物质的配伍性关系等也需要进行深入的研究.
Park等HDN下调pro-Caspase-3蛋白的表达, 上调凋亡因子半胱氨酸天冬氨酸蛋白酶3(Caspase-3)的活性, 通过激活Caspase-3的酶活性而诱导人结肠癌细胞的凋亡.
本文采用HDN灌胃预处理, 模拟目前HDN的主要摄取方法和代谢途径, HDN预防急性肝损伤的保护作用, 体现其预防保健的作用, 具有现实意义.
HDN主要存在柑橘属果实的皮、果肉、种子中, 皮和种子均为废弃的副产物. 柑橘除部分品种用于鲜食及加工外, 许多品种及副产物未得到综合利用, 每年都有极大的浪费. 2007年我国柑橘种植面积达181.46万m2, 产量突破1800万吨, 达到历史新高. 因此, 从柑橘中提取具有功能性的HDN将具有重大的经济效益和社会效益.
本文设计合理, 方法先进, 具有一定的理论意义和潜在的应用价值.
编辑: 田滢 电编: 闫晋利
| 1. | Wilmsen PK, Spada DS, Salvador M. Antioxidant activity of the flavonoid hesperidin in chemical and biological systems. J Agric Food Chem. 2005;53:4757-4761. [PubMed] |
| 2. | Mitsunaga Y, Takanaga H, Matsuo H, Naito M, Tsuruo T, Ohtani H, Sawada Y. Effect of bioflavonoids on vincristine transport across blood-brain barrier. Eur J Pharmacol. 2000;395:193-201. [PubMed] [DOI] |
| 3. | Jaeschke H, Knight TR, Bajt ML. The role of oxidant stress and reactive nitrogen species in acetaminophen hepatotoxicity. Toxicol Lett. 2003;144:279-288. [PubMed] [DOI] |
| 4. | Kim JK, Sung NY, Srinivasan P, Choi JI, Kim SK, Oh JM, Kim JH, Song BS, Park HJ, Byun MW. Effect of gamma irradiated hyaluronic acid on acetaminophen induced acute hepatotoxicity. Chem Biol Interact. 2008;172:141-153. [PubMed] [DOI] |
| 5. | Choi EM, Kim YH. Hesperetin attenuates the highly reducing sugar-triggered inhibition of osteoblast differentiation. Cell Biol Toxicol. 2008;24:225-231. [PubMed] [DOI] |
| 6. | Orallo F, Alvarez E, Basaran H, Lugnier C. Comparative study of the vasorelaxant activity, superoxide-scavenging ability and cyclic nucleotide phosphodiesterase-inhibitory effects of hesperetin and hesperidin. Naunyn Schmiedebergs Arch Pharmacol. 2004;370:452-463. [PubMed] [DOI] |
| 7. | Morand C, Dubray C, Milenkovic D, Lioger D, Martin JF, Scalbert A, Mazur A. Hesperidin contributes to the vascular protective effects of orange juice: a randomized crossover study in healthy volunteers. Am J Clin Nutr. 2011;93:73-80. [PubMed] [DOI] |
| 8. | Aranganathan S, Selvam JP, Sangeetha N, Nalini N. Modulatory efficacy of hesperetin (citrus flavanone) on xenobiotic-metabolizing enzymes during 1,2-dimethylhydrazine-induced colon carcinogenesis. Chem Biol Interact. 2009;180:254-261. [PubMed] [DOI] |
| 9. | Tian Q, Miller EG, Ahmad H, Tang L, Patil BS. Differential inhibition of human cancer cell proliferation by citrus limonoids. Nutr Cancer. 2001;40:180-184. [PubMed] [DOI] |
| 10. | Winawer S, Fletcher R, Rex D, Bond J, Burt R, Ferrucci J, Ganiats T, Levin T, Woolf S, Johnson D. Colorectal cancer screening and surveillance: clinical guidelines and rationale-Update based on new evidence. Gastroenterology. 2003;124:544-560. [PubMed] [DOI] |
| 11. | Pradeep K, Ko KC, Choi MH, Kang JA, Chung YJ, Park SH. Protective effect of hesperidin, a citrus flavanoglycone, against γ-radiation-induced tissue damage in Sprague-Dawley rats. J Med Food. 2012;15:419-427. [PubMed] [DOI] |
| 12. | Kalpana KB, Devipriya N, Srinivasan M, Vishwanathan P, Thayalan K, Menon VP. Evaluating the radioprotective effect of hesperidin in the liver of Swiss albino mice. Eur J Pharmacol. 2011;658:206-212. [PubMed] [DOI] |
| 13. | Kalpana KB, Devipriya N, Srinivasan M, Menon VP. Investigation of the radioprotective efficacy of hesperidin against gamma-radiation induced cellular damage in cultured human peripheral blood lymphocytes. Mutat Res. 2009;676:54-61. [PubMed] [DOI] |
| 14. | Kumar P, Kumar A. Protective effect of hesperidin and naringin against 3-nitropropionic acid induced Huntington's like symptoms in rats: possible role of nitric oxide. Behav Brain Res. 2010;206:38-46. [PubMed] [DOI] |
| 15. | Cho J. Antioxidant and neuroprotective effects of hesperidin and its aglycone hesperetin. Arch Pharm Res. 2006;29:699-706. [PubMed] [DOI] |
| 16. | Ahmadi A, Hosseinimehr SJ, Naghshvar F, Hajir E, Ghahremani M. Chemoprotective effects of hesperidin against genotoxicity induced by cyclophosphamide in mice bone marrow cells. Arch Pharm Res. 2008;31:794-797. [PubMed] [DOI] |
| 17. | Piao YJ, Choi JS. Enhanced bioavailability of verapamil after oral administration with hesperidin in rats. Arch Pharm Res. 2008;31:518-522. [PubMed] [DOI] |
| 18. | Forattini OP, Kakitani I, Sallum MA, de Rezende L. [Productivity of a breeding place of Aedes albopictus in an urban environment]. Rev Saude Publica. 1997;31:545-555. [PubMed] [DOI] |
| 19. | Kaur G, Tirkey N, Chopra K. Beneficial effect of hesperidin on lipopolysaccharide-induced hepatotoxicity. Toxicology. 2006;226:152-160. [PubMed] [DOI] |
| 20. | Tirkey N, Pilkhwal S, Kuhad A, Chopra K. Hesperidin, a citrus bioflavonoid, decreases the oxidative stress produced by carbon tetrachloride in rat liver and kidney. BMC Pharmacol. 2005;5:2. [PubMed] [DOI] |
| 21. | Ahmad ST, Arjumand W, Nafees S, Seth A, Ali N, Rashid S, Sultana S. Hesperidin alleviates acetaminophen induced toxicity in Wistar rats by abrogation of oxidative stress, apoptosis and inflammation. Toxicol Lett. 2012;208:149-161. [PubMed] [DOI] |
| 22. | Nelson SD. Molecular mechanisms of the hepatotoxicity caused by acetaminophen. Semin Liver Dis. 1990;10:267-278. [PubMed] [DOI] |
| 23. | Meyers LL, Beierschmitt WP, Khairallah EA, Cohen SD. Acetaminophen-induced inhibition of hepatic mitochondrial respiration in mice. Toxicol Appl Pharmacol. 1988;93:378-387. [PubMed] [DOI] |
| 24. | Kon K, Kim JS, Jaeschke H, Lemasters JJ. Mitochondrial permeability transition in acetaminophen-induced necrosis and apoptosis of cultured mouse hepatocytes. Hepatology. 2004;40:1170-1179. [PubMed] [DOI] |
| 25. | Bajt ML, Cover C, Lemasters JJ, Jaeschke H. Nuclear translocation of endonuclease G and apoptosis-inducing factor during acetaminophen-induced liver cell injury. Toxicol Sci. 2006;94:217-225. [PubMed] [DOI] |
| 26. | McGill MR, Sharpe MR, Williams CD, Taha M, Curry SC, Jaeschke H. The mechanism underlying acetaminophen-induced hepatotoxicity in humans and mice involves mitochondrial damage and nuclear DNA fragmentation. J Clin Invest. 2012;122:1574-1583. [PubMed] [DOI] |
| 27. | Ferret PJ, Hammoud R, Tulliez M, Tran A, Trébéden H, Jaffray P, Malassagne B, Calmus Y, Weill B, Batteux F. Detoxification of reactive oxygen species by a nonpeptidyl mimic of superoxide dismutase cures acetaminophen-induced acute liver failure in the mouse. Hepatology. 2001;33:1173-1180. [PubMed] [DOI] |
| 28. | Gujral JS, Knight TR, Farhood A, Bajt ML, Jaeschke H. Mode of cell death after acetaminophen overdose in mice: apoptosis or oncotic necrosis? Toxicol Sci. 2002;67:322-328. [PubMed] |
| 30. | Brooks C, Dong Z. Regulation of mitochondrial morphological dynamics during apoptosis by Bcl-2 family proteins: a key in Bak? Cell Cycle. 2007;6:3043-3047. [PubMed] [DOI] |