修回日期: 2010-08-03
接受日期: 2010-08-10
在线出版日期: 2010-09-28
目的: 探讨HMGA1及HMGA2的表达与食管癌发生、发展及浸润、转移的关系.
方法: 62例食管癌手术切除标本于2006-02-26/03-16取自食管癌高发区河南省安阳市肿瘤医院. 应用免疫组织化学SP法检测62例食管鳞癌组织, 31例癌旁不典型增生组织及62例正常食管黏膜组织中RECK及MMP-9蛋白的表达.
结果: 食管鳞癌组织中HMGA1蛋白表达与癌的组织学分级、浸润深度、淋巴结转移及TNM分期均密切相关(χ2 = 6.649, 6.175, 5.921, 11.341, 均P<0.05); 在食管鳞癌癌变过程中HMGA1蛋白在正常黏膜组织、癌旁不典型增生组织及癌组织中的表达率依次增高, 分别为8.1%(5/62)、58.1%(18/31)、69.4%(43/62), 组间比较有明显差异(χ2 = 51.429, P<0.01); HMGA2蛋白表达与癌的淋巴结转移及TNM分期密切相关(χ2 = 8.276, 17.851, 均P<0.05); HMGA2蛋白在正常黏膜组织、癌旁不典型增生组织及癌组织中的表达率依次增高, 分别为71.0%(44/62)、48.4%(15/31)、4.8%(3/62), 组间比较有明显差异(χ2 = 57.621, P<0.01), HMGA1及HMGA2的表达呈正相关关系(γp = 0.346, P = 0.006).
结论: HMGA1及HMGA2蛋白在食管鳞癌组织中表达显著下降, 并与食管鳞癌生物学行为关系密切, 提示HMGA1及HMGA2低表达与食管鳞癌的发生、发展有关, HMGA1及HMGA2可作为食管鳞癌早期诊断和判断预后的辅助指标.
引文著录: 闫艳琴, 刘红涛, 冯天平, 赵景志, 李晟磊. HMGA1和HMGA2蛋白在食管鳞癌中表达的相关性及其临床病理意义. 世界华人消化杂志 2010; 18(27): 2869-2873
Revised: August 3, 2010
Accepted: August 10, 2010
Published online: September 28, 2010
AIM: To explore the relationship of the protein expression of high mobility group protein AT-hook 1 (HMGA1) and HMGA2 with the development, progression, invasion and metastasis of esophageal squamous cell carcinoma.
METHODS: Sixty-two patients with esophageal squamous cell carcinoma treated at Anyang Tumor Hospital from February 2006 to March 2006 were included in this study. Immunohistochemistry was used to detect the protein expression of HMGA1 and HMGA2 in 62 esophageal squamous cell carcinoma specimens, 31 tumor adjacent atypical hyperplastic epithelial specimens, and 62 normal esophageal epithelial specimens.
RESULTS: The expression of HMGA1 protein was closely correlated with tumor grade, infiltration, lymphatic metastasis and TNM grade in esophageal squamous cell carcinoma (χ2 = 6.649, 6.175, 5.921 and 11.341, respectively; all P < 0.05). The positive rates of HMGA1 protein expression in normal esophageal epithelium, tumor-adjacent atypical hyperplastic epithelium and carcinoma were 8.1% (5/62), 58.1% (18/31) and 69.4% (43/62), respectively, with a significant difference among the three groups (χ2 = 51.429, P < 0.01). The expression of HMGA2 protein was closely correlated with lymphatic metastasis and TNM grade in esophageal squamous cell carcinoma (χ2 = 8.276 and 17.851, respectively; both P < 0.05). The positive rates of HMGA2 protein expression in normal esophageal epithelium, tumor-adjacent atypical hyperplastic epithelium and carcinoma were 71.0% (44/62), 48.4% (15/31) and 4.8% (3/62), respectively, with a significant difference among the three groups (χ2 = 57.621, P < 0.01). There is a positive correlation between the protein expression of HMGA1 and HMGA2 (γp = 0.346, P = 0.006).
CONCLUSION: HMGA1 and HMGA2 play an important role in the carcinogenesis, infiltration and metastasis of esophageal carcinoma. Combined detection of HMGA1 and HMGA2 expression may be used as a molecular parameter for early diagnosis and prognostic evaluation of esophageal squamous cell carcinoma.
- Citation: Yan YQ, Liu HT, Feng TP, Zhao JZ, Li SL. Clinical pathological significance of HMGA1 and HMGA2 protein expression in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(27): 2869-2873
- URL: https://www.wjgnet.com/1009-3079/full/v18/i27/2869.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i27.2869
高迁移率族蛋白(high mobility group protein, HMG)起初是在牛胸腺细胞内被发现的, 是细胞核内的一种强水溶性的, 在聚丙烯酰胺凝胶电泳过程中表现出很高迁移率的一类小分子蛋白质. HMGA是其家族成员之一, 其又可分为HMGA1及HMGA2两个家族成员. 研究表明HMG家族成员, 尤其是HMGA1及HMGA2均参与了多种肿瘤有关基因的转录调控[1-3], 与乳腺癌、皮肤癌及卵巢癌等多种恶性癌变的发生密切相关[4-6]. 有关HMGA1及HMGA2与食管癌浸润转移的关系及二者表达相关性的研究, 迄今国内外均未见报道. 我们采了用免疫组织化学SP法系统地检测了HMGA1及HMGA2基因在62例食管鳞癌组织、31例癌旁不典型增生组织及62例正常食管黏膜组织的表达, 探讨HMGA1及HMGA2在食管癌演变过程中的作用, 以期寻找食管癌早期诊断和判断预后的分子指标.
62例食管癌手术切除标本于2006-02- 26/03-16取自食管癌高发区河南省安阳市肿瘤医院, 所有病例术前均无化疗, 放疗及免疫治疗史. 其中男36例, 女26例, 年龄38-75(平均60.6±9.5)岁. 全部病理组织学证实均为鳞状细胞癌. 其中组织学分级Ⅰ级15例, Ⅱ级25例, Ⅲ级22例; 伴淋巴结转移者20例, 无淋巴结转移者42例. 浸润深度分两组, 浸达浅层者(包括黏膜层、黏膜下层及浅肌层)7例, 浸达深者(包括深肌层及纤维膜). 全部样本分别在癌灶、癌旁3 cm以内及远端正常黏膜组织3处取材, 经40 g/L多聚甲醛液固定, 常规脱水, 石蜡包埋, 连续切片, 切片厚度4-6 μm, 分别用于HE和免疫组织化学染色. 兔抗入HMGA1多克隆抗体及鼠抗人HMGA2单克隆抗体均购自英国Abcam公司产品, SP免疫组织化学试剂盒购自北京中杉金桥生物技术开发公司.
1.2.1 免疫组织化学染色: 采用SP法, HMGA1及HMGA2单抗稀释, 稀释倍数分别为1:200和1:230, DAB显色, 苏木素复染. 染色步骤严格按说明书进行, 以PBS液代替一抗作为阴性对照, 阳性对照为已知的HMGA1及HMGA2阳性的乳腺癌组织切片.
1.2.2 结果判定: HMGA1及HMGA2蛋白阳性信号均呈棕黄色颗粒样物质, 主要位于细胞核内. 高倍镜下随机选取5个视野(每个视野观察细胞数不少于200个), 按阳性细胞所占百分比及着色深浅进行结果判定[7,8]. (1)按阳性细胞数占同类细胞数的百分比, <30%为1分, 30%-70%为2分, >70%为3分; (2)按切片中细胞着色深浅评分: 0分, 细胞无显色; 1分, 浅黄色; 2分, 棕黄色; 3分, 棕褐色. 取(1)(2)两项评分的乘积作为总积分, 0-1分为阴性(-), >1分为阳性(++).
统计学处理 应用SPSS13.0统计学软件, 采用χ2检验. 检验水准α = 0.05.
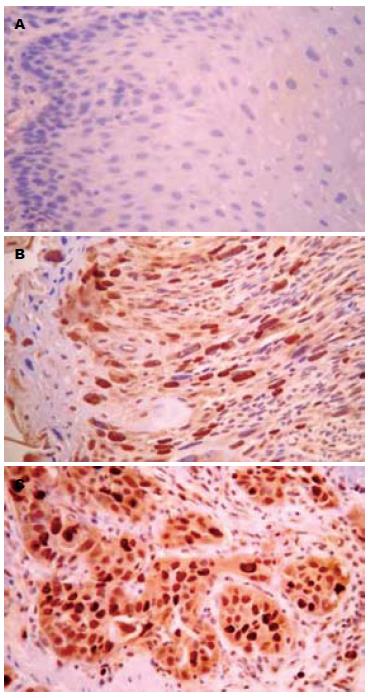
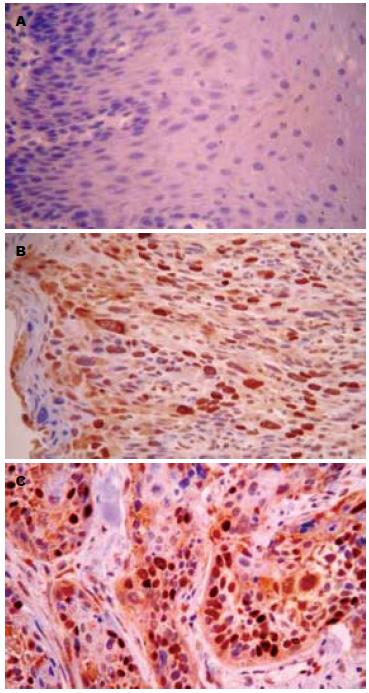
HMGA1蛋白阳性表达主要位于肿瘤细胞的胞核中, 呈浅黄色至深黄色颗粒(图1). 在食管鳞癌癌变过程中HMGA1蛋白表达在正常黏膜组织、癌旁不典型增生组织及癌组织中的表达率依次增高, 分别为8.1%(5/62)、58.1%(18/31)、69.4%(43/62), 组间比较有明显差异(χ2 = 51.429, P<0.01, 表1). HMGA1蛋白表达与食管鳞癌组织学分级、浸润深度、淋巴结转移及TNM分期均有关(χ2 = 6.649, 6.175, 5.921及11.341, 均P<0.05, 表2).
| n | HMGA1 | HMGA2 | |||||||||
| -(n) | +(n) | 阳性率(%) | χ2值 | P值 | -(n) | +(n) | 阳性率(%) | χ2值 | P值 | ||
| 正常黏膜上皮组织 | 62 | 57 | 5 | 8.1 | 51.429 | 0.000 | 59 | 3 | 4.8 | 57.621 | 0.000 |
| 非典型增生组织 | 31 | 13 | 18 | 58.1 | 16 | 15 | 48.4 | ||||
| 鳞癌组织 | 62 | 19 | 43 | 69.4 | 18 | 44 | 71.0 | ||||
| 病理特征 | n | HMGA1 | HMGA2 | ||||
| 阳性表达n(%) | χ2值 | P值 | 阳性表达n(%) | χ2值 | P值 | ||
| 组织学分级 | |||||||
| Ⅰ | 15 | 7(46.7) | 6.649 | 0.036 | 11(73.3) | 0.181 | 0.914 |
| Ⅱ | 25 | 17(68.0) | 17(68.0) | ||||
| Ⅲ | 22 | 19(86.4) | 16(72.7) | ||||
| 浸润深度 | |||||||
| 浅层 | 7 | 2(28.6) | 6.175 | 0.013 | 4(57.1) | 0.732 | 0.392 |
| 深层 | 55 | 41(74.5) | 40(72.7) | ||||
| 淋巴结转移 | |||||||
| 无 | 42 | 25(59.5) | 5.921 | 0.015 | 25(54.2) | 8.276 | 0.004 |
| 有 | 20 | 18(90.0) | 19(85.7) | ||||
| TNM分期 | |||||||
| Ⅰ、Ⅱ | 26 | 12(46.2) | 11.341 | 0.001 | 11(42.3) | 17.851 | 0.000 |
| Ⅲ、Ⅳ | 36 | 31(86.1) | 33(91.7) | ||||
HMGA2蛋白阳性着色定位于细胞核, 呈棕黄色或深黄色颗粒(图2). 在食管鳞癌癌变过程中HMGA2蛋白在正常黏膜组织、癌旁不典型增生组织及癌组织中的表达率依次升高, 分别为71.0%(44/62)、48.4%(15/31)、4.8%(3/62), 组间比较有明显差异(χ2 = 57.621, P<0.01, 表1). HMGA2蛋白表达与食管鳞癌组织的组织学分级及浸润深度无关, 组间比较差异无统计学意义(χ2 = 0.181, 0.732, 均P>0.05), HMGA2蛋白阳性表达率与癌组织的淋巴结转移及TNM分期密切相关(χ2 = 8.276及17.851; 均P<0.05, 表2).
HMG是一种染色体相关蛋白, 广泛存在于真核细胞内, 通常以其相对分子质量的大小、DNA结合的特异性及序列不同被研究者分为3个家族成员, 包括HMGB、HMGN及HMGA, 其中HMGA与恶性肿瘤的关系十分密切. HMGA家族包括HMGA1及HMGA2两大类蛋白, 二者均参与了包括细胞生长, 分化和转化等过程, 有结构转录因子的功能, 同时还参与了多条途径的靶基因启动因子结构的激活并参与多种人体的不同细胞的分化进程. 可诱导肿瘤细胞的生长和迁移, 参与肿瘤细胞的演变过程[9-13]. HMGA1是一种相对分子质量大约为10 000 Da, 位于6p21, 有4个转录外显子及4个增强区域; HMGA2位于12q14-15, 有5个外显子[14-16]. HMGA1与HMGA2蛋白序列基本相似, 相对分子质量大小相差无几, 其特征性结构3个碱性的八肽DNA结合基序和1个酸性的C末端几乎完全相同. 这3个DNA结合基序都能与DNA分子小沟内的A-T丰富区优先结合, 因而被称为A-T hooks. A-T hooks的核心结构能诱导DNA分子空间结构发生变化如弯曲、拉直等, 从而发挥调节基因转录的作用[17,18]. 通常情况下, HMGA主要存在于胚胎发育期及处于快速增殖的细胞内, 而在分化成熟的组织内几乎没有表达, 近期的研究结果显示HMGA可能与恶性肿瘤的复发、侵袭、转移及预后关系密切[1-3]. 目前的研究还发现HMGA参与了许多基因转录的调节, 例如HMGA1与P53家族转录因子寡聚化区域直接发生作用, 阻止正常寡聚化及DNA结合, 进一步抑制其转录及抑癌活性, 并抑制凋亡. 许多生物、环境和转录因子可诱导HMGAI基因的表达, 如TPA、FGF、转化TGF-α、缺氧以及转录因子AP-1、c-Myc. 有趣的是这其中许多刺激因子也可诱导HMGA2基因的表达, 其5'端启动/增强区域较HMGA1基因有更为简单的结构, 就HMGA2基因来说, PI3K、Ras/MAP激酶和缺氧刺激信号传导通路则是更强的刺激物. 这都充分说明了HMGA与肿瘤的进展、转移及凋亡过程密切相关[19-21].
本研究结果显示, HMGA1及HMGA2在食管鳞癌组织中的表达远高于其在相对应的癌旁不典型增生组织及正常食管黏膜内, 说明HMGA1及HMGA2高表达的食管鳞癌具有更强的侵袭能力. HMGA1与食管鳞癌的组织学分级、TNM分期、浸润深度及有无淋巴结转移密切相关, HMGA2与TNM分期及有无淋巴结转移密切相关, 提示二者可能共同参与了食管鳞癌浸润转移的过程. HMGA1及HMGA2蛋白表达呈正相关关系, 提示了二者在食管鳞癌发生发展过程中可能起到了协同作用. 联合检测HMGA1及HMGA2蛋白的表达有利于我们进一步地了解食管癌的生物学行为, 为食管鳞癌的早期诊断和治疗提供一个新的途径.
HMGA家族包括HMGA1及HMGA2两大类蛋白, 二者均参与了细胞生长, 分化和转化等过程, 他们有结构转录因子的功能, 同时还参与了多条途径的靶基因启动因子结构的激活, 并参与了多种人体的不同细胞的分化进程.
纪小龙, 教授, 武警总医院纳米医学研究所
目前, 关于HMGA1, HMGA2基因与食管癌浸润、转移的关系及HMGA1, HMGA2表达相关性的研究, 迄今国内外均未见报道. 关于HMGA1及HMGA2与恶性肿瘤关系的研究已成为热点.
本文首次采用免疫组织化学方法联合检测了食管癌高发区河南安阳的食管癌患者手术切除的癌组织、癌旁不典型增生组织及正常食管黏膜组织中HMG1及HMG2蛋白的表达情况.
HMGA1及HMGA2可能共同参与了食管鳞癌浸润转移的过程, 在食管鳞癌发生发展过程中可能起协同作用. 联合检测HMGA1及HMGA2蛋白的表达有利于进一步地了解食管癌的生物学行为, 为食管鳞癌的早期诊断和治疗提供新的途径.
本研究有一定得参考价值, 但学术价值一般.
编辑: 李军亮 电编:何基才
| 1. | Lyngaard C, Stemmer C, Stensballe A, Graf M, Gorr G, Decker E, Grasser KD. Physcomitrella HMGA-type proteins display structural differences compared to their higher plant counterparts. Biochem Biophys Res Commun. 2008;374:653-657. [PubMed] [DOI] |
| 2. | Di Cello F, Hillion J, Hristov A, Wood LJ, Mukherjee M, Schuldenfrei A, Kowalski J, Bhattacharya R, Ashfaq R, Resar LM. HMGA2 participates in transformation in human lung cancer. Mol Cancer Res. 2008;6:743-750. [PubMed] [DOI] |
| 3. | Strichman-Almashanu LZ, Bustin M, Landsman D. Retroposed copies of the HMG genes: a window to genome dynamics. Genome Res. 2003;13:800-812. [PubMed] [DOI] |
| 4. | Laezza C, Malfitano AM, Proto MC, Esposito I, Gazzerro P, Formisano P, Pisanti S, Santoro A, Caruso MG, Bifulco M. Inhibition of 3-hydroxy-3-methylglutaryl-coenzyme A reductase activity and of Ras farnesylation mediate antitumor effects of anandamide in human breast cancer cells. Endocr Relat Cancer. 2010;17:495-503. [PubMed] [DOI] |
| 5. | Sharma A, Ray R, Rajeswari MR. Overexpression of high mobility group (HMG) B1 and B2 proteins directly correlates with the progression of squamous cell carcinoma in skin. Cancer Invest. 2008;26:843-851. [PubMed] [DOI] |
| 6. | Mahajan A, Liu Z, Gellert L, Zou X, Yang G, Lee P, Yang X, Wei JJ. HMGA2: a biomarker significantly overexpressed in high-grade ovarian serous carcinoma. Mod Pathol. 2010;23:673-681. [PubMed] [DOI] |
| 7. | 高 冬玲, 李 晟磊, 陈 奎生, 赵 志华, 赵 秋民, 刘 宗文, 张 云汉. 金属蛋白酶抑制基因RECK在食管鳞癌中的表达及生物学意义. 世界华人消化杂志. 2008;16:1634-1638. [DOI] |
| 8. | 李 晟磊, 赵 秋民, 刘 宗文, 赵 志华, 高 冬玲, 郑 湘予, 陈 奎生, 张 云汉. 食管鳞癌中RECK和MMP-9蛋白表达的相关性及临床病理意义. 世界华人消化杂志. 2007;15:1082-1086. [DOI] |
| 9. | Pogna EA, Clayton AL, Mahadevan LC. Signalling to chromatin through post-translational modifications of HMGN. Biochim Biophys Acta. 2010;1799:93-100. [PubMed] |
| 10. | Tecle E, Zielinski L, Kass DH. Recent integrations of mammalian Hmg retropseudogenes. J Genet. 2006;85:179-185. [PubMed] [DOI] |
| 11. | Rahman MM, Qian ZR, Wang EL, Sultana R, Kudo E, Nakasono M, Hayashi T, Kakiuchi S, Sano T. Frequent overexpression of HMGA1 and 2 in gastroenteropancreatic neuroendocrine tumours and its relationship to let-7 downregulation. Br J Cancer. 2009;100:501-510. [PubMed] [DOI] |
| 12. | Franco R, Esposito F, Fedele M, Liguori G, Pierantoni GM, Botti G, Tramontano D, Fusco A, Chieffi P. Detection of high-mobility group proteins A1 and A2 represents a valid diagnostic marker in post-pubertal testicular germ cell tumours. J Pathol. 2008;214:58-64. [PubMed] [DOI] |
| 13. | Sarhadi VK, Wikman H, Salmenkivi K, Kuosma E, Sioris T, Salo J, Karjalainen A, Knuutila S, Anttila S. Increased expression of high mobility group A proteins in lung cancer. J Pathol. 2006;209:206-212. [PubMed] [DOI] |
| 14. | Medeiros F, Araujo AR, Erickson-Johnson MR, Kashyap PC, Dal Cin P, Nucci M, Wang X, Bell DA, Oliveira AM. HMGA1 and HMGA2 rearrangements in mass-forming endometriosis. Genes Chromosomes Cancer. 2010;49:630-634. [PubMed] |
| 15. | Liu Y, Shete S, Etzel CJ, Scheurer M, Alexiou G, Armstrong G, Tsavachidis S, Liang FW, Gilbert M, Aldape K. Polymorphisms of LIG4, BTBD2, HMGA2, and RTEL1 genes involved in the double-strand break repair pathway predict glioblastoma survival. J Clin Oncol. 2010;28:2467-2474. [PubMed] [DOI] |
| 16. | Ahmed KM, Tsai CY, Lee WH. Derepression of HMGA2 via removal of ZBRK1/BRCA1/CtIP complex enhances mammary tumorigenesis. J Biol Chem. 2010;285:4464-4471. [PubMed] [DOI] |
| 17. | Pierantoni GM, Rinaldo C, Esposito F, Mottolese M, Soddu S, Fusco A. High Mobility Group A1 (HMGA1) proteins interact with p53 and inhibit its apoptotic activity. Cell Death Differ. 2006;13:1554-1563. [PubMed] [DOI] |
| 18. | Cleynen I, Brants JR, Peeters K, Deckers R, Debiec-Rychter M, Sciot R, Van de Ven WJ, Petit MM. HMGA2 regulates transcription of the Imp2 gene via an intronic regulatory element in cooperation with nuclear factor-kappaB. Mol Cancer Res. 2007;5:363-372. [PubMed] [DOI] |
| 19. | Dhar A, Hu J, Reeves R, Resar LM, Colburn NH. Dominant-negative c-Jun (TAM67) target genes: HMGA1 is required for tumor promoter-induced transformation. Oncogene. 2004;23:4466-4476. [PubMed] [DOI] |
| 20. | Liau SS, Jazag A, Whang EE. HMGA1 is a determinant of cellular invasiveness and in vivo metastatic potential in pancreatic adenocarcinoma. Cancer Res. 2006;66:11613-11622. [PubMed] [DOI] |
| 21. | Biswas A, Bhattacharya S, Dasgupta S, Kundu R, Roy SS, Pal BC, Bhattacharya S. Insulin resistance due to lipid-induced signaling defects could be prevented by mahanine. Mol Cell Biochem. 2010;336:97-107. [PubMed] [DOI] |