修回日期: 2008-02-28
接受日期: 2008-04-11
在线出版日期: 2008-04-18
目的: 探讨T-cadherin启动子甲基化与T-cadherin在肝细胞癌中表达的关系.
方法: 采用甲基化特异性聚合酶链反应(methylation-specific PCR, MSP)、免疫组织化学(immunohistochemistry, IHC)和免疫印迹(Western blot)检测T-cadherin在肝细胞癌中启动子甲基化的状态及其对T-cadherin表达的影响. 培养肝癌HepG2细胞, 采用去甲基化药物5-aza-2-deoxycytidine处理后, Western blot检测T-cadherin表达, 并观察T-cadherin表达对肝癌细胞株HepG2细胞增殖的影响.
结果: T-cadherin在肝细胞癌中存在启动子甲基化(40%), 肝细胞癌组织中T-cadherin启动子甲基化导致其表达明显下调(表达评分: 0.227±0.875 vs 0.188±1.667, P<0.05); 对存在T-cadherin启动子甲基化的HepG2细胞应用去甲基化药物5-aza-2-deoxycytidine培养能诱导HepG2细胞T-cadherin分子的重新表达, T-cadherin分子重新表达能抑制HepG2细胞增殖.
结论: T-cadherin启动子的甲基化导致其表达下调; 去甲基化药物5-aza-2-deoxycytidine能恢复HepG2细胞T-cadherin的表达, 并抑制HepG2细胞增殖.
引文著录: 张志发, 黄志勇, 陈孝平, 严群, 肖振宇, 吴在德. T-cadherin启动子甲基化与人肝癌T-cadherin表达的关系. 世界华人消化杂志 2008; 16(11): 1194-1198
Revised: February 28, 2008
Accepted: April 11, 2008
Published online: April 18, 2008
AIM: To investigate the relationship between the aberrant methylation of T-cadherin promoter and T-cadherin protein expression in human hepatocellular carcinoma (HCC).
METHODS: Methylation-specific PCR (MSP), immunohistochemistry and Western blot were used to detect the methylation status of T-cadherin promoter and T-cadherin protein expression in tissue samples of HCC and cancer-adjacent mucosa. HepG2 cells were cultured, and then treated with demethylating agent 5-aza-2-deoxycytidine. Western blot was used to measure the re-expression of T-cadherin in HepG2 cells, and cell growth suppression induced by 5-aza-2-deoxycytidine was also observed.
RESULTS: The methlylation of T-cadherin promoter existed in HCC (40%), the T-cadherin expression was significantly decreased in comparison with that in HCC without methylation (expression score: 0.227 ± 0.875 vs 0.188 ± 1.667, P < 0.05). When HepG2 cells with aberrant methylation of T-cadherin promoter were treated with 5-aza-2-deoxycytidine, T-cadherin was re-expressed, and the proliferation of HepG2 cells was significantly suppressed as compared with that of cells without treatment.
CONCLUSION: The promoter aberrant methylation plays a key role in down-regulating T-cadherin expression, and demethylation agents can restore T-cadherin expression so as to suppress the growth of HepG2 cells.
- Citation: Zhang ZF, Huang ZY, Chen XP, Yan Q, Xaio ZY, Wu ZD. Relationship between aberrant methylation of T-cadherin promoter and T-cadherin expression in human hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2008; 16(11): 1194-1198
- URL: https://www.wjgnet.com/1009-3079/full/v16/i11/1194.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i11.1194
原发性肝癌为高度恶性肿瘤, 其死亡率居我国肿瘤死亡率第二位. 手术切除是治疗肝癌的首选方法. 我国原发性肝癌与乙肝感染引起的肝硬化密切相关, 且易发生早期转移和播散, 手术切除率低和术后转移及复发是制约手术疗效的重要因素. 因此, 研究肝细胞癌发生、发展的分子机制, 对我们制定新的治疗方案, 控制其转移及复发有着重要的临床意义. 近年来研究发现黏附分子与恶性肿瘤的生物学特征如肿瘤细胞的恶性增殖、侵袭及转移有密切的相关性. 黏附分子家族中T-cadherin在乳腺癌[1]、肺癌[2]、结直肠癌[3]、卵巢癌[4]等中表达下调, 其下调机制和T-cadherin启动子甲基化明显相关[2,5]. 转染T-cadherin cDNA的乳腺癌细胞增殖和侵袭能力减弱[1], 证实T-cadherin具有肿瘤抑制的功能, 且T-cadherin作为肿瘤抑制因子的推测在裸鼠体内也得到了进一步证实[6]. 在人肝细胞癌中是否存在T-cadherin启动子甲基化对T-cadherin的表达的影响尚无研究报道. 深入研究人肝癌组织中T-cadherin的表达与T-cadherin启动子甲基化的关系, 对揭示其发生、发展的精确分子机制, 设计合理的药物治疗, 进一步提高我国肝癌的治疗水平具有重要的意义.
收集2003-08/2006-01同济医院肝脏外科中心行手术切除的原发性肝细胞癌及远离癌灶边缘2 cm以上的癌旁肝组织共20例. 所取标本部分置于-70℃超低温冰箱中保存, 另一部分作石蜡切片, 所有诊断均经病理学诊断证实为肝细胞肝癌.
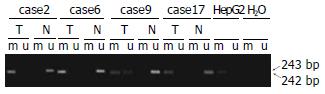
1.2.1 甲基化特异性聚合酶链式反应(MSP): 用Genomic DNA Purification Kit从20例肝癌组织、癌旁组织和1例肝癌细胞株中提取基因组DNA, 提取步骤按照试剂盒的说明进行. 然后取1 μg的基因组DNA用Chemicon CpGWIZTM DNA Modification Kit进行处理, 将基因组DNA上所有非甲基化的胞嘧啶转换成尿嘧啶, 同时那些甲基化的胞嘧啶则保持不变[8], 修饰过程按试剂盒说明书进行. 修饰后的DNA保存在TE缓冲液(pH7.5)中. 用上述修饰的DNA作为模板, 按照T-cadherin启动子甲基化和非甲基化两种可能设计两对引物, 引物序列按照Sakai et al[9]所述. T-cadherin启动子非甲基化的引物序列是: 上游引物: 5'-TTGTGGGGTTGTTTTTTGT-3', 下游引物: 5'-AACTTTTCATTCATACACACA-3', 扩增出242对碱基产物. 针对T-cadherin启动子甲基化的引物序列是: 上游引物: 5'-TCGCGGGGTTCGTTTTTCGC-3', 下游引物: 5'-GACGTTTTCATTCATACACGCG-3', 扩增出243个碱基对, PCR扩增的产物在20 g/L的琼脂糖凝胶验证.
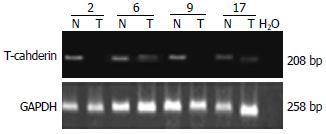
1.2.2 逆转录聚合酶链反应(RT-PCR): 用TRIzol分别从20例肝细胞癌组织和其对应的癌旁组织中提取总RNA, 提取步骤按照TRIzol试剂的说明进行. 用2 μg RNA作为模板进行逆转录反应. PCR反应的引物序列按Wang et al[8]和Sakai et al[9]所述. 上游引物: 5'-TTCAGCAGAAAGTGTTCCATAT-3', 下游引物: 5'-GTGCATGGACGAACAGAGT-3'. 内参GAPDH做为对照, 上游引物: 5'-AGAAGGCTGGGGCTCATTTG-3', 下游引物: 5'-AGGGGCCATCCACAGTCTTC-3'. 循环过程包括: 94℃ 5 min; 94℃ 30 s; 50℃ 1 min; 72℃ 1 min; 共32个循环; 最后72℃ 10 min. PCR的产物在20 g/L琼脂糖凝胶电泳验证.
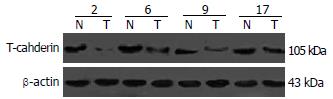
1.2.3 蛋白质免疫印迹杂交: 用三去污裂解液从10例肝癌组织和癌旁组织提取蛋白(用单去污裂解液从肝癌细胞株中提取蛋白), 每孔加入80 μg蛋白, 以10% SDS-PAGE凝胶电泳分离, 电转印将蛋白质转移到硝酸纤维膜(NC膜), 用含5%脱脂奶粉的TBST缓冲液37℃下封闭NC膜1 h, 将兔抗人T-cadheirn一抗和β-actin用含5%脱脂奶粉的TBST缓冲液以1:1000和1:200稀释后分别置入含有NC膜的杂交袋中4℃孵育过夜, TBST漂洗数次后, 再以1:5000稀释的HRP标记羊抗兔IgG中于37℃孵育1 h, TBST漂洗数次, 采用ECL化学发光试剂于暗室中进行放射自显影.
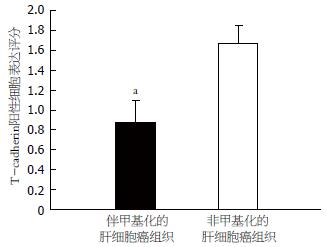
1.2.4 免疫组织化学: 组织标本行4 μm厚连续切片, 组织切片常规脱蜡、水化, 抗T-cadherin一抗用磷酸盐缓冲液(PBS)以1:100稀释后孵育过夜, 余后采用上海基因公司代理Dako公司二步法抗兔/鼠通用型免疫组化检测试剂盒的步骤. PBS代替一抗作为阴性对照. 结果判断根据阳性细胞所占百分比进行评分, T-cadherin阳性细胞为细胞膜被染成棕黄色, 100倍镜头下任意选取10个视野, 400倍镜头下在每一视野中连续记数100个癌细胞, 记录其中阳性细胞数, 计算阳性细胞百分数, 取平均数后从0到4评分. 0: ≤5%阳性细胞数; 1: 6%-25%阳性细胞数; 2: 26%-50%阳性细胞数; 3: 51%-75%阳性细胞数; 4: ≥76%阳性细胞数.
1.2.5 细胞增殖实验: 肝癌细胞株HepG2被培养在含有100 mL/L的胎牛血清、青霉素和链霉素的DMEM培养液中. 104个细胞被种植在直径为6 cm的18个培养皿中, 18个皿被分成两组, 每组9个皿. 一组细胞被种植在上述普通的培养液中, 另一细胞被种植在含去甲基化药物终浓度为2 μmol/L的培养液中, 培养液每3 d换1次. 两组细胞在第3、5、7天各计数一次, 每次每组选3个皿计数取平均值. 分别以0、1、2、4、8、10、20、40 μmol/L的药物浓度培养细胞, 在2 μmol/L的药物浓度时观察到既能让细胞保持较好的生长状态又能保证不因药物剂量过大而致的细胞毒性作用. 每次细胞计数结束, 收集细胞做Western blot分析.
统计学处理 所有数据均采用mean±SD表示, 以α = 0.05为检验水准. 应用SPSS11.5对实验结果进行统计学处理.
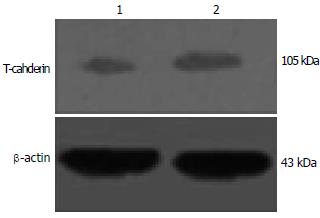
对20例肝细胞癌组织、癌旁组织中T-cadherin甲基化的状态及其表达水平的研究表明: 在肝细胞癌组织中有8例出现甲基化, 而在癌旁组织中没有出现甲基化, 均表现出非甲基化(图1). 证明T-cadherin启动子的甲基化与肝癌恶性转化相关. 8例甲基化肝细胞癌组织中T-cadherin mRNA的表达显著低于癌旁组织 (图2); Western blot结果表明8例甲基化的肝组织中T-cadherin蛋白水平低于对应的癌旁组织(图3); 免疫组织化学结果也表明: 这8例存在甲基化的癌组织中T-cadherin蛋白较没有甲基化的12例癌组织中T-cadherin蛋白表达低, 其表达评分分别为0.875±0.227和1.667±0.188, 有显著性差异(P<0.05, 图4), 表明启动子的甲基化是导致T-cadherin在肝细胞癌中表达下调的机制之一.
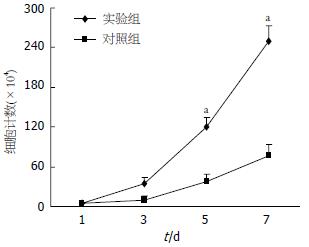
前期实验证实肝癌细胞株HepG2中存在T-cadheirn启动子甲基化现象. 为进一步验证启动子甲基化对T-cadheirn表达的影响, 实验组中将HepG2细胞以浓度为2 μmol/L的去甲基化药物5-aza-2-deoxycytidine培养, 对照组中仅用常规培养基培养, 培养7 d后收集细胞HepG2检测T-cadherin表达, 结果发现, 用去甲基化药物处理过的细胞中T-cadherin蛋白的量明显高于没有用药物处理的细胞(图5). 同时还发现, 以去甲基化试剂培养的HepG2细胞培养第5, 7天计数显著少于以常规培养基培养的细胞(P<0.05, 图6). 表明去甲基化药物5-aza-2-deoxycytidine能恢复T-cadherin表达, 且能抑制HepG2细胞的增殖.
肝癌是我国常见的恶性程度极高的肿瘤之一, 手术切除率低. 肝癌对放疗、化疗均不敏感, 对手术切除后复发和转移的病例及不能手术切除的肝癌, 目前尚无有效的治疗手段, 因此, 深入研究肝癌的发生、转移的分子机制, 探索新的药物治疗靶点对肝癌治疗具有重要意义. T-cadherin是黏附分子家族较为特殊的一种类型, 因为缺失经典cadherin分子所具有的跨膜区而经糖基磷脂酰肌醇分子附着于细胞膜上[9], 故命名truncated-cadherin(即T-cadherin, 又称CDH13或H-cadherin), 他主要介导同种细胞间的黏附[11]和迁移[11]. 研究已经发现重新表达T-cadherin的乳腺癌细胞其增殖特性受抑[1], 而在成神经细胞瘤中, T-cadherin的高表达也能抑制由表皮生长因子诱导的细胞生长、侵袭性反应[13], 说明T-cadherin黏附分子参与了肿瘤的发生、发展过程. 启动子甲基化是导致肿瘤抑制基因沉默的重要原因之一, 这在卵巢癌[14]、胰腺癌[15-16]中已得到证实, 而因启动子甲基化导致T-caderhin在众多的肿瘤中表达下调或缺失已有诸多报道, 在胰腺癌[8]中约58%的T-cadherin的下调表达是由于启动子甲基化引起的, 说明在恶性肿瘤中启动子的甲基化和T-cadherin的表达下调中有直接的相关性.
我们的研究结果表明在20例肝细胞癌中8例存在启动子甲基化, 这8例甲基化的癌组织中T-cadherin的表达水平显著低于其他12例没有甲基化的肝细胞癌组织(P<0.05), 表明T-cadherin甲基化在肝癌中是影响T-cadherin的表达下调的重要机制. 为进一步证实上述结论, 利用肝癌细胞株HepG2中存在T-cadherin启动子甲基化这一特征, 我们应用去甲基化药物来研究是否去甲基化试剂能恢复T-cadherin的表达. 结果表明, HepG2细胞通过去甲基化药物培养后, T-cadherin在HepG2细胞株中的表达上调, 且恢复T-cadherin表达对的HepG2细胞增殖有明显受抑作用.
我们前期研究表明, 将T-cadherin基因导入缺失表达的T-cadherin分子的大鼠胶质母细胞C6细胞使其过度表达T-cadherin分子, C6细胞的增殖及侵袭能力显著受抑, 证实T-cadherin在大鼠胶质母细胞中的肿瘤抑制功能, 并进一步揭示起抑制机制是T-cadherin分子通过诱导p21CIP/WAF1表达致使肿瘤细胞于细胞周期G2期阻滞. 本研究证实在人肝细胞癌中启动子甲基化对T-cadherin的表达下调有密切的相关性, 而去甲基化的药物能恢复T-cadherin在HepG2细胞株中的表达, 并能抑制他的增殖, 证明T-cadherin启动子甲基化导致T-cadherin表达缺失是肝癌恶性转化的机制之一, p21CIP/WAF1基因是否参与肝癌的发生、发展是需要进一步研究. 深入研究T-cadherin基因表达下调或缺失与肝癌的关系, 以及影响T-cadherin表达的分子机制,对进一步探索T-cadherin基因在肝癌发生、发展过程中的作用, 进而发展通过调节T-cadherin基因表达来抑制肿瘤生长的肿瘤治疗研究具有重要意义.
原发性肝癌的实验研究取得了较大进展, 但临床治疗效果却不理想. 从分子水平深入探讨其发生、发展机制对指导临床治疗显得尤为迫切.
季国忠, 副教授, 南京医科大学第二附属医院消化科
黏附分子cadherin参与机体内许多生物过程, 包括调节钙介导的细胞黏附、细胞极性及形态的形成, 细胞的聚集和迁移, 细胞的识别和信号的传导机制. 但T-cadherin在肝细胞癌的发生、发展过程扮演什么角色一直不被人们了解.
本研究通过MSP技术证实了T-cadherin分子在肝细胞癌中存在启动子甲基化, 以及用去甲基化药物能抑制HCC细胞的恶性生物学特征的现象, 有助于从基因水平上了解肝细胞癌的发展规律.
本研究证实T-cadherin分子参与肝癌发生、发展过程, 为下一步的实验提供可靠理论基础.
本文报道内容新颖, 研究方法可行, 结果基本可靠, 具有较好的学术价值.
编辑:李军亮 电编:郭海丽
| 1. | Sato M, Mori Y, Sakurada A, Fujimura S, Horii A. The H-cadherin (CDH13) gene is inactivated in human lung cancer. Hum Genet. 1998;103:96-101. [PubMed] |
| 2. | Lee SW. H-cadherin, a novel cadherin with growth inhibitory functions and diminished expression in human breast cancer. Nat Med. 1996;2:776-782. [PubMed] |
| 3. | Toyooka S, Toyooka KO, Harada K, Miyajima K, Makarla P, Sathyanarayana UG, Yin J, Sato F, Shivapurkar N, Meltzer SJ. Aberrant methylation of the CDH13 (H-cadherin) promoter region in colorectal cancers and adenomas. Cancer Res. 2002;62:3382-3386. [PubMed] |
| 4. | Kawakami M, Staub J, Cliby W, Hartmann L, Smith DI, Shridhar V. Involvement of H-cadherin (CDH13) on 16q in the region of frequent deletion in ovarian cancer. Int J Oncol. 1999;15:715-720. [PubMed] |
| 5. | Lee SW, Reimer CL, Campbell DB, Cheresh P, Duda RB, Kocher O. H-cadherin expression inhibits in vitro invasiveness and tumor formation in vivo. Carcinogenesis. 1998;19:1157-1159. [PubMed] |
| 6. | Roman-Gomez J, Castillejo JA, Jimenez A, Cerv-antes F, Boque C, Hermosin L, Leon A, Granena A, Colomer D, Heiniger A. Cad-herin-13, a mediator of calcium-dependent cell-cell adhesion, is silenced by methylation in chronic myeloid leukemia and correlates with pretreatment risk profile and cytogenetic response to interferon alfa. J Clin Oncol. 2003;21:1472-1479. [PubMed] |
| 7. | Wang RY, Gehrke CW, Ehrlich M. Comparison of bisulfite modification of 5-methyldeoxycytidine and deoxycytidine residues. Nucleic Acids Res. 1980;8:4777-4790. [PubMed] |
| 8. | Sakai M, Hibi K, Koshikawa K, Inoue S, Takeda S, Kaneko T, Nakao A. Frequent promoter methylation and gene silencing of CDH13 in pancreatic cancer. Cancer Sci. 2004;95:588-591. [PubMed] |
| 9. | Angst BD, Marcozzi C, Magee AI. The cadherin superfamily: diversity in form and function. J Cell Sci. 2001;114:629-641. [PubMed] |
| 10. | Vestal DJ, Ranscht B. Glycosyl phosphatidylinositol--anchored T-cadherin mediates calcium-dependent, homophilic cell adhesion. J Cell Biol. 1992;119:451-461. [PubMed] |
| 11. | Philippova M, Ivanov D, Tkachuk V, Erne P, Resink TJ. Polarisation of T-cadherin to the leading edge of migrating vascular cells in vitro: a function in vascular cell motility? Histochem Cell Biol. 2003;120:353-360. [PubMed] |
| 12. | Huang ZY, Wu Y, Hedrick N, Gutmann DH. T-cadherin-mediated cell growth regulation involves G2 phase arrest and requires p21(CIP1/WAF1) expression. Mol Cell Biol. 2003;23:566-578. [PubMed] |
| 13. | Takeuchi T, Misaki A, Liang SB, Tachibana A, Hayashi N, Sonobe H, Ohtsuki Y. Expression of T-cadherin (CDH13, H-Cadherin) in human brain and its characteristics as a negative growth regulator of epidermal growth factor in neuroblastoma cells. J Neurochem. 2000;74:1489-1497. [PubMed] |
| 14. | Merlo A, Herman JG, Mao L, Lee DJ, Gabrielson E, Burger PC, Baylin SB, Sidransky D. 5' CpG island methylation is associated with transcriptional silencing of the tumour suppressor p16/CDKN2/MTS1 in human cancers. Nat Med. 1995;1:686-692. [PubMed] |
| 15. | Dammann R, Schagdarsurengin U, Liu L, Otto N, Gimm O, Dralle H, Boehm BO, Pfeifer GP, Hoang-Vu C. Frequent RASSF1A promoter hypermethylation and K-ras mutations in pancreatic carcinoma. Oncogene. 2003;22:3806-3812. [PubMed] |
| 16. | Fukushima N, Sato N, Ueki T, Rosty C, Walter KM, Wilentz RE, Yeo CJ, Hruban RH, Goggins M. Aberrant methylation of preproenkephalin and p16 genes in pancreatic intraepithelial neoplasia and pancreatic ductal adenocarcinoma. Am J Pathol. 2002;160:1573-1581. [PubMed] |