修回日期: 2008-03-05
接受日期: 2008-04-11
在线出版日期: 2008-04-18
目的: 对特异性抗肝癌单链抗体(single chain variable fragment, scFv)DM同步进行人源化和优化, 以获得亲和力高和免疫原性低的人源化抗肝癌单链抗体.
方法: 通过分子结构和序列分析, 确定对抗原结合位点的构象有重要影响的骨架区(FR)残基, 把难以判断回复突变残基的人、鼠源副本同时编入人源化抗体序列中; 通过重叠延伸PCR技术合成人源化抗体全基因, 利用噬菌体展示技术构建人源化组合抗体库; 通过肝癌细胞筛选阳性克隆, ELISA方法测定各个克隆抗原结合活性; 用硫氰酸盐洗脱法测定并比较亲本抗体和人源化scFv的相对亲和力.
结果: 成功构建人源化组合抗体库, 实际库容4.77×105, 包含由25不同重链和22不同轻链组成的128种人源化DM; 经过筛淘及ELISA鉴定, 获得HDM1、HDM2和HDM3 3个阳性克隆, 相对亲和力指数分别为HDM1 1.6 mol/L、HDM2 1.2 mol/L和HDM3 2.2 mol/L.
结论: 抗体库优化法是一个高效、简便的人源化方法; 获得的3株阳性克隆HDM1、HDM2、HDM3与亲本抗体DM同样具有良好的抗原结合特异性和较高的亲和力.
引文著录: 叶刚, 杨冬华, 汤绍辉, 黄卫, 丁世华, 罗静兰. 抗体库优化策略对特异性抗肝癌单链抗体的人源化. 世界华人消化杂志 2008; 16(11): 1144-1150
Revised: March 5, 2008
Accepted: April 11, 2008
Published online: April 18, 2008
AIM: To humanize and optimize the single chain variable fragment (scFv) DM specific against hepatocellular carcinoma (HCC), and simultaneously to get humanized scFvs with high affinity and low immuogenicity.
METHODS: The amino acid sequence and the model structure of scFv DM were investigated to identify murine framework residues that most likely contribute to the integrity of binding site. All the residues that were difficult to decide were included as human and murine alternatives in the combinatorial library. The full-length humanized scFv gene fragments were synthesized with splicing overlap extension-polymerase chain reaction (SOE-PCR). Phage display technique was used to construct a humanized combinatorial library. Hepatocarcinoma cell-specific scFvs were selected by panning with HCC cell line, and the specificity of those selected scFvs for HCC was detected by enzyme linked immunosorbent assay (ELISA). The relative affinities of phage antibodies of the positive clones and the primitive clone DM were measured by ELISA using thiocyanate elution.
RESULTS: A humanized combinatorial library was constructed successfully, and the real content of the library was 4.77 × 105 and contained a total of 128 variant humanized DM consisting of 25 different heavy chains and 22 different light chains. Three selected positive clones HDM1, HDM2, and HDM3 were obtained after two rounds of panning and ELISA detection, and their relative affinities were 1.6, 1.2 and 2.2 mol/L, respectively.
CONCLUSION: Combinatorial library strategy is an effective and simple method for humanization of antibodies. All of the selected positive clones, HDM1, HDM2 and HDM3, have high specificity and affinity against HCC as the primitive clone DM.
- Citation: Ye G, Yang DH, Tang SH, Huang W, Ding SH, Luo JL. Optimized humanization of a single chain variable fragment against hepatocellular carcinoma using a combinatorial library. Shijie Huaren Xiaohua Zazhi 2008; 16(11): 1144-1150
- URL: https://www.wjgnet.com/1009-3079/full/v16/i11/1144.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i11.1144
肝癌是一种常见的恶性肿瘤, 起病隐匿, 进展快, 转移早, 预后差, 目前临床早期诊治仍较难. 单链抗体(single chain variable fragment, scFv)分子质量小, 容易进入病灶组织的周围循环及在肾内清除快; 缺少恒定区(Fc段), 不与具有Fc受体的非靶细胞结合, 因此在体内定位诊断时背景低、图像清晰[1], 在肿瘤的影像分析[2]、导向治疗[3-4]和新药设计[5]等多个领域具有广阔的应用前景. 但由于鼠源性抗体会诱导人体产生针对鼠源性蛋白的人抗鼠抗体(HAMA), 影响治疗效果, 又可能诱发过敏反应, 鼠源性抗体必须经过人源化改造方可应用于临床[6-7]. 我们在2001年构建成鼠抗人肝癌噬菌体scFv库[8]后, 成功利用噬菌体抗体库技术成功筛选出特异性抗肝癌单链抗体HscFv 4-16(GenBank登录号: DQ640759), 并在体外进行亲和力成熟改造, 获得具有高亲和力抗肝癌scFv DM[9-10]. 现采用组合抗体库优化法[11]的人源化策略对scFv DM进行人源化改造, 以获得特异性强、亲和力高、免疫原性低的人源化抗肝癌scFv, 为肝癌的导向诊断和治疗提供新手段和新方法.
肝癌细胞特异性单链抗体DM的核苷酸序列由本课题组提供; 同源蛋白分析借助基因数据库(EMBL+GenBank+DDBJ), 参考蛋白的结构坐标来源于蛋白质晶体结构数据库(the Protein Data Bank, PDB); 所有分子模建、能量优化均在Sgi图形工作站上, 采用Accelrys公司的Insight lI 98商用软件包完成; 高保真Pyrobest DNA聚合酶、SfiⅠ内切酶、NotⅠ内切酶均购自TaKaRa公司; Lingation High DNA连接酶购自ToYoBo公司; 凝胶回收试剂盒、质粒提取试剂盒、DNA片段纯化试剂盒均购自Omega公司; 大肠杆菌TG1、大肠杆菌HB2151、载体pCANTAB 5E、辅助噬菌体M13K07和HRP标记抗M13 mAb均购自Amershan公司; 人肝癌细胞株(Bel-7402, HepG2, SMMC7721)和正常人胎肝细胞株(L-02)由本室保存, 购自武汉大学中国典型培养物保藏中心. 引物由上海英骏生物技术公司合成.
通过IgBlast搜索基因数据库(EMBL+GenBank+DDBJ+Kabat Database)[12], 确定与DM单链抗体FR同源性最高的人VH和VL胚系基因序列[13]. 将鼠源抗体CDR插入到已选择好的人FR, 然后检查FR序列, 确定鼠、人序列之间不同的氨基酸残基. 采用同源模建方法模建鼠源单链抗体DM的三维结构[14], 按文献[15-16]结合分析抗体结构和鼠源抗体FR重要残基, 评价每个不同残基对抗原结合的重要性, 对应该回复突变的残基做出判断. 最后将难以确定对抗原结合的重要性残基的鼠源、人源副本均编入人源化抗体序列.
1.2.1 人源化抗肝癌噬菌体单链抗体全基因的合成: 分别将重链和轻链拆分为大小约60 bp的寡核苷酸序列, 片段之间重叠约20 bp, 采用重叠延伸PCR(splicing overlapping extension-PCR, SOE-PCR)方法[17-18]合成scFv. (1)轻、重链寡核苷酸链引物1-9(表1)各5 pmol与0.25 μL Pyrobest高保真DNA聚合酶进行PCR反应(50 μL). PCR反应程序设置: 94℃ 30 s, 58℃ 45 s, 72℃ 60 s, 32个循环后, 72℃ 10 min. 凝胶电泳检测并回收PCR产物. (2)扩增P1-2, P3-4, P6-7, P8-9: 将P1和P2, P3和P4, P6和P7, P8和P9 PCR产物等摩尔混合, 加入上下游引物, 98℃ 10 s, 63℃ 60 s, 6个循环后, 98℃ 30 s, 63℃ 45 s, 72℃ 90 s, 32个循环后, 72℃ 10 min. (3)扩增重链(P1-2-3-4)和轻链(P6-7-8-9): PCR设置同上一轮反应. (4) 将重链, Linker(P5), 轻链PCR产物等摩尔混合, 按相同反应条件进行重叠延伸PCR反应. (5)在PCR产物加上酶切位点, PCR反应条件: 95℃ 5 min, 94℃ 30 s, 63℃ 45 s, 72℃ 90 s, 32个循环后, 72℃ 10 min. 凝胶电泳检测并回收基因片段, 产物纯化后备用.
| 引物名称 | 引物序列 |
| F1 | 5'<atggcccaggtg(a/c)agctggtgcagtctggggctgag gtg aag aag cct ggg gcc tca gtg a>3' |
| R1 | 5'<acttgtggagatgtatccagaagccttgcaggagaccttcactgaggccccaggcttc>3' |
| F2 | 5'<gga tac atc tcc aca agt tat gat ata gac tgg gtg cga cag gcc cct gga caaggg c>3' |
| R2 | 5'<agtactcccctctccaggaaaaatccatccaatccactcaagcccttgtccaggggcc>3' |
| F3 | 5'<ttt cct gga gag ggg agt act gaa tac aat gag aag ttc aag ggc aggg(c/t)c acc ctg a>3' |
| R3 | 5'<ctccatgtaggctgtgctgatggac(t/g) tgtctac(a/g)(c/a) tcagggtg(g/a)ccctgcccttgaac>3' |
| F4 | 5'<agc aca gcc tac atg gag ctg a(c/g)(t/c)agg ctg aga tct gac gac acg gccgtg tat t>3' |
| R4 | 5'<ccacaagtcaaagtagagcctatagtagtcccctctcgcacagaaatacacggccgtgt>3' |
| F5 | 5'<ctc tac ttt gac ttg tgg ggc caa ggg acc acg gtc acc gtc tct tca ggt ggaggc g>3' |
| R5 | 5'<gatgtcagatccgccaccgccagagccacctccgcctgaaccgcctccacctgaagag>3' |
| F6 | 5'<ggt ggc gga tct gac atc gag ttg acc cag tct cca gcc acc ctg tct ttg tctcca gg>3' |
| R6 | 5'<tgt act tga gct ggc act gca gg(t/a) gag ggt ggc tct ttc ccc tgg aga caaaga cag g>3' |
| F7 | 5'<agt gcc agc tca agt aca cgt tac ata tat tgg tac caa cag aaa cct ggc caggct c>3' |
| R7 | 5'<agccacgttggatgtgtcatagatgaggagcctgggagcctggccaggtttctgttggt>3' |
| F8 | 5'<tat gac aca tcc aac gtg gct cct ggc(g /a)tc cca ttt agg ttc agt ggcagt ggg tct g>3' |
| R8 | 5'<ttcaggctctaggctgctgatggtgagagtataagatgtcccagacccactgccactga>3' |
| F9 | 5'<agc agc cta gag cct gaa gat ttt gcc gtt tat tac tgt cag gag cgg agt ggttat c>3' |
| R9 | 5'<tcgtttgatctccagcttggtccctccgccgaacgtgtacggataaccactccgctcct>3' |
| 测序引物S1 | 5'-caa cgt gaa aaa att att cgc-3' |
| 测序引物S6 | 5'-gta aat gaa ttt tct gta tga gg-3' |
1.2.2 抗肝癌噬菌体scFv的人源化组合抗体库的构建: 将scFv PCR产物予SfiⅠ、NotⅠ双酶切后, 按scFv基因与载体pCANTAB 5E 3:1的摩尔比进行连接. pCANTAB 5E-scFv经电穿孔转化入电感受态大肠杆菌TG1. 用SOBAG(含100 g/L的氨苄青霉素)平板筛选并测定库容量. 随机挑取10个克隆接种培养, 次日抽提质粒DNA, 以质粒DNA为模板进行PCR反应检测, 测目的基因插入率. 再进一步以其中一个质粒DNA为模板, 分别取F1up/R2down, F1up/R4down, F1up/R6, F3up/R9down, F1up/R8, F1up/R9down为引物, 进行PCR扩增. 对噬菌体突变库进行2轮"挽救-吸附-洗脱-扩增"富集筛选. 从最后1轮洗脱的噬菌体抗体库中挑选共90个克隆制备噬菌体抗体. 以肝癌细胞(浓度为108/L)包被ELISA板, 正常肝细胞作为阴性对照, 经1 g/L BSA封闭后加入待测噬菌体抗体上清, 同时设3个复孔; 然后以1:5000 HRP标记的抗M13为Ⅱ抗, 孵育, 洗涤后OPD底物显色, 标本A490值大于阴性对照2倍以上者为阳性将阳性克隆送上海英骏生物技术有限公司进行scFv基因序列测定, 采用S1, S6测序引物进行测序.
1.2.3 人源化抗肝癌scFv的分泌表达: 3个阳性克隆表达的噬菌体抗体10 μL加到400 μL对数生长期的HB2151细胞400 μL中, 37℃振荡培养30 min; 将每个克隆的培养物接种于SOBAG-N平板上, 30℃培养过夜. 挑单菌落, 接种2×YT-AG中, 30℃培养过夜; 将过夜培养菌加入2×YT-AG中, 30℃培养1 h. 离心, 去上清, 加入50 mL 2×YT-AI(I为终浓度1 mmol/L IPTG), 30℃培养16 h. 离心15 min, 取上清, 即为含诱导表达的抗肝癌scFv抗体片段的培养上清, 置4℃保存备用[19].
1.2.4 相对亲和力测定: 参照文献[20-21]的方法, 将肝癌细胞(Bel-7402, HepG2, SMMC7721)加入96孔培养板, 培养24 h; 0.5 g/L戊二醛固定, PBS/20 g/L脱脂牛奶封闭后加入抗体, 每个阳性克隆或原始克隆各加9个孔; 再加入不同浓度硫氰酸铵, 浓度依次为0、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 mol/L, 各孔内加入1:5000 HRP标记抗M13 mAb. 孵育, 洗涤后OPD底物显色. 以未加硫氰酸铵溶液孔的A值为100%, A值降低50%时所对应的硫氰酸铵溶液的浓度, 即为此抗体的相对亲和力指数.
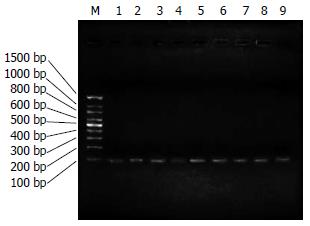
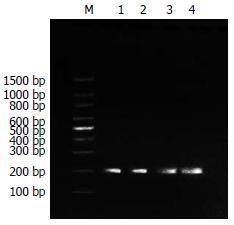
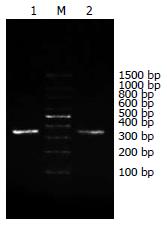
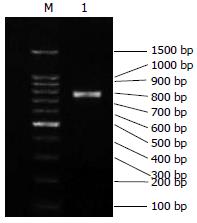
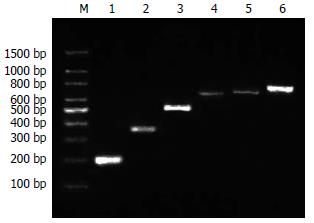
(1)通过分析抗体结构和鼠源抗体FR重要残基, 将人、鼠VH和VL的FR序列的20个和23个不同残基, 划分为28个人源化残基、8个回复突变残基和7个难以确定残基; (2)将人源化单链抗体序列拆分为F1-9和R1-9共18个大小约60 bp, 以F1/R1, F2/R2, F3/R3, F4/R4, F5/R5, F6/R6, F7/R7, F8/R8, F9/R9互为引物和模板, 经过首轮重叠延伸PCR, 获得大小约为100 bp的片段(图1); (3)经过第2轮重叠延伸PCR, 将P1和P2, P3和P4, P6和P7, P8和P9拼接, 获得大小约为180 bp的片段(图2); (4)经过第3轮重叠延伸PCR, 将P1-2和P3-4, P6-7和P8-9拼接, 获得P1-2-3-4(重链)、P6-7-8-9片段(轻链), 大小约340 bp(图3); (5)经过第4轮重叠延伸PCR, 将P1-2-3-4、P5、P6-7-8-9片段拼接为P1-9, 大小约750 bp, 与理论值相符(图4).
转化的细菌在含有氨苄青霉素的平板上均生长良好, 基因插入率为90%. 再进一步以其中一个质粒DNA为模板, 分别取F1up/R2down, F1up/R4down, F1up/R6, F3up/R9down, F1up/R8, F1up/R9down为引物, 进行PCR扩增, 获得PCR产物P1-2, P1-4, P1-6, P3-9, P1-8, P1-9, 经15 g/L琼脂糖凝胶电泳, 结果显示条带与理论值200、, 360、520、600、680、770 bp基本一致(图5). 将其中4个克隆的质粒DNA送上海英骏公司测序, 序列正确. PCR鉴定和测序结果证明人源化组合抗体库的构建成功, 实际库容为4.77×105. 从构建的抗肝癌噬菌体scFv人源化组合库中随机挑选出90个克隆, 经ELISA鉴定, 有24个克隆的A490值高于阴性对照的A490值2倍以上, 提示这24个单克隆菌株是能特异性结合肝癌细胞的阳性克隆.
23个特异性抗肝癌人源化scFv的基因序列被成功测出, 获得3个不同的基因序列, 分别命名为HDM1、HDM2、HDM3. 借助NCBI的BL2seq, 将3条基因序列与亲本抗体scFvDM序列比对, 结果提示人源化后VH骨架区的同源性由原来的76%提高到91%, VL骨架区的同源性从79%提高到83%. 将3条人源化抗体的骨架区氨基酸序列作比较结果见表2.
| 抗体 | 残基(暴露度) | ||||||
| H5 | H67 | H70 | H73 | H82A | L22 | L58 | |
| 0.82 | 0.00 | 0.79 | 0.43 | 0.58 | 0.69 | 0.13 | |
| DM | K | A | S | K | T | T | V |
| 人模板 | Q | V | T | T | S | S | I |
| HDM1 | K | V | T | K | T | S | V |
| HDM2 | Q | V | T | K | T | S | V |
| HDM3 | K | V | T | K | T | S | I |
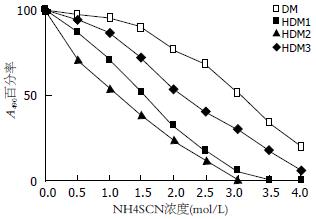
以硫氰酸盐洗脱法对亲本scFv DM及3株阳性克隆HDM1、HDM2、HDM3的可溶性抗体进行相对亲和力测定. 亲本scFv DM可溶性抗体对应的NH4SCN浓度即相对亲和力指数为3.0 mol/L, HDM1为1.6 mol/L, HDM2为1.2 mol/L, HDM3为2.2 mol/L(图6). HDM1、HDM2和HDM3的相对亲和力指数分别为亲本抗体的0.54、0.40和0.74.
抗体人源化后亲和力常较原亲本抗体的明显减弱, 可降低为亲本抗体的1/2-1/100[22]. 研究结果显示, 其具有支持作用的FR的某些氨基酸残基参与CDR的空间构象, 甚至直接与抗原相互作用[23-24], 单纯将鼠源抗体的CDR移植到人抗体的FR所获得的人源化抗体很难保持亲本抗体的亲和力和特异性[25]. 学者常根据已发表的信息, 确定FR中起关键作用的氨基酸, 通过逐次试着将一些FR残基回复突变为鼠残基, 使抗体恢复亲和力[26], 这样既繁琐, 效率也低. 我们采用抗体库优化FR的策略对scFv进行人源化, 先通过分子结构分析找出可能影响抗原结合部位立体结构的骨架区残基, 将这些残基的鼠源副本和人源副本同时组合到一个抗体库中, 构建人源化组合抗体库, 借助噬菌体展示技术强大的筛选能力寻找最佳组合, 确定哪些位置需要保留亲本鼠源残基, 达到优化的作用. 本实验通过重叠延伸PCR技术合成人源化抗体全基因, 并克隆到噬菌粒载体pCANTAB 5E, 通过电穿孔转化到大肠杆菌, 利用抗体库技术成功构建抗肝癌scFv人源化组合抗体库, 库容4.77×105, 包含了由25不同重链和22不同轻链组成的128种人源化DM.
噬菌体展示技术的优越性在于具有极强的筛选功能, 是一种极高效的表达、筛选体系. 噬菌体抗体的抗体分子以融合蛋白的形式表达在噬菌粒外膜上, 相当于体内B细胞的膜型表达, 使我们能在体外模拟体内的抗原对特异性抗体的克隆选择过程[6]. 通过与抗原的结合, 洗涤除去不结合的噬菌体, 将结合于抗原的噬菌体洗脱下来, 同时由于噬菌体对大肠杆菌的感染性, 使噬菌体抗体库技术能够以淘洗的方式, 达到富集的目的, 为快速选择特异性抗体提供了简便而高效的筛选系统[18]. 一般每一轮的筛选可富集50-1000倍[27], 因此我们按库容大小设计为仅筛淘2次, 然后在最后1次筛淘后, 随机挑取90克隆制备噬菌体抗体, 以肝癌细胞包被作固相抗原, 通过ELISA鉴定出24个阳性克隆, 送去测序, 获得3个克隆的序列. 以硫氰酸盐洗脱法对亲本scFv DM及3株阳性克隆HDM1、HDM2、HDM3的可溶性抗体进行相对亲和力测定. 亲本scFv DM对应的NH4SCN浓度即相对亲和力指数为3.0 mol/L, HDM1为1.6 mol/L, HDM2为1.2 mol/L, HDM3为2.2 mol/L, 提示获得的3株阳性克隆HDM1、HDM2、HDM3与亲本抗体DM同样具有良好的抗原结合特异性和较高的亲和力.
分析3个阳性克隆HDM1、HDM2、HDM3的氨基酸序列发现, 3个克隆的轻链均包含了人抗体残基SerL22, 重链H67, H70残基均为人抗体残基, 分别是Val和Thr; 重链H73, H82A均为鼠抗体残基, 分别是Lys和Thr; 3个克隆的H5和L58号残基人、鼠残基都有, 提示H5和L58残基不是必须回复突变残基. L22和H70残基的暴露度分别为0.69、0.79, 属于大部分暴露残基; H5的暴露度为0.82, 属暴露残基, 3个阳性克隆的L22, H70都是人抗体残基, H5人、鼠残基都有, 表明L22, H5, H70均可人源化, 提示将暴露残基或大部分暴露残基人源化, 对抗原抗体结合没有不利影响, 与Padlan et al[28]的推论相符. H73, H82A均为部分包埋残基, 3个阳性克隆的H73, H82A均为鼠残基, 提示H73和H82A的重要性, 人源化可能对抗原抗体的结合有影响. L58, H67均为包埋残基, H67在3个阳性克隆中均为人抗体残基Val, L58在HDM3以人抗体残基Ile出现, 在另两个克隆中则为鼠抗体残基Val, 提示包埋残基L58, H67为可人源化残基. Rosok et al[29]的实验结果也证明了在人源化时不是所有的包埋残基都必须回复突变. 本实验借助抗体库对多样化抗体的强大筛选能力, 通过筛选确定需保留的亲本残基, 达到优化人源化抗体的目的.
总之, 本实验通过抗体库优化法, 成功对抗肝癌scFv DM进行人源化, 获得3株与亲本抗体具有同样良好的抗原结合特异性和较高的亲和力的阳性克隆, 并帮助判断必须回复突变的重要残基, 证明抗体库优化法是一个高效、实用的人源化方法, 可一步就实现人源化和优化FR的目的, 为快速获取高亲和力的人源化抗体提供了新手段.
单链抗体(scFv)分子质量小, 容易进入病灶组织的周围循环及在肾内清除快; 缺少恒定区(Fc段), 不与具有Fc受体的非靶细胞结合, 因此在体内定位诊断时背景低、图像清晰, 在肿瘤的影像分析、导向治疗和新药设计等多个领域具有广阔的应用前景.
张占卿, 主任医师, 上海市复旦大学公共卫生中心
近年来对肝癌单克隆抗体在肝癌检测诊断及导向治疗的深入研究, 为肝癌的诊疗带来了新的前景. 但鼠源性抗体, 作为异种蛋白应用于人体有很强的免疫原性, 临床反复多次用药, 会使人体内产生人抗小鼠抗体(HAMA), 可使临床疗效减弱甚至消失, 或诱发过敏反应, 临床应用受限.
截至2007年, 12个人源化抗体被批准上市. 1986年Jones et al首次采用CDR移植技术, 将鼠源抗体的CDR移植到人的重链FR上, 使免疫原性降低为原来的10%, 开创了真正意义的人源化抗体-改形抗体(RAb).
本研究通过不同的人源化策略将抗体进行人源化改造, 可明显降低甚至完全消除抗体的免疫原性.
抗体库优化FR法为实现人源化和优化FR, 快速获取高亲和力的人源化抗体提供了一种新手段.
本文设计合理, 科学性强, 有一定的参考价值.
编辑:程剑侠 电编:郭海丽
| 1. | Pavlinkova G, Colcher D, Booth BJ, Goel A, Batra SK. Pharmacokinetics and biodistribution of a light-chain-shuffled CC49 single-chain Fv antibody construct. Cancer Immunol Immunother. 2000;49:267-275. [PubMed] |
| 2. | Sundaresan G, Yazaki PJ, Shively JE, Finn RD, Larson SM, Raubitschek AA, Williams LE, Chatziioannou AF, Gambhir SS, Wu AM. 124I-labeled engineered anti-CEA minibodies and diabodies allow high-contrast, antigen-specific small-animal PET imaging of xenografts in athymic mice. J Nucl Med. 2003;44:1962-1969. [PubMed] |
| 3. | Cooke SP, Pedley RB, Boden R, Begent RH, Chester KA. In vivo tumor delivery of a recombinant single chain Fv::tumor necrosis factor-alpha fusion [correction of factor: a fusion] protein. Bioconjug Chem. 2002;13:7-15. [PubMed] |
| 4. | Deckert PM, Renner C, Cohen LS, Jungbluth A, Ritter G, Bertino JR, Old LJ, Welt S. A33scFv-cytosine deaminase: a recombinant protein construct for antibody-directed enzyme-prodrug therapy. Br J Cancer. 2003;88:937-939. [PubMed] |
| 5. | von Minckwitz G, Harder S, Hovelmann S, Jager E, Al-Batran SE, Loibl S, Atmaca A, Cimpoiasu C, Neumann A, Abera A. Phase I clinical study of the recombinant antibody toxin scFv(FRP5)-ETA specific for the ErbB2/HER2 receptor in patients with advanced solid malignomas. Breast Cancer Res. 2005;7:R617-R626. [PubMed] |
| 6. | Kim SJ, Park Y, Hong HJ. Antibody engineering for the development of therapeutic antibodies. Mol Cells. 2005;20:17-29. [PubMed] |
| 11. | Son JH, Lee UH, Lee JJ, Kwon B, Kwon BS, Park JW. Humanization of agonistic anti-human 4-1BB monoclonal antibody using a phage-displayed combinatorial library. J Immunol Methods. 2004;286:187-201. [PubMed] |
| 12. | Zhang Y, Li ZS, Sun M, Zheng QC, Sun CC. Molecular simulation studies of a selenium-containing scFv catalytic antibody that mimics glutathione peroxidase. Biochim Biophys Acta. 2005;1747:27-34. [PubMed] |
| 13. | Hwang WY, Almagro JC, Buss TN, Tan P, Foote J. Use of human germline genes in a CDR homology-based approach to antibody humanization. Methods. 2005;36:35-42. [PubMed] |
| 15. | Vargas-Madrazo E, Paz-Garcia E. An improved model of association for VH-VL immunoglobulin domains: asymmetries between VH and VL in the packing of some interface residues. J Mol Recognit. 2003;16:113-120. [PubMed] |
| 16. | Staelens S, Desmet J, Ngo TH, Vauterin S, Pareyn I, Barbeaux P, Van Rompaey I, Stassen JM, Deckmyn H, Vanhoorelbeke K. Humanization by variable domain resurfacing and grafting on a human IgG4, using a new approach for determination of non-human like surface accessible framework residues based on homology modelling of variable domains. Mol Immunol. 2006;43:1243-1257. [PubMed] |
| 17. | Yang DF, Zhu HF, Wang ZH, Shen GX, Tian DY. Construction of single chain Fv antibody against transferrin receptor and its protein fusion with alkaline phosphatase. World J Gastroenterol. 2005;11:3300-3303. [PubMed] |
| 18. | Yazaki PJ, Sherman MA, Shively JE, Ikle D, Williams LE, Wong JY, Colcher D, Wu AM, Raubitschek AA. Humanization of the anti-CEA T84.66 antibody based on crystal structure data. Protein Eng Des Sel. 2004;17:481-489. [PubMed] |
| 19. | Wei J, Liu Y, Yang S, Xu J, Kong H, Han B, Bao Y, Wu Y, Yin W, Li W. Screening of single-chain variable fragments against TSP50 from a phage display antibody library and their expression as soluble proteins. J Biomol Screen. 2006;11:546-552. [PubMed] |
| 20. | 王 刚, 王 琰. 硫氰酸盐洗脱法测定噬菌体抗体的相对亲和力. 中华微生物学和免疫学杂志. 2000;20:355-357. |
| 21. | 汪 保安, 陈 晓穗, 王 欲晓, 曲 佳, 周 丽君, 王 琰. 通过随机突变提高抗TNF-α单链抗体的亲和力. 细胞与分子免疫学杂志. 2005;21:445-448. |
| 22. | O'Connor P. Natalizumab and the role of alpha 4-integrin antagonism in the treatment of multiple sclerosis. Expert Opin Biol Ther. 2007;7:123-136. [PubMed] |
| 23. | Foote J, Winter G. Antibody framework residues affecting the conformation of the hypervariable loops. J Mol Biol. 1992;224:487-499. [PubMed] |
| 24. | Li Y, Li H, Smith-Gill SJ, Mariuzza RA. Three-dimensional structures of the free and antigen-bound Fab from monoclonal antilysozyme antibody HyHEL-63(,). Biochemistry. 2000;39:6296-6309. [PubMed] |
| 25. | Saldanha JW, Martin AC, Leger OJ. A single backmutation in the human kIV framework of a previously unsuccessfully humanized antibody restores the binding activity and increases the secretion in cos cells. Mol Immunol. 1999;36:709-719. [PubMed] |
| 26. | Caldas C, Coelho V, Kalil J, Moro AM, Maranhao AQ, Brigido MM. Humanization of the anti-CD18 antibody 6.7: an unexpected effect of a framework residue in binding to antigen. Mol Immunol. 2003;39:941-952. [PubMed] |
| 27. | Zhang JL, Gou JJ, Zhang ZY, Jing YX, Zhang L, Guo R, Yan P, Cheng NL, Niu B, Xie J. Screening and evaluation of human single-chain fragment variable antibody against hepatitis B virus surface antigen. Hepatobiliary Pancreat Dis Int. 2006;5:237-241. [PubMed] |
| 28. | Padlan EA, Abergel C, Tipper JP. Identification of specificity-determining residues in antibodies. FASEB J. 1995;9:133-139. [PubMed] |
| 29. | Rosok MJ, Yelton DE, Harris LJ, Bajorath J, Hellstrom KE, Hellstrom I, Cruz GA, Kristensson K, Lin H, Huse WD. A combinatorial library strategy for the rapid humanization of anticarcinoma BR96 Fab. J Biol Chem. 1996;271:22611-22618. [PubMed] |