修回日期: 2007-09-17
接受日期: 2007-09-28
在线出版日期: 2007-09-28
目的: 用三硝基苯磺酸(2, 4, 6-trinitrobenzene sulfonic acid, TNBS)复制大鼠急性肠道损伤的动物模型.
方法: SD大鼠64只随机分为制模组、制模对照组及正常对照组, 分别用TNBS(乙醇稀释)、500 mL/L乙醇及生理水灌肠; 观察各组大鼠制模后的粪便、精神状态、进食及存活情况; 分别在第1、3、5、7及10天处死大鼠, 取结肠组织, 进一步观察肠道的大体病理变化和组织病理变化; 再结合病理评分, 总结大鼠TNBS制模后肠道病理改变的规律, 评价该模型用于实验性肠道损伤研究的可行性.
结果: TNBS制模组在制模后第1天即表现出明显的肠道稀便和血便, 持续至实验结束; 进食减少、懒动、畏寒, 持续7-10 d后缓解; 4只在制模后第7-9天死亡(4/34); 制模后第1天即出现肠道病理改变, 第5天出现急性肠道损伤, 第7天病理改变最严重. 制模对照组大鼠在制模后第1天部分出现稀便, 持续1-2 d后消失; 制模后第1天肠道出现轻度病理改变, 3 d后病变减退; 正常对照组大鼠未见异常, 各组大鼠肠道病理评分与病变程度一致.
结论: 大鼠TNBS制模后早期即表现出肠道损伤, 制模后第7天病理改变达到高峰, 此后向慢性炎症转化; TNBS制模后5 d内可用于急性肠道损伤的实验性研究.
引文著录: 邢锐, 马高峰, 杨晓强, 武金宝, 陈学清, 张振书. 大鼠急性肠道损伤动物模型的建立. 世界华人消化杂志 2007; 15(27): 2918-2922
Revised: September 17, 2007
Accepted: September 28, 2007
Published online: September 28, 2007
AIM: To develop a model of acute intestinal injury in rats treated with 2, 4, 6-trinitrobenzene sulfonic acid (TNBS).
METHODS: Sixty-four Sprague-Dawley rats were randomly divided into three groups: model, mock model and control groups. TNBS (ethanol-diluted), 500 mL/L ethanol and physiological saline were administered per rectum to each of the three groups, respectively. Feces, psychosis, appetite and mortality were observed in each group. Rats were killed after 1, 3, 5, 7 and 10 d, and the colon was removed for gross observation and histopathological evaluation. By combining the pathological scores, we summarized the rule of gut pathological change of rats after TNBS treatment and evaluated the feasibility of using the model in the study of intestinal injury.
RESULTS: On the first day, rats in the model group had thin and bloody stools until the end of the experiment. During the study, the rats were lazy, chilled and had loss of appetite. The symptoms lasted for 7-10 d, and alleviated thereafter. Four rats died (4/34) during 7-9 d after TNBS treatment. Pathological changes in the intestine showed up on d 1, acute intestinal injury appeared on d 5, and reached a peak on d 7. In the mock model group, the rats had thin stools on d 1, which persisted for 1-2 d. Pathological changes were mild and vanished on d 3. In the control group, the rats looked normal and there was no pathological change. The pathological score reflected the pathological changes.
CONCLUSION: Intestinal injury emerged at the initial stage and reached a peak 7 d after treatment with TNBS. After that, the pathological changes became chronic. The first 5 d after the rats were treated with TNBS they were suitable for studying acute intestinal injury.
- Citation: Xing R, Ma GF, Yang XQ, Wu JB, Chen XQ, Zhang ZS. Establishment of a rat model of acute intestinal injury. Shijie Huaren Xiaohua Zazhi 2007; 15(27): 2918-2922
- URL: https://www.wjgnet.com/1009-3079/full/v15/i27/2918.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i27.2918
肠道损伤是临床常见的综合征, 有多种表现形式, 既有急性病变, 也有慢性病变; 既可以是肠道本身病变, 也可以是全身病变的局部表现. 复制不同形式的肠道损伤的动物模型, 有利于针对性地开展实验性研究. 我们用三硝基苯磺酸复制了大鼠肠道损伤模型, 并在制模后连续观察了制模大鼠的病变过程.
64只SD大鼠, 雌雄不限, 体质量130-150 g, 由南方医科大学实验动物中心提供; TNBS为Sigma公司产品, 购自南方医科大学试剂中心, 浓度为5 g/L, 与纯乙醇按1:1体积混合, 配制成含500 mL/L乙醇的TNBS溶液, 终浓度为2.5 g/L; Olympus BX40光学显微镜是Olympus公司产品; 其他为国产分析纯.
1.2.1 动物分组及处理集: 60只SD大鼠随机分为3组, 制模组30只, 制模对照组24只, 正常对照组6只; 用30 g/L戊巴比妥钠ip麻醉后, 上述3组大鼠分别经肛门灌肠缓慢注入1 mL的2.5 g/L TNBS、500 mL/L乙醇及生理盐水, 制模后大鼠平躺, 自然清醒, 常规饲养. 制模组和制模对照组大鼠分别于制模后第1、3、5、7天麻醉后各处死6只, 制模组大鼠制模后第10天再处死6只, 正常对照组大鼠制模后第1天全部处死; 全部动物处死前用戊巴比妥钠麻醉. 处死后剖腹观察腹腔及腔管病变, 并剖开肠腔, 观察肠黏膜病变, 进行大体病理评分; 取病变最明显部位肠组织一块, 甲醛固定、包埋、切片、HE染色后行病理组织学观察和评分.
1.2.2 观察和病理评分方法: 每天记录大鼠一般情况变化, 包括粪便性状、进食情况、精神状态及死亡发生情况. 大体病理评分参考王皓 et al标准[1](表1); 病理组织学评分参考Araki[2]及Gulpinar et al[3]评分标准制定, 根据黏膜损伤、隐窝破坏、黏膜出血、间质水肿及炎性细胞浸润轻、中、重程度分别计1、2、3分, 每个标本组织损伤评分取上述5项指标的总和.
| 大体形态 | 评分 |
| 粘连 | |
| 无 | 0 |
| 轻度 | 1 |
| 重度 | 2 |
| 溃疡及炎症 | |
| 无 | 0 |
| 局部充血, 无溃疡 | 1 |
| 1处溃疡不伴充血或肠壁增厚 | 2 |
| 1处溃疡伴炎症 | 3 |
| 2处溃疡伴炎症 | 4 |
| >2处溃疡和/伴炎症>1 cm | 5 |
| 溃疡和/伴炎症>2 cm, 病变每增加1 cm加1分 | 6-8 |
统计学处理 结果以mean±SD表示, 所测数据用SPSS12.0统计软件进行单因素方差分析的LSD检验, 以P≤0.05为有统计学意义.
制模组大鼠制模后第1天即出现稀便、懒动、畏寒及进食减少, 大部分出现血便, 稀便和血便持续至第10天, 精神状态和进食减少, 7 d后逐渐改善; 死亡4只, 发生于制模后7-9 d, 剔除下一步试验, 再补充制模4只; 制模对照组部分大鼠制模后第1天出现稀便, 仅持续1-2 d, 精神状况基本正常, 1 d后进食正常, 无死亡发生; 正常对照组大鼠未见异常.
制模组大鼠在制模后第1天见结肠黏膜充血; 3 d出现腹腔渗出, 肠腔扩张, 结肠黏膜出现溃疡和糜烂, 有出血病灶; 5 d腹腔渗出增多, 结肠黏膜出现多溃疡和出血病灶; 7 d病变最严重, 结肠黏膜出现大的融合性溃疡和广泛出血病灶; 制模后10 d见腹腔渗出减少, 部分大鼠出现腹腔粘连, 大部分大鼠溃疡变小或消失, 结肠黏膜充血和水肿减轻. 制模对照组大鼠腹腔未见病变, 制模后第1天出现肠黏膜轻度充血或毛细血管网消失, 未见溃疡和糜烂形成; 制模3 d后肠道病变消失. 正常对照组大鼠未见异常.
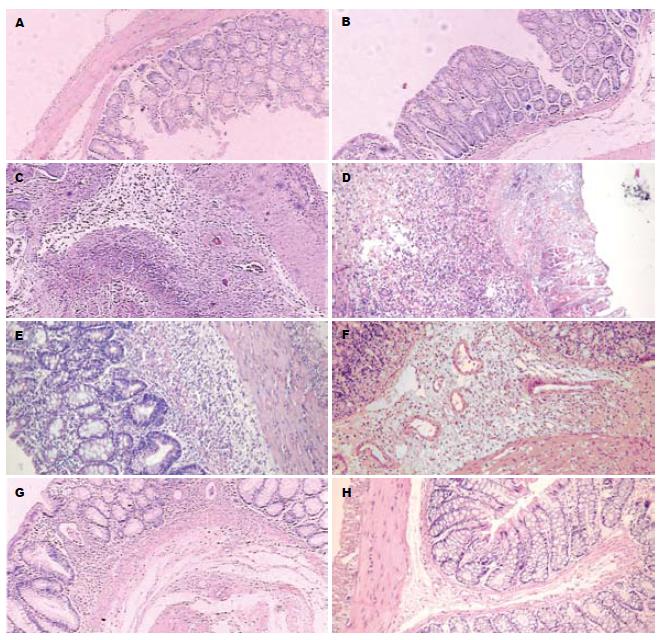
制模组大鼠制模后第1天黏膜充血, 肠黏膜上皮中度受损, 黏膜下层见中量中性炎性细胞浸润, 轻度水肿, 未见出血病灶, 隐窝结构轻度受损(图1A); 第3天出现黏膜溃疡形成, 隐窝中度破坏, 黏膜下见中量中性粒细胞炎性细胞浸润, 黏膜下水肿明显(图1B); 第5天出现黏膜多处溃疡形成, 隐窝变浅, 有出血病灶、坏死病灶形成, 腺体破坏明显, 多处溃疡形成, 伴有黏膜缺损, 全层肠壁炎症浸润, 浆膜有炎性细胞渗出, 黏膜下水肿明显(图1C); 第7天黏膜上皮细胞广泛脱落, 溃疡加深增大, 形成融合性溃疡, 广泛黏膜出血病灶, 肠壁全层炎性细胞浸润, 水肿明显, 有脓肿形成, 隐窝破坏(图1D); 第10天黏膜上皮细胞中度受损, 隐窝破坏减轻, 肠壁全层炎性细胞浸润, 以黏膜和黏膜下层明显, 溃疡病变未加重, 出血和坏死病灶有吸收(图1E). 制模对照组大鼠第1天出现黏膜轻度损害, 黏膜下层轻度水肿, 见中性粒细胞浸润至肌层, 腺体结构未见明显异常, 无出血病灶形成(图1F); 第3天后见黏膜上皮基本完整, 隐窝结构完整, 水肿减轻, 黏膜下层炎性细胞浸润减少(图1G). 正常对照组大鼠组织病理未见明显变化(图1H).
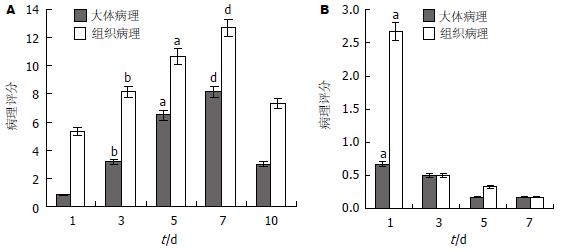
制模组大鼠大体及病理评分均在制模后第7天达到病理改变的高峰; 制模对照组大鼠病理评分仅在制模后第1天明显, 以后病理改变消退(图2A-B).
复制稳定的动物模型是研究肠损伤的必要条件. 复制肠损伤动物模型方法多, 但不同的肠损伤动物模型表现出不同的病理特点. 用TNBS灌肠方法制作炎症性肠道损伤是实验研究中应用较多和较方便的方法[4]. TNBS诱导的大鼠肠损伤模型广泛用于人类各种肠道病变发病机制的研究, 如Yamamoto用TNBS鼠结肠损伤的模型进行IBD发病机制的分子和遗传学研究[5]; Onori et al[6]将TNBS大鼠肠损伤动物模型用于研究非炎症部位肠道肌肉收缩功能障碍; TNBS肠损伤动物模型还用于肠道各种神经和炎症介质表达和传导的研究[7]; 用TNBS肠损伤模型进行的多个研究, 如抗氧化应激[8]、抑制过度的炎症表达[9]、调节免疫平衡等[10]也取得了效果, 所以, TNBS诱导的肠损伤模型涉及多种机制参与其中, 弄清TNBS制模后病理变化过程, 有利于从各个方面研究肠道损伤的发生机制和防治措施.
TNBS是一种是弱有机弱酸, 属于半抗原类物质, 单一使用并不造成组织损害, 但与乙醇联合应用就能导致各种免疫应答, 其机制是乙醇造成黏膜损伤, 使TNBS与组织蛋白结合, 成为完全抗原, 诱导机体发生自身免疫性损伤[11]. 本研究中的病理变化过程也同样证明了这种机制, 假制模对照组大鼠病理改变程度较轻, 且仅在结肠注入乙醇后第1天有一定程度的病理改变, 此后肠道病变逐渐消失. 这个现象说明, 该模型早期结肠病变是乙醇的化学损伤所致, 而继发的肠道损伤是TNBS协同作用的结果.
从病理变化过程发现, TNBS制模后第1天就表现出明显的肠道损伤, 病理改变在第3-5天后明显加重, 并且在制模后第7天病理改变达到高峰, 以后病理改变开始逐渐减轻, 变成慢性肠道炎症, 这与有关文献报道是一致的[12]. 因此, TNBS制模后7 d内可用于急性炎症性损伤的研究, 10 d后也可用于复制慢性结肠炎症性损伤动物模型[13], 这在一定程度上反应了人类炎性肠病(inflammatory bowel disease, IBD)不同时期的病理改变和免疫损伤的特点[14]. 从研究中我们注意到, 在制模7 d后大鼠有一定的死亡率(4/34), 而在制模后5 d肠道急性损伤的特点已很明显, 没有动物死亡发生, 因此, 选择在制模后5 d进行急性肠道损伤的研究是适合的. 分析大鼠制模后一般表现情况, 与肠道病理变化过程是相符的.
肠道损伤的病理评分包括大体病理评分和组织病理评分, 评分方式较多, 应注意结合动物模型病变程度和特点以及实验周期的制定等多方面因素, 根据实验的具体情况, 有目的地制定有实用意义的评分标准. 我们在Araki及Gulpinar et al报道的评分标准基础上进行了适当修改, 目的是使评分标准能详细体现出TNBS制模后急性期肠道病理改变的特点. 在本实验模型的急性期, 不同程度的黏膜上皮层受损、肠壁全层的炎症和水肿以及出血病灶均能在评分标准中得到体现. 病理评分与肠道损伤的病理变化过程也是一致的.
从已有的文献报道和我们的实验结果可以看出, TNBS作为肠损伤的动物模型实验周期短, 方法简单, 费用低廉, 动物耐受性好, 制模成功率高.
肠道损伤是临床常见的综合征, 有多种表现形式, 既有急性病变, 也有慢性病变; 既可以是肠道本身病变, 也可以是全身病变的局部表现. 复制不同形式的肠道损伤的动物模型, 有利于针对性地开展实验性研究.
复制稳定的动物模型是研究肠损伤的必要条件. 复制肠损伤动物模型方法多, 用 TNBS灌肠方法制作炎症性肠道损伤是实验研究中应用较多和较方便的方法, 广泛用于人类各种肠道病变的发病机制的研究, 但TNBS诱导的肠损伤模型制模后的系列病理变化过程的研究尚较少见报道, 连续的病理变化研究有利于肠道损伤的发生机制和防治措施的研究.
Yamamoto、Onori et al用TNBS复制大鼠结肠损伤的模型进行IBD发病机制的分子和遗传学、非炎症部位肠道肌肉收缩功能障碍, 以及不同时间点的病理变化等研究, 提示肠损伤随着时间的增长, 大鼠肠道病理变化加重, 但有一定的时限性. 本文的研究发现制模后第1天就表现出明显的肠道损伤, 并且在制模后第7天病理改变达到高峰.
通过系列病理变化过程研究发现,制模后7 d内可用于急性炎症性损伤的研究, 10 d后可用于复制慢性结肠炎症性损伤动物模型, 但在制模7 d后大鼠有一定的死亡率, 而在制模后5 d没有动物死亡发生, 其机制尚有待于进一步研究.
本文从连续系列的病理检测这个角度研究TNB S复制大鼠结肠损伤的模型, 对模型在不同时间的可利用性进行评估, 为肠道损伤的模型制作和实际应用提供了理论依据. 本研究手段较先进, 病历资料完整. 立题目的明确, 结论客观真实可靠. 是一篇较好的科研论文.
编辑:程剑侠 电编:李军亮
| 2. | Araki Y, Andoh A, Takizawa J, Takizawa W, Fujiyama Y. Clostridium butyricum, a probiotic derivative, suppresses dextran sulfate sodium-induced experimental colitis in rats. Int J Mol Med. 2004;13:577-580. [PubMed] |
| 3. | Gulpinar MA, Ozbeyli D, Arbak S, Yeğen BC. Acute Stress Ameliorates Colitis via Central Corticotropin- Releasing Factor and Serotonin (5-HT)-3 Receptors. Turk J Med Sci. 2005;35:13-19. |
| 4. | Selve N. Chronic intrajejunal TNBS application in TNBS-sensitized rats: a new model of chronic inflammatory bowel diseases. Agents Actions. 1992;Spec No:C15-C17. [PubMed] |
| 5. | Yamamoto S, Isuzugawa K, Takahashi Y, Murase Y, Iwata M, Arisawa T, Nakano H, Nishimura N, Yamato S, Ohta M. Intestinal gene expression in TNBS treated mice using genechip and subtractive cDNA analysis: implications for Crohn's disease. Biol Pharm Bull. 2005;28:2046-2053. [PubMed] |
| 6. | Onori L, Aggio A, D'Alo' S, Muzi P, Cifone MG, Mellillo G, Ciccocioppo R, Taddei G, Frieri G, Latella G. Role of nitric oxide in the impairment of circular muscle contractility of distended, uninflamed mid-colon in TNBS-induced acute distal colitis in rats. World J Gastroenterol. 2005;11:5677-5684. [PubMed] |
| 7. | Linden DR, Foley KF, McQuoid C, Simpson J, Sharkey KA, Mawe GM. Serotonin transporter function and expression are reduced in mice with TNBS-induced colitis. Neurogastroenterol Motil. 2005;17:565-574. [PubMed] |
| 8. | Isozaki Y, Yoshida N, Kuroda M, Takagi T, Handa O, Kokura S, Ichikawa H, Naito Y, Okanoue T, Yoshikawa T. Effect of a novel water-soluble vitamin E derivative as a cure for TNBS-induced colitis in rats. Int J Mol Med. 2006;17:497-502. [PubMed] |
| 9. | Lindsay J, Van Montfrans C, Brennan F, Van Deventer S, Drillenburg P, Hodgson H, Te Velde A, Sol Rodriguez Pena M. IL-10 gene therapy prevents TNBS-induced colitis. Gene Ther. 2002;9:1715-1721. [PubMed] |
| 10. | Fiorucci S, Mencarelli A, Palazzetti B, Sprague AG, Distrutti E, Morelli A, Novobrantseva TI, Cirino G, Koteliansky VE, de Fougerolles AR. Importance of innate immunity and collagen binding integrin alpha1beta1 in TNBS-induced colitis. Immunity. 2002;17:769-780. [PubMed] |
| 11. | Strober W, Kelsall B, Fuss I, Marth T, Ludviksson B, Ehrhardt R, Neurath M. Reciprocal IFN-gamma and TGF-beta responses regulate the occurrence of mucosal inflammation. Immunol Today. 1997;18:61-64. [PubMed] |
| 12. | Moreels TG, De Man JG, Dick JM, Nieuwendijk RJ, De Winter BY, Lefebvre RA, Herman AG, Pelckmans PA. Effect of TNBS-induced morphological changes on pharmacological contractility of the rat ileum. Eur J Pharmacol. 2001;423:211-222. [PubMed] |
| 13. | Marquez E, Sanchez-Fidalgo S, Calvo JR, la de Lastra CA, Motilva V. Acutely administered melatonin is beneficial while chronic melatonin treatment aggravates the evolution of TNBS-induced colitis. J Pineal Res. 2006;40:48-55. [PubMed] |
| 14. | Neurath M, Fuss I, Strober W. TNBS-colitis. Int Rev Immunol. 2000;19:51-62. [PubMed] |