修回日期: 2007-02-01
接受日期: 2007-02-08
在线出版日期: 2007-04-18
目的: 检测WWOX mRNA及其编码蛋白在肝外胆管癌中的表达, 分析其临床病理学意义.
方法: 用Real Time RT-PCR方法定量分析21例胆管癌组织WWOX mRNA表达情况, 5例肝移植的正常胆管组织作为对照; 采用UIP法染色检测相应病理切片的蛋白表达情况, 并比较mRNA和蛋白在不同分级组织中的表达差异.
结果: WWOX mRNA在肝外胆管癌中的表达显著低于正常胆管组织(8.936×10-7±3.253×10-7vs 1.079×10-6±1.735×10-7, P<0.001), 47%表达缺失; 蛋白表达的缺失频率为57%, 其mRNA及蛋白表达与组织学分级有显著相关(r = -0.583, -0.840, P<0.001), 而年龄、性别、术前肝功能及临床分期无显著相关性. 低分化胆管癌组织中的表达显著低于分化较好的肿瘤组织(P<0.05).
结论: WWOX表达改变参与胆管癌的发病, 可作为预测肝外胆管癌生物侵袭性的有效指标.
引文著录: 顾军, 王梅, 王雅杰, 李咏梅, 袁杨, 薛春燕. 抑癌基因WWOX在肝外胆管癌中的表达. 世界华人消化杂志 2007; 15(11): 1302-1305
Revised: February 1, 2007
Accepted: February 8, 2007
Published online: April 18, 2007
AIM: To determine the expression of WW domain-containing oxidoreductase (WWOX) messenger RNA (mRNA) and protein, and evaluate its clinicopathological significance in human extrahepatic cholangiocacinoma (ECC).
METHODS: Real-time reverse transcription-polymerase chain reaction and immunohistochemistry (UIP method) were used to detect the expression of WWOX mRNA and protein respectively in 21 ECC patients and 5 cases of normal bile duct tissues. The results were comparatively analyzed with the clinicopathological characteristics.
RESULTS: The expression of WWOX mRNA was significantly lower in ECC than that in normal bile duct tissues (8.936 × 10-7 ± 3.253 × 10-7vs 1.079 × 10-6 ± 1.735 × 10-7, P < 0.001), and the loss of mRNA was observed in 47% of the cases (t = 10.145, P < 0.001). Loss of WWOX protein expression was found in 57% of ECC specimens. Both mRNA and protein expression had a significant correlation with the histological grading, and the correlation coefficients were -0.583 and -0.840, respectively. However, WWOX expression had no correlations with other clinicopathological factors such as age, sex, clinical staging or the status of preoperative hepatic function (P > 0.05). Poorly differentiated ECC had markedly lower expression of WWOX than moderately or well differentiated one (P < 0.05).
CONCLUSION: Alterations of WWOX expression may be involved in the tumorigenesis of cholangiocarcinoma, which may serve as an indicator for predicting the invasion of ECC.
- Citation: Gu J, Wang M, Wang YJ, Li YM, Yuan Y, Xue CY. Expression of WW domain-containing oxidoreductase gene in patients with extrahepatic cholangiocarcinoma. Shijie Huaren Xiaohua Zazhi 2007; 15(11): 1302-1305
- URL: https://www.wjgnet.com/1009-3079/full/v15/i11/1302.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i11.1302
肝外胆管癌(extrahepatic cholangiocacinoma, ECC)是高度恶性的肿瘤, 其发病机制尚不明确, 缺乏有效的早期诊断手段和分子生物学标记, 有必要对其分子生物学改变进行研究[1]. WWOX基因是近年鉴定出的新抑癌基因, 在多种肿瘤的发生、发展中起重要作用, 已经成为研究热点[2]. 通过对21例胆管癌组织和5例正常胆管组织的WWOX基因的表达情况研究, 判定WWOX基因在胆管细胞癌发病中所起的作用, 为基因治疗寻找新的靶点打下基础.
收集东方肝胆外科医院及长海医院2004-01/11手术切除的21例胆管癌新鲜标本, 均为腺癌. 其中男14例, 女7例, 平均年龄58.8岁. 组织学分级: 高分化6例, 中分化6例, 低分化9例. 分期:Ⅰ期2例, Ⅱ期8例, Ⅲ期10例, ⅣA期1例. 5例正常胆管组织标本来自肝移植患者. 新鲜肿瘤组织立即放入液氮4 h, 后转至-80 ℃冰箱储存; 其余组织送病理科行病理诊断及组织学分级, 所有患者切片用UIP法行免疫组化染色, 切片评估由2位有经验的病理学家完成.
组织总RNA快速抽提试剂盒购自华舜公司, dNTPs, SYBR® Premix En TaqTM, miniBEST plasmid Purification kit Ver 2.0, pMD18®-T Easy Vector Systems均为TaKaRa公司产品, Power Script Reverse Transcriptase购自Clontech公司, 2400型GeneAmp PCR system为GeneAmp公司产品, LightCycler realtime PCR系统为Roche Diagnostics公司产品, 兔抗鼠WWOX (28-42)多克隆抗体购自Calbiochem公司, Simple Stain MAXPO (MULTI)试剂盒购自Nichirei公司, 引物由上海生工公司合成.
1.2.1 荧光定量RT-PCR: 按照已经发表的WWOX基因mRNA序列(GenBank ID: NM-016373), 分析并选择其保守序列区段, 设计上游引物: 5'-GAGAGGCTGATCCAAGAACG-3'; 下游引物为5'-ACTCTTGCGGATCTGTGTTG-3', 预计扩增产物152 bp, 在国际公用数据库检索无相似序列. 100 mg组织常规抽提后, 取0.5 μg总RNA, 按试剂盒说明组成10 μL反应体系, 42 ℃孵育60 min, 70 ℃反应6 min灭活逆转录酶, 合成cDNA第一链. 将cDNA一链产物1 μL分别加入PCR反应液、dNTP、上下游引物和Taq酶, 94 ℃ 30 s预变性, 随后94 ℃变性10 s, 62 ℃退火15 s, 72 ℃延伸20 s, 共30个循环, 72 ℃延伸5 min. 产物经纯化、回收并电泳鉴定, 操作按试剂盒说明.
纯化PCR产物1 μL加入pMD18-T载体中, 16 ℃过夜连接; 将10 μL连接产物插入100 μL大肠杆菌DH5a感受态细菌中, 常规蓝白斑筛选并PCR扩增确认成功插入WWOX基因. 挑取菌落白癍, Amp+LB液体培养基37 ℃、200 r/min过夜培养, 取其上层菌液4 mL, 进行质粒DNA抽提纯化并经PCR反应扩增、电泳鉴定, 计算出质粒DNA含量为251.4 mg/L, 分别稀释为10-2, 10-3, 10-4, 10-5, 10-6 mg/L, 作为标准品; 用GreenⅠ嵌合荧光法检测, Tag反应液中分别加入WWOX上下游引物、标准品或组织样品1 μL组成20 μL反应体系. 预变性95 ℃, 10 s, 20 ℃/s, 1个循环, 然后95 ℃变性, 5 s, 20 ℃/s, 60 ℃退火20 s, 20 ℃/s, 45循环; 循环结束后自动进行熔解曲线分析. RUN Lingtcycler Version 5.32软件自动分析各项参数, 计算模板的初始含量.
1.2.2 免疫组化染色: 采用UIP法染色, 石蜡切片常规脱蜡至水, 热抗原修复, 抗WWOX多抗工作浓度1:200, 阳性着色定位于肿瘤细胞和(或)基质细胞胞质内, 呈褐色颗粒. 阳性判断按文献标准, 阴性对照以PBS代替一抗.
统计学处理 应用SPSS11.5软件包进行统计分析, 计量资料行方差分析, 计数资料用Fisher精确检验, Spearman法检验相关性. 检验显著性水准: P<0.05.
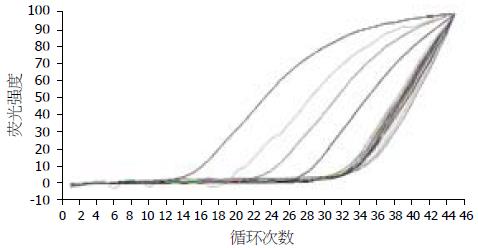
根据标准品Ct值计算直线回归方程: Y = 11.16-4.215X, X为样品的Ct值, Y为样品浓度的对数值, 正常胆管WWOX mRNA浓度为1.079×10-6±1.735×10-7 μg/L, 胆管癌组织为8.936×10-7±3.253×10-7 μg/L, 14/21例(66.67%)低于正常均值. 熔解曲线无明显杂峰, 表明无引物二聚体和非特异扩增(图1).
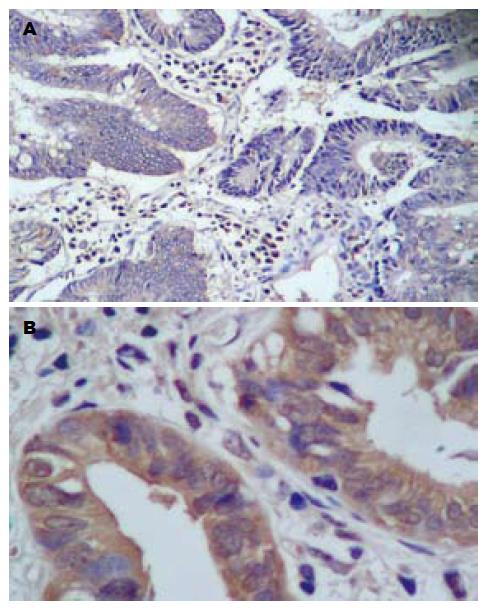
阳性染色为9例, 阴性为12例, 阴性率为57.14%(12/21例), 其中高分化表达阴性1例(1/6, 16.67%), 中分化3例阴性(3/6, 33.33%), 低分化8例阴性(8/9, 88.89%). 腺癌细胞胞质呈棕色颗粒, 部分间质细胞染色(图2).
14/21例(66.67%)胆管癌组织WWOX mRNA浓度低于正常均值, 比正常胆管明显降低(t = 10.145, P<0.001), 差异有统计学意义. 用样本mRNA含量比正常均值降低30%作为判断基因的表达缺失的标准, 10例(47.62%)表达缺失. 高分化组比低分化组的mRNA含量更低, 差异有统计学意义(P = 0.012), 但高分化组和中分化组、中分化组和低分化组比较差异无统计学意义, mRNA含量与年龄、性别、临床分期及术前肝功能状况差异无统计学意义; 蛋白表达亦与组织的分化有关(χ2 = 7.843, P = 0.020), 与其他临床特征差异无统计学意义(表1). Spearman分析发现肿瘤组织的mRNA含量及蛋白表达和胆管癌的分化程度呈负相关(r = -0.583, P = 0.007; r = -0.840, P<0.001).
| n | mRNA含量 | t值 | P值 | 免疫组化 | χ2 | P值 | ||||
| 均数(10-7 μg/L) | 标准误(10-7 μg/L) | 阳性 | 阴性 | |||||||
| 年龄分组 | <50岁 | 7 | 7.326 | 3.165 | 1.675 | 0.11 | 1 | 6 | 3.5 | 0.159 |
| ≥50岁 | 14 | 9.741 | 3.092 | 8 | 6 | |||||
| 性别 | 女 | 7 | 8.038 | 2.029 | 0.889 | 0.385 | 3 | 4 | 0.01 | 0.676 |
| 男 | 14 | 9.385 | 3.705 | 6 | 8 | |||||
| 疾病分期 | I+II 期 | 10 | 8.724 | 3.665 | 0.974 | 0.764 | 4 | 6 | 0.064 | 0.575 |
| III+IV期 | 11 | 9.129 | 2.997 | 5 | 6 | |||||
| 分化程度 | 高分化 | 6 | 11.102 | 2.051 | 2.916 | 0.012a | 5 | 1 | 7.843 | 0.02a |
| 中分化 | 6 | 9.351 | 3.807 | 3 | 3 | |||||
| 低分化 | 9 | 7.215 | 2.789 | 1 | 8 | |||||
| 术前肝功 | 正常 | 9 | 8.179 | 2.394 | 0.919 | 0.369 | 6 | 3 | 3.646 | 0.087 |
| 异常 | 12 | 9.533 | 3.775 | 3 | 9 | |||||
| 蛋白表达 | 阴性 | 12 | 7.334 | 3.221 | 2.065 | 0.053 | ||||
| 阳性 | 9 | 11.072 | 1.789 | |||||||
众多研究发现, 含WW域的氧化还原酶基因(WWOX)在多种肿瘤, 尤其是消化道肿瘤和激素相关肿瘤中的启动和进展阶段起重要作用. 作用机制是以Tyr33磷酸化的方式与P53协同诱导凋亡, 是凋亡途径中的必需分子伴侣[2-5]. 如基因缺失或Tyr33未磷酸化, S期未修复的DNA逃逸细胞周期"检查点", 启动实体细胞突变的进程[6-7], 并促进bcl-2和bcl-xL表达, 抑制凋亡, 促进肿瘤进展[8-9].
WWOX基因在消化道肿瘤中有高频的杂合性缺失(LOH), 且与组织分化程度相关, 但胆管癌中的表达程度尚未见报道. 本研究用Real Time RT-PCR法定量分析WWOX mRNA在胆管癌中的表达, 发现正常胆管组织表达量基本恒定, 胆管癌组织表达明显低, 差异有统计学意义; 低分化组织其mRNA比高分化组织缺失更明显, 差异有统计学意义(P = 0.012), 与其他临床因素差异无统计学意义, 说明WWOX基因的缺失与分化程度相关, 与文献的结论相似[10-11]. 文献以半定量PCR的电泳图片灰度扫描比对照低30%为表达的缺失, 尤其是在判定LOH时[5-6,10-11]. 用样本mRNA含量比正常均值降低30%作为判断基因的表达减低或缺失的标准, 发现其与免疫组化观察的蛋白表达情况基本一致, 14/21例表达低于正常均值, 其中10例表达含量减低大于30%. 免疫组化发现蛋白缺失12例, 其中高分化组织1例, 低分化腺癌8例, 差异有统计学意义, 与其他临床因素差异无统计学意义. 14例胆管癌标本WWOX mRNA含量低于正常均值, 10例超过30%; 而12例免疫组化阴性表达, 定量减低30%以内的3个标本对应的染色阴性, 一例超过30%的肿瘤标本免疫组化染色阳性, 表明蛋白表达和mRNA水平还存在一些差异, 原因之一可能是肿瘤标本中包含痕量的正常组织RNA, 定量检测高度敏感, 而免疫组化染色敏感性相对低; 另外, 部分异常拼接的mRNA也可能不翻译成蛋白[11].
本组研究结果证实WWOX基因在胆管癌中高频缺失, 且缺失发生与组织分级显著相关, 证明该基因的改变在胆管癌的分子发病中起一定的作用, 可预测肿瘤的侵袭性. 目前研究已表明, 该基因可以作为预后预测因子[12], 作为肿瘤基因治疗或生物治疗目标基因.
WWOX是位于染色体脆性位点, 与多种蛋白相互作用, 调节凋亡, 在多种肿瘤中表达减低或缺失, 表达恢复后可以抑制肿瘤生长, 促进细胞凋亡, 与多种肿瘤特别是激素相关肿瘤及消化道肿瘤的预后相关. 胆管癌预后恶劣, 早期发现困难, 治疗效果差, 对其分子发病机制的研究可以加深对胆管癌的了解.
本研究用WWOX表达质粒作为标准品, 比用"管家基因"作为内对照标准品有一定优势, 其定量准确, 结论可靠, 对定量低丰度基因敏感性高. 同时, 定量RT-PCR与相应标本的免疫组化对照, 可以明确mRNA与蛋白表达之间的差异, 对进一步研究基因的转录变体与蛋白功能的关系提供线索. 有关胆管癌的分子发病机制和分子预后指标的研究较少, 本研究证实WWOX基因在胆管癌中高频缺失, 且缺失发生与组织分级显著相关, 证明该基因的改变在胆管癌的分子发病中起一定的作用, 可预测肿瘤的侵袭性.
WWOX蛋白与p53基因及众多核转录因子的相互作用日益受到重视, 成为一个新的热点, 针对恢复WWOX基因功能的研究已经在体内及体外显示抑制肿瘤生长的作用, 包括Ad-WWOX、逆转启动子高甲基化和siRNA等方法均显示令人鼓舞的结果, 临床研究也发现与性激素相关肿瘤的预后显著相关, 有望成为一个预后判断的独立标记, 作为治疗的靶基因有着巨大的潜力.
本文采用Real-TimeRT-PCR及免疫组化分别探讨了WWOXRNA和蛋白在肝外胆管癌组织中的表达, 内容比较新颖, 设计合理, 有较好的理论意义.
编辑:张焕兰 电编:张敏
| 1. | Yoon JH, Gores GJ. Diagnosis, Staging, and Treatment of Cholangiocarcinoma. Curr Treat Options Gastroenterol. 2003;6:105-112. [PubMed] [DOI] |
| 2. | Bednarek AK, Laflin KJ, Daniel RL, Liao Q, Hawkins KA, Aldaz CM. WWOX, a novel WW domain-containing protein mapping to human chromosome 16q23.3-24.1, a region frequently affected in breast cancer. Cancer Res. 2000;60:2140-2145. [PubMed] |
| 3. | Ried K, Finnis M, Hobson L, Mangelsdorf M, Dayan S, Nancarrow JK, Woollatt E, Kremmidiotis G, Gardner A, Venter D. Common chromosomal fragile site FRA16D sequence: identification of the FOR gene spanning FRA16D and homozygous deletions and translocation breakpoints in cancer cells. Hum Mol Genet. 2000;9:1651-1663. [PubMed] [DOI] |
| 4. | Filling C, Berndt KD, Benach J, Knapp S, Prozorovski T, Nordling E, Ladenstein R, Jörnvall H, Oppermann U. Critical residues for structure and catalysis in short-chain dehydrogenases/reductases. J Biol Chem. 2002;277:25677-25684. [PubMed] [DOI] |
| 5. | Chen ST, Chuang JI, Cheng CL, Hsu LJ, Chang NS. Light-induced retinal damage involves tyrosine 33 phosphorylation, mitochondrial and nuclear translocation of WW domain-containing oxidoreductase in vivo. Neuroscience. 2005;130:397-407. [PubMed] [DOI] |
| 6. | Palakodeti A, Han Y, Jiang Y, Le Beau MM. The role of late/slow replication of the FRA16D in common fragile site induction. Genes Chromosomes Cancer. 2004;39:71-76. [PubMed] [DOI] |
| 7. | Chang NS. A potential role of p53 and WOX1 in mitochondrial apoptosis (review). Int J Mol Med. 2002;9:19-24. [PubMed] [DOI] |
| 8. | Chang NS, Doherty J, Ensign A, Lewis J, Heath J, Schultz L, Chen ST, Oppermann U. Molecular mechanisms underlying WOX1 activation during apoptotic and stress responses. Biochem Pharmacol. 2003;66:1347-1354. [PubMed] [DOI] |
| 9. | Chang NS, Doherty J, Ensign A. JNK1 physically interacts with WW domain-containing oxidoreductase (WOX1) and inhibits WOX1-mediated apoptosis. J Biol Chem. 2003;278:9195-9202. [PubMed] [DOI] |
| 10. | Yendamuri S, Kuroki T, Trapasso F, Henry AC, Dumon KR, Huebner K, Williams NN, Kaiser LR, Croce CM. WW domain containing oxidoreductase gene expression is altered in non-small cell lung cancer. Cancer Res. 2003;63:878-881. [PubMed] |
| 11. | Aqeilan RI, Kuroki T, Pekarsky Y, Albagha O, Trapasso F, Baffa R, Huebner K, Edmonds P, Croce CM. Loss of WWOX expression in gastric carcinoma. Clin Cancer Res. 2004;10:3053-3058. [PubMed] [DOI] |
| 12. | Nunez MI, Rosen DG, Ludes-Meyers JH, Abba MC, Kil H, Page R, Klein-Szanto AJ, Godwin AK, Liu J, Mills GB. WWOX protein expression varies among ovarian carcinoma histotypes and correlates with less favorable outcome. BMC Cancer. 2005;5:64. [PubMed] [DOI] |