修回日期: 2007-01-05
接受日期: 2007-01-27
在线出版日期: 2007-04-18
目的: 体外研究Oligofectamine介导的VEGF反义寡核苷酸(antisense oligodeoxynucleotide, ASODN)转染对人胆囊癌GBC-SD细胞VEGF, Flt-1及KDR mRNA表达和VEGF蛋白分泌的影响.
方法: 运用Oligofectamine介导的VEGF反义寡核苷酸(ASODN)和错义寡核苷酸(Scrambled Oligodeoxynucleotide, SODN)转染人胆囊癌细胞GBC-SD, 半定量RT-PCR检测转染后各组细胞不同时间的VEGF, Flt-1及KDR mRNA表达变化, ELISA测定转染后各组细胞培养上清液VEGF蛋白浓度.
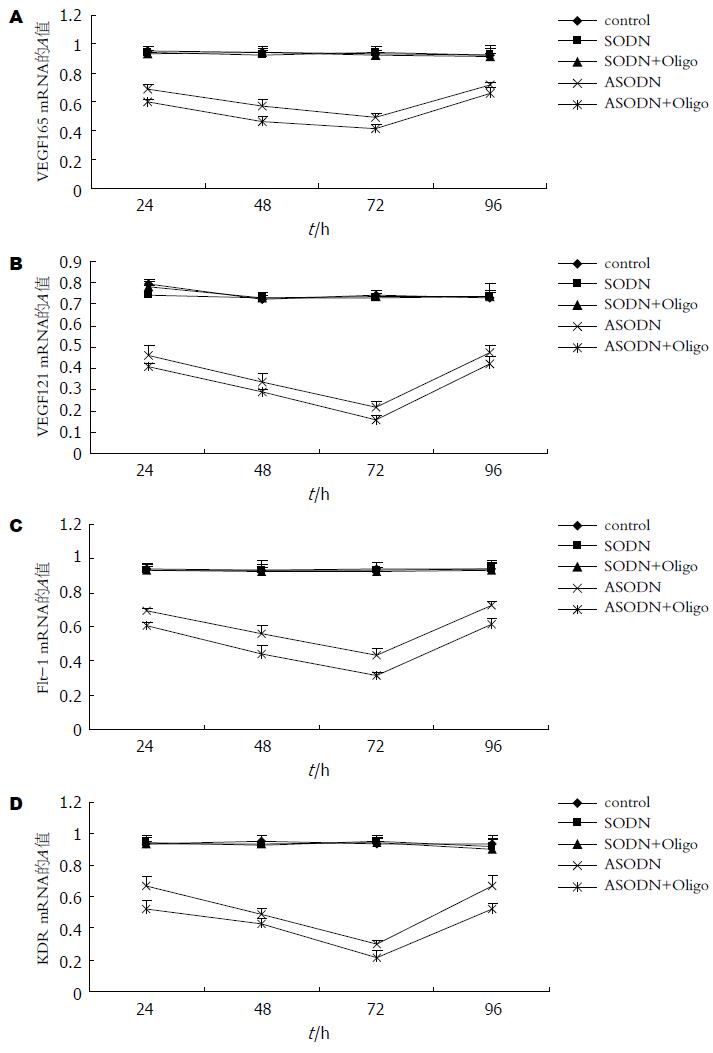
结果: 半定量RT-PCR发现ASODN组及ASODN+Oligofectamine组24, 48, 72, 96 h VEGF (ASODN组VEGF165: 0.686±0.033, 0.569±0.049, 0.489±0.036, 0.716±0.017; ASODN组VEGF121: 0.462±0.046, 0.338±0.034, 0.219±0.022, 0.471±0.038; ASODN+Oligofectamine组VEGF165: 0.601±0.021, 0.465±0.042, 0.416±0.023, 0.662±0.035; ASODN+Oligofectamine组VEGF121: 0.408±0.014, 0.286±0.019, 0.157±0.021, 0.418±0.037)、Flt-1 (ASODN组: 0.694±0.019, 0.562±0.045, 0.435±0.042, 0.724±0.026; ASODN+Oligofectamine组: 0.609±0.018, 0.442±0.049, 0.314±0.015, 0.614±0.029)及KDR (ASODN组: 0.667±0.063, 0.490±0.033, 0.301±0.029, 0.665±0.068; ASODN+Oligofectamine组: 0.523±0.048, 0.432±0.027, 0.218±0.036, 0.524±0.037) mRNA的表达显著低于Control组(P<0.05), 且ASODN+Oligofectamine的抑制作用比ASODN强(P>0.05). ELISA测定结果显示ASODN组(281.26±18.62, 526.44±34.95, 791.13±20.99)及ASODN+Oligofectamine组(250.7±14.57, 506.09±19.14, 711.79±19.91) 24, 48, 72 h VEGF蛋白的分泌浓度均显著低于Control组(394.23±16.26, 711.6±26.21, 933.85±28.65)(P<0.05), 且ASODN+Oligofectamine的抑制作用比ASODN强(P>0.05).
结论: Oligofectamine介导的VEGF ASODN能抑制GBC-SD细胞VEGF, Flt-1及KDR mRNA表达和VEGF蛋白分泌.
引文著录: 李海军, 庞作良, 毛拉艾沙·买买提. VEGF反义寡核苷酸对胆囊癌细胞VEGF, Flt-1及KDR mRNA表达和VEGF蛋白分泌的影响. 世界华人消化杂志 2007; 15(11): 1225-1231
Revised: January 5, 2007
Accepted: January 27, 2007
Published online: April 18, 2007
AIM: To investigate the effect of oligofectamine-mediated vascular endothelial growth factor (VEGF) antisense oligodeoxynucleotide (ASODN) transfection on the mRNA expression of VEGF, fms-like tyrosine kinase-1 (Flt-1) and kinase insert domain-containing receptor (KDR) as well as VEGF protein excretion of gallbladder carcinoma GBC-SD cells in vitro.
METHODS: Gallbladder carcinoma GBC-SD cells were transfected with VEGF ASODN and scrambled oligodeoxynucleotide (SODN) by Oligofectamine mediation. The mRNA expression of VEGF, Flt-1 and KDR in GBC-SD cells of each group were detected by semi-quantitive reverse transcription-polymerase chain reaction (RT-PCR) and the excretion of VEGF protein was measured by enzyme-linked immunosorbent assay (ELISA).
RESULTS: Semi-quantitive RT-PCR revealed that VEGF, Flt-1 and KDR mRNA expression in groups of ASODN (VEGF165: 0.686 ± 0.033, 0.569 ± 0.049, 0.489 ± 0.036, 0.716 ± 0.017; VEGF165: 0.462 ± 0.046, 0.338 ± 0.034, 0.219 ± 0.022, 0.471 ± 0.038; Flt-1: 0.694 ± 0.019, 0.562 ± 0.045, 0.435 ± 0.042, 0.724 ± 0.026; KDR: 0.667 ± 0.063, 0.490 ± 0.033, 0.301 ± 0.029, 0.665 ± 0.068) and ASODN + Oligofectamine (VEGF165: 0.601 ± 0.021, 0.465 ± 0.042, 0.416 ± 0.023, 0.662 ± 0.035; VEGF121: 0.408 ± 0.014, 0.286 ± 0.019, 0.157 ± 0.021, 0.418 ± 0.037; Flt-1: 0.609 ± 0.018, 0.442 ± 0.049, 0.314 ± 0.015, 0.614 ± 0.029; KDR: 0.523 ± 0.048, 0.432 ± 0.027, 0.218 ± 0.036, 0.524 ± 0.037) were significantly inhibited 24, 48, 72 and 96 h after transfection in comparison with those in the control group (P < 0.05), and the inhibitory effect of ASODN + Oligofectamine was stronger (P > 0.05). ELISA results discovered that VEGF protein excretion was markedly decreased in the culture media of ASODN (281.26 ± 18.62, 526.44 ± 34.95, 791.13 ± 20.99) and ASODN + Oligofectamine (250.7 ± 14.57, 506.09 ± 19.14, 711.79 ± 19.91) group (P < 0.05) as compared with that in the control group, and ASODN + Oligofectamine was more efficient (P > 0.05).
CONCLUSION: VEGF ASODN can inhibit VEGF, Flt-1 and KDR mRNA expression and VEGF protein excretion of GBC-SD cells, and the effect may be strengthened by Oligofectamine mediation.
- Citation: Li HJ, Pang ZL, Mai-Mai-Ti MLAS. Effects of vascular endothelial growth factor antisense oligodeoxynucleotide on the mRNA expression of vascular endothelial growth factor, fms-like tyrosine kinase-1 and kinase insert domain-containing receptor and vascular endothelial growth factor protein excretion of gallbladder carcinoma GBC-SD cells in vitro. Shijie Huaren Xiaohua Zazhi 2007; 15(11): 1225-1231
- URL: https://www.wjgnet.com/1009-3079/full/v15/i11/1225.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i11.1225
VEGF是高度特异性的血管内皮细胞有丝分裂因子, 在肿瘤的生长和转移中起重要作用. 抑制VEGF及其受体信号转导通路的任何一个环节, 就可防止肿瘤的进展与转移. ASODN有专一序列的寡聚脱氧核苷酸, 能特异阻断靶基因的复制、转录和翻译, 可在基因水平抑制VEGF的分泌, 已成功地运用于神经胶质瘤[1-2]、乳腺癌[3]、胰腺癌[4]和胃癌[5]等多种肿瘤[6-9]. 本实验体外运用Oligofectamine介导的VEGF ASODN转染人胆囊癌细胞GBC-SD, 通过RT-PCR和ELISA测定VEGF ASODN对GBC-SD细胞VEGF及其受体Flt-1和KDR在mRNA水平的表达, 并检测GBC-SD细胞VEGF蛋白分泌, 从分子水平考察VEGF ASODN抑制胆囊癌细胞GBC-SD生长、促进凋亡的基础.
人胆囊癌细胞株GBC-SD(中科院上海细胞生物学研究所), RPMI1640培养基, 2.5 g/L胰蛋白酶(含EDTA)(Gibco公司), OligofectamineTM Reagent(20 μmol/L) (Invitrogen公司), VEGF反义寡核苷酸、VEGF错义寡核苷酸, VEGF, Flt-1, KDR与β-actin引物(上海生工生物工程公司).
人胆囊癌GBC-SD细胞用含100 mL/L小牛血清的RPMI1640培养液(含青霉素和链霉素各100 mg/L), 37 ℃, 50 mL/L CO2培养箱培养. 待细胞长满瓶底70%-80%时采用2.5 g/L胰酶(含0.2 g/L EDTA)消化传代, 3-4 d传代1次, 传代后24-48 h处于指数生长期的细胞备实验用. 细胞经4 g/L台盼蓝染色, 拒染率>95%.
1.2.1 寡核苷酸合成: VEGF反义寡核苷酸及错义寡核苷酸序列参照文献[10], VEGF反义寡核苷酸(ASODN)序列为: 5'-TGGCTTGAAGATGTACTCGAT-3', VEGF错义寡核苷酸(SODN)序列为: 5'-TACGTAGTATGGTGTACGATC-3', 全硫代修饰, 保存于-70 ℃待用. OligofectamineTM介导的寡核苷酸转染参照OligofectamineTM Reagent说明书和参照文献[11-14]进行.
1.2.2 四甲基偶氮唑蓝(MTT)法检测: SODN和OligofectamineTM对GBC-SD细胞的毒性试验 实验设对照组, 2.5、5、10和20 μmol/L SODN组及0.5、1、2和4 μL Oligofectamine组. GBC-SD细胞37 ℃, 50 mL/L CO2度培养箱培养24 h后, 无血清RPMI1640换液, 并分别加入SODN(终浓度为2.5、5、10和20 μmol/L)和0.5、1、2和4 μL Oligofectamine. 12、24、48和72 h后, 用MTT法检测细胞活力, 并绘制各组细胞的生长曲线.
1.2.3 OligofectamineTM介导的寡核苷酸转染: 指数生长期GBC-SD细胞, 以5×106/L细胞密度接种96孔板中. 混合5 μL Oligofectamine和10 μL 20 μmol/L SODN或10 μL 20 μmol/L ASODN, 制备成无血清转染液, 并加入细胞中, 培养4 h后, 吸弃转染液, 加入含小牛血清培养液继续培养, 此时设为0 h点.
1.2.4 RT-PCR法检测GBC-SD细胞VEGF, Flt-1及KDR mRNA表达的变化: 实验设对照组、SODN组、Oligofectamine+SODN组、ASODN组和Oligofectamine+ASODN组. OligofectamineTM介导的寡核苷酸转染如前所述. 分别于转染后24, 48, 72和96 h提取总RNA, 逆转录后, PCR扩增各目的基因. 将扩增的RT-PCR产物经20 g/L琼脂糖凝胶电泳检测, 用IS1000凝胶数字成像系统拍照, 采用Magnitec Ltd.公司Band Leader Applacation 3.0图像分析软件分析电泳条带灰度, 分析GBC-SD细胞VEGF, Flt-1及KDR mRNA变化. 引物相关参数见表1.
| 名称 | 方向 | 引物序列 | 目的片段的长度 |
| VEGF | forward: | 5'-CGAAGTGGTGAAGTTCATGGATG-3' | 403 bp (VEGF165) |
| reverse: | 5'-TTCTGTATCAGTCTTTCCTGGTGAG-3' | 535 bp (VEGF121) | |
| Flt-1 | forward: | 5'-CAAGTGGCCAGA GGCATGGAGTT-3' | 498 bp |
| reverse: | 5'-GATGTAGTCTTTACCATCCTGTTG-3' | ||
| KDR | forward: | 5'-TATAGATGGTGTAACCCGGA-3' | 555 bp |
| reverse: | 5'-TTTGTCACTGAGACAGCTTGG-3' | ||
| β-actin | forward: | 5'-CTTCTACAATGAGCTGCGTG-3' | 305 bp |
| reverse: | 5'-TCATGAGGTAGTCAGTCAGG-3' |
1.2.5 ELISA检测VEGF蛋白分泌的变化: 分别收集各组24, 48和72 h的培养液上清, 采用双抗夹心ELISA法检测其中的VEGF蛋白分泌, 具体方法按ELISA试剂盒说明书进行.
统计学处理 实验数据中计量资料以mean±SD表示, 多组资料的统计学检验采用方差分析, 各组均数间的相互比较采用Student-Newman-keuls法, 所有统计学检验均采用统计学软件SPSS11.0进行, P<0.05为有显著性差异.
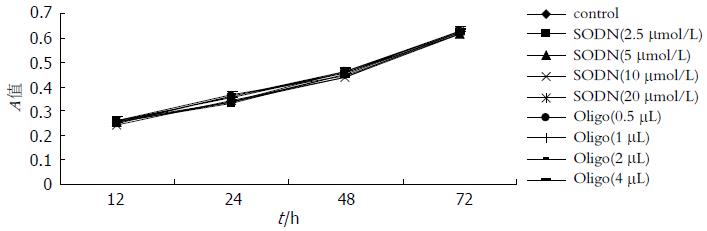
在12、24、48和72 h 4个作用时相点, 对照组、2.5、5、10和20 μmol/L SODN组及0.5、1、2和4 μL Oligofectamine组GBC-SD细胞生长无明显差异(P>0.05), 可见在试验浓度范围内, SODN和Oligofectamine对GBC-SD细胞均未见明显毒性. 各组细胞的生长曲线如图1所示.
RT-PCR扩增产物均经电泳, DNA分子标志标定, 确认为目的条带. 24, 48, 72和96 h GBC-SD细胞VEGF, Flt-1及KDR mRNA的表达水平在SODN组、SODN+Oligofectamine组和control组无明显差别(P>0.05), 而ASODN组及ASODN+Oligofectamine组则明显低于control组(P<0.05). ASODN组及ASODN+Oligofectamine组VEGF, Flt-1及KDR mRNA在同组不同时间作用点的表达水平也存在差异, 48和72 h组的抑制程度显著强于24 h组(P<0.05), 而96 h组与24 h组之间无显著差异(P>0.05), 可见VEGF ASODN及ASODN+Oligofectamine抑制VEGF, Flt-1及KDR mRNA表达的作用在24-72 h左右逐渐增强, 在72 h抑制作用最强, 在72后抑制作用开始逐渐减弱, 且ASODN+Oligofectamine的抑制作用比ASODN组更明显, 虽然两组在统计学上的差异并不显著(P>0.05)(图2-4).
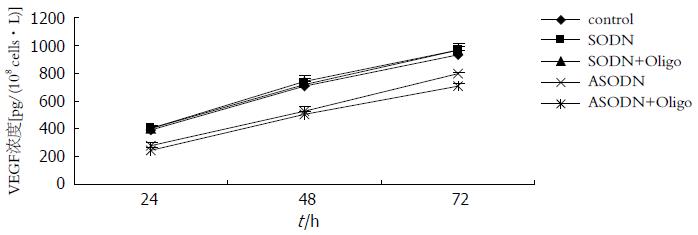
ELISA检测结果显示, 24, 48和72 h GBC-SD细胞培养上清液中VEGF蛋白浓度在SODN组、SODN+Oligofectamine组和control组无明显差别(P>0.05), 而ASODN组及ASODN+Oligofectamine组则明显低于control组(P<0.05), 且ASODN+Oligofectamine组的VEGF蛋白浓度比ASODN组低, 虽然两组在统计学上的差异并不显著(P>0.05)(图5).
VEGFR有3种属于酪氨酸蛋白激酶受体(receptor tyrosine kinases, RTKs)超家族, 命名为VEGFR-1 (F1t-1), VEGFR-2(KDR/F1k-1), VEGFR-3 (F1t-4). F1t-4分布在淋巴管内皮细胞, F1t-1和KDR/F1k-1则主要在血管内皮细胞内表达[14]. KDR/F1k-1激活后能使毛细血管通透性增高, 促进内皮细胞增生及迁移; 而F1t-1激活后可促进内皮细胞分化形成血管, 同时对F1t-1所引起的生物学效应起缓冲作用[15-16]. 正常情况下, 这些受体表达水平很低, 大多数组织中不能检测出, 但在病理情况下, 如各种肿瘤等, 常可在其附近血管内皮细胞中检测到受体高度表达. 以往的研究证明在许多人体肿瘤组织中存在VEGF及其受体的异常过度表达[17]. VEGF mRNA在肿瘤细胞内表达, 内皮细胞不表达VEGF, 但肿瘤内皮细胞过度表达Flt-l mRNA和KDR mRNA, 说明VEGF主要是旁分泌. 但通过对AIDS-Kaposi肉瘤的研究发现[18], VEGF受体的表达除血管内皮外还出现于肿瘤细胞, 用VEGF ASODN可特异地阻抑VEGF蛋白产生, 并可以剂量依赖的方式抑制肉瘤细胞生长. 这提示VEGF可能以自分泌、旁分泌两种方式刺激肿瘤细胞的生长. 不管是何种分泌方式, 在诱导肿瘤生长、转移过程中, VEGF表达的增高是始动因素. VEGF通过与其特异性受体(VEGFR)结合, 引起一系列的信号转导, 释放多种细胞因子与生长因子, 刺激血管内皮细胞增殖和迁移, 促进新生血管生成, 在肿瘤的生长和转移中起重要作用. 抑制VEGFR信号转导通路的任何一个环节, 就可防止肿瘤的进展与转移. 肿瘤的生长和转移依赖于新生血管的形成, 而新生血管的形成受与酪氨酸激酶受体(RTKs)结合的特异性生长因子的调控. VEGFR-1(Flt-1)和VEGFR-2(KDR)都是细胞表面的RTKs, 是信号转导通路的主要环节, 影响细胞的增生、分化、黏附、迁移和代谢. 许多研究提示Flt-1和KDR所引起的信号转导级联反应有所不同, KDR有明显促有丝分裂和化学趋化活性, 在血管通透性升高和血管生成过程中起主要作用, 而Flt-1在血管生成中的调节作用可能与调节内皮细胞间作用、内皮细胞与基底膜作用以及内皮细胞的迁移相关[10,19-21].
ASODN是能与特定的DNA或RNA以碱基互补配对的方式结合, 并阻止其转录和翻译的短核酸片段, 是目前迅速发展的新型的基因治疗药物[22-23]. 阳离子脂质体(cationic liposomes)能与带负电荷的核酸物质形成复合物, 可提高细胞对ASODN的摄人, 增加生物利用度, 同时可在一定程度上降低核酸酶对其的降解, 在基因治疗中具有独特的应用价值[24-31]. Oligofectamine是一种新型的专门用于寡核苷酸转染的阳离子脂质体, 其效率高于市售的Lipofectamine.
半定量RT-PCR结果显示, VEGF ASODN及ASODN+Oligofectamine抑制人胆囊癌细胞GBC-SD的VEGF, Flt-1及KDR mRNA表达的作用在24-72 h左右逐渐增强, 在72 h是抑制作用最强, 在72 h后抑制作用开始逐渐减弱, 且VEGF ASODN+Oligofectamine的抑制作用比ASODN更明显, 虽然两组在统计学上的差异并不显著(P>0.05), 而SODN组和SODN+Oligofectamine组则无抑制作用, 表明VEGF ASODN在mRNA水平能显著抑制人胆囊癌细胞GBC-SD的VEGF及其受体Flt-1及KDR的表达. ELISA结果表明, VEGF ASODN及ASODN+Oligofectamine在蛋白水平抑制人胆囊癌细胞GBC-SD的VEGF的表达, 且VEGF ASODN+Oligofectamine的抑制作用比ASODN更明显, 虽然两组在统计学上的差异并不显著(P>0.05). 可见VEGF ASODN能够特异性封闭VEGF基因并抑制VEGF及其受体Flt-1和KDR表达, 阻断其在促进肿瘤新生血管生成通路的信号转导, 从而能够抑制胆囊癌细胞GBC-SD生长增殖, 促进细胞凋亡, Oligofectamine作为一种专门用于寡核苷酸转染的阳离于脂质体, 能显著提高VEGF ASODN抑制人胆囊癌细胞GBC-SD的增殖效应, 并且这种作用是序列特异性的, 而不是脂质体本身的作用或非序列特异性效应. 因此Oligofectamine可作为一种低毒载体应用于介导ASODN对胆囊癌的治疗.
从本实验的设计提示VEGF ASODN抑制胆囊癌细胞GBC-SD VEGF的表达, 以及其受体Flt-1和KDR表达, 即抑制自分泌的方式达到抑制胆囊癌细胞GBC-SD生长增殖, 促进细胞凋亡的效果. 也表明胆囊癌细胞GBC-SD存在VEGF自分泌的方式, 是否还具有旁分泌的方式, 即肿瘤内皮细胞过渡表达Flt-1和KDR mRNA, 需要进一步检测实体肿瘤内皮细胞mRNA及蛋白水平Flt-1和KDR表达情况. 总之, VEGF ASODN通过抑制VEGF的表达来抑制人胆囊癌细胞GBC-SD的增殖效应. 本实验的结果为将来采用VEGF ASODN对胆囊癌进行基因治疗积累一定的理论基础和实验依据.
胆囊癌恶性程度高, 预后差, 目前外科手术疗效不尽人意, 近年来抗血管形成疗法作为一种崭新的抗癌策略已成为研究的焦点, ASODN是目前迅速发展的新型的基因治疗药物, 本文利用Oligofectamine介导的VEGFASODN转染人胆囊癌细胞, 探讨其对VEGF, Flt-1和KDR在mRNA和蛋白水平表达的影响, 为将来采用VEGFASODN对胆囊癌进行基因治疗积累理论基础和实验依据.
本文研究了VEGF反义寡核苷酸对胆囊癌细胞VEGF, Flt-1及KDR mRNA表达和VEGF蛋白分泌的影响, 文章具有一定的科学性、创新性和可读性, 能较好的反映我国肝胆病学临床和基础研究的先进水平.
编辑:张焕兰 电编:张敏
| 3. | Im SA, Kim JS, Gomez-Manzano C, Fueyo J, Liu TJ, Cho MS, Seong CM, Lee SN, Hong YK, Yung WK. Inhibition of breast cancer growth in vivo by antiangiogenesis gene therapy with adenovirus-mediated antisense-VEGF. Br J Cancer. 2001;84:1252-1257. [PubMed] [DOI] |
| 10. | Masood R, Cai J, Zheng T, Smith DL, Hinton DR, Gill PS. Vascular endothelial growth factor (VEGF) is an autocrine growth factor for VEGF receptor-positive human tumors. Blood. 2001;98:1904-1913. [PubMed] [DOI] |
| 11. | Zeng H, Dvorak HF, Mukhopadhyay D. Vascular permeability factor (VPF)/vascular endothelial growth factor (VEGF) peceptor-1 down-modulates VPF/VEGF receptor-2-mediated endothelial cell proliferation, but not migration, through phosphatidylinositol 3-kinase-dependent pathways. J Biol Chem. 2001;276:26969-26979. [PubMed] [DOI] |
| 12. | Zeng H, Zhao D, Mukhopadhyay D. KDR stimulates endothelial cell migration through heterotrimeric G protein Gq/11-mediated activation of a small GTPase RhoA. J Biol Chem. 2002;277:46791-46798. [PubMed] [DOI] |
| 13. | Zeng H, Zhao D, Mukhopadhyay D. Flt-1-mediated down-regulation of endothelial cell proliferation through pertussis toxin-sensitive G proteins, beta gamma subunits, small GTPase CDC42, and partly by Rac-1. J Biol Chem. 2002;277:4003-4009. [PubMed] [DOI] |
| 14. | Gille H, Kowalski J, Li B, LeCouter J, Moffat B, Zioncheck TF, Pelletier N, FerRARα N. Analysis of biological effects and signaling properties of Flt-1 (VEGFR-1) and KDR (VEGFR-2). A reassessment using novel receptor-specific vascular endothelial growth factor mutants. J Biol Chem. 2001;276:3222-3230. [PubMed] [DOI] |
| 15. | Bussolati B, Dunk C, Grohman M, Kontos CD, Mason J, Ahmed A. Vascular endothelial growth factor receptor-1 modulates vascular endothelial growth factor-mediated angiogenesis via nitric oxide. Am J Pathol. 2001;159:993-1008. [PubMed] [DOI] |
| 16. | Lu D, Jimenez X, Zhang H, Wu Y, Bohlen P, Witte L, Zhu Z. Complete inhibition of vascular endothelial growth factor (VEGF) activities with a bifunctional diabody directed against both VEGF kinase receptors, fms-like tyrosine kinase receptor and kinase insert domain-containing receptor. Cancer Res. 2001;61:7002-7008. [PubMed] |
| 17. | Sugawara Y, Makuuchi M, Harihara Y, Noie T, Inoue K, Kubota K, Takayama T. Tumor angiogenesis in gallbladder carcinoma. Hepatogastroenterology. 1999;46:1682-1686. [PubMed] |
| 18. | Masood R, Cai J, Zheng T, Smith DL, Naidu Y, Gill PS. Vascular endothelial growth factor/vascular permeability factor is an autocrine growth factor for AIDS-Kaposi sarcoma. Proc Natl Acad Sci U S A. 1997;94:979-984. [PubMed] [DOI] |
| 19. | Langer I, Vertongen P, Perret J, Fontaine J, Atassi G, Robberecht P. Expression of vascular endothelial growth factor (VEGF) and VEGF receptors in human neuroblastomas. Med Pediatr Oncol. 2000;34:386-393. [PubMed] [DOI] |
| 20. | Brekken RA, Overholser JP, Stastny VA, Waltenberger J, Minna JD, Thorpe PE. Selective inhibition of vascular endothelial growth factor (VEGF) receptor 2 (KDR/Flk-1) activity by a monoclonal anti-VEGF antibody blocks tumor growth in mice. Cancer Res. 2000;60:5117-5124. [PubMed] |
| 21. | Kanno S, Oda N, Abe M, Terai Y, Ito M, Shitara K, Tabayashi K, Shibuya M, Sato Y. Roles of two VEGF receptors, Flt-1 and KDR, in the signal transduction of VEGF effects in human vascular endothelial cells. Oncogene. 2000;19:2138-2146. [PubMed] [DOI] |
| 22. | Varga LV, Tóth S, Novák I, Falus A. Antisense strategies: functions and applications in immunology. Immunol Lett. 1999;69:217-224. [PubMed] [DOI] |
| 23. | Weiss B, Davidkova G, Zhou LW. Antisense RNA gene therapy for studying and modulating biological processes. Cell Mol Life Sci. 1999;55:334-358. [PubMed] [DOI] |
| 24. | Akhtar S, Hughes MD, Khan A, Bibby M, Hussain M, Nawaz Q, Double J, Sayyed P. The delivery of antisense therapeutics. Adv Drug Deliv Rev. 2000;44:3-21. [PubMed] [DOI] |
| 25. | Thomas SM, Zeng Q, Dyer KF, Suscovich TJ, Kanter PM, Whalen JD, Watkins SF, Grandis JR. Tissue distribution of liposome-mediated epidermal growth factor receptor antisense gene therapy. Cancer Gene Ther. 2003;10:518-528. [PubMed] [DOI] |
| 26. | Zhang Y, Jeong Lee H, Boado RJ, Pardridge WM. Receptor-mediated delivery of an antisense gene to human brain cancer cells. J Gene Med. 2002;4:183-194. [PubMed] [DOI] |
| 27. | Ghosh C, Iversen PL. Intracellular delivery strategies for antisense phosphorodiamidate morpholino oligomers. Antisense Nucleic Acid Drug Dev. 2000;10:263-274. [PubMed] [DOI] |
| 28. | Arora V, Cate ML, Ghosh C, Iversen PL. Phosphorodiamidate morpholino antisense oligomers inhibit expression of human cytochrome P450 3A4 and alter selected drug metabolism. Drug Metab Dispos. 2002;30:757-762. [PubMed] [DOI] |
| 29. | Geller BL, Deere JD, Stein DA, Kroeker AD, Moulton HM, Iversen PL. Inhibition of gene expression in Escherichia coli by antisense phosphorodiamidate morpholino oligomers. Antimicrob Agents Chemother. 2003;47:3233-3239. [PubMed] [DOI] |
| 30. | Moulton HM, Hase MC, Smith KM, Iversen PL. HIV Tat peptide enhances cellular delivery of antisense morpholino oligomers. Antisense Nucleic Acid Drug Dev. 2003;13:31-43. [PubMed] [DOI] |
| 31. | Tilley LD, Hine OS, Kellogg JA, Hassinger JN, Weller DD, Iversen PL, Geller BL. Gene-specific effects of antisense phosphorodiamidate morpholino oligomer-peptide conjugates on Escherichia coli and Salmonella enterica serovar typhimurium in pure culture and in tissue culture. Antimicrob Agents Chemother. 2006;50:2789-2796. [PubMed] [DOI] |