修回日期: 2007-01-05
接受日期: 2007-01-20
在线出版日期: 2007-04-18
目的: 研究不同剂量的壳寡糖和N-乙酰氨基单糖对STZ诱导的糖尿病大鼠的糖耐量作用及肠道微生态平衡的影响.
方法: 按65 mg/kg体质量一次性ip STZ制备糖尿病大鼠模型. 大鼠随机分为9组: 正常对照组, 二甲双胍阳性对照组, 阴性对照组, 壳寡糖高、中、低剂量组, N-乙酰氨基单糖高、中、低剂量组. 正常对照组、阴性对照组每天灌胃蒸馏水(10 mL/kg); 二甲双胍阳性对照组每天200 mg/kg灌胃; 壳寡糖、N-乙酰氨基单糖组分别按250, 500, 1500 mg/kg每天灌胃, 连续60 d, 然后观察各组大鼠的一般状况和饮食. 按2.5 g/kg体质量葡萄糖水溶液灌胃(ig), 测定各组大鼠0, 0.5、1、2 h耐糖血糖值, 并分别对各组大鼠肠道菌群进行培养, 计数并计算B/E值.
结果: 不同剂量的壳寡糖和N-乙酰氨基单糖均能不同程度改善糖尿病大鼠的体质量减轻、多饮、多食等症状, 中、高剂量组的效果要优于低剂量组. 各模型组的葡萄糖糖耐量均有不同程度受损. 壳寡糖各组葡萄糖耐量的显著改善(P<0.01), 中剂量组效果最好; N-乙酰氨基单糖低剂量和中剂量显著改善葡萄糖耐量(P<0.05), 低剂量组的效果最好. 糖尿病大鼠肠道内大肠肝菌和肠球菌数量升高, 而乳酸杆菌和双歧杆菌的数量明显下降. 壳寡糖各剂量组可明显降低大肠肝菌和肠球菌的数量(P<0.01), 对双歧杆菌和乳酸杆菌的增殖作用也有显著作用(P<0.01), 且改善效果随着剂量的增加而增加; N-乙酰氨基单糖各剂量组随着剂量的增加使大肠杆菌和肠球菌的数量降低, 高剂量组乳酸杆菌的增殖作用显著提高(P<0.01). 单纯糖尿病大鼠组需氧菌总数量升高, 而厌氧菌总数量升高明显下降, 厌氧菌与需氧菌之比及B/E值<1. 壳寡糖各剂量组均可使B/E值显著升高(P<0.01); N-乙酰氨基单糖高剂量组厌氧菌总数显著改善(P<0.05).
结论: 不同剂量的壳寡糖和N-乙酰氨基单糖均能不同程度的改善糖尿病大鼠的体质量减轻、多饮、多食等症状, 改善葡萄糖耐量, 对肠道微生态有调节作用.
引文著录: 阎春玲, 刘兵, 刘万顺. 壳寡糖及其衍生物对糖尿病大鼠糖耐量及肠道微生态平衡的影响. 世界华人消化杂志 2007; 15(11): 1202-1207
Revised: January 5, 2007
Accepted: January 20, 2007
Published online: April 18, 2007
AIM: To investigate the effect of chitooligo-saccharides (COS) and N-acetylglucosamine (NAG) at different doses on oral glucose tole-rance test (OGTT) and intestinal microecological balance in rats with diabetes induced by streptozotocin (STZ).
METHODS: The diabetic model of Wistar rats was duplicated with STZ intraperitoneally (65 mg/kg, once). The rats were randomly divided into 9 groups: normal control, metformin, diabetes, COS-H, COS-M, COS-L, NAG-H, NAG-M, and NAG-L group. The rats in normal control and diabetes group were treated with distilled water (10 mL/kg), and those in metformin group were treated with metformin (200 mg/kg). The rats in COS-H, COS-M and COS-L group received high-, moderate- and low-dose COS treatment (250, 500, 1500 mg/kg), while those in NAG-H, NAG-M, and NAG-L group received high-, moderate- and low-dose NAG treatment (250, 500, 1500 mg/kg). All the drugs were administered by gastric irrigation. Sixty days later, the general conditions were observed. OGTT was performed and the intestinal flora were cultured, calculated and identified. The value of B/E was also calculated.
RESULTS: COS and NAG improved the symptoms such as decrease of body weight, over-drinking and over-eating in diabetic rats, and the effects of high and moderate doses were superior to those of low ones. The glucose tolerance was decreased in all the diabetic rats, but was improved significantly (P < 0.05) by different concentrations of COS (moderate dose produced the best effect) and low and moderate concentrations of NAG (low dose produced the best effect). In diabetic rats, the numbers of pathogenetic E. Coli and Enterococcus were increased while those of Bifidobacteria and Lactobacillus were decreased. However, after administration with COS and NAG, the numbers of Bifidobacteria and Lactobacillus increased significantly, while those of pathogenetic E. Coli and Enterococcus decreased significantly (P < 0.01). The effects were increased with the elevation of COS and NAG concentrations. In diabetic rats, the total numbers of aerobes were increased, while those of anaerobes were increased markedly. The ratio of anaerobes to aerobes and the value of B/E were less than one. COS enhanced the value of B/E, while NAG augmented the total numbers of anaerobes (P < 0.05).
CONCLUSION: COS and NAG have effective effects on the general clinical symptom, disorders of glucose tolerance at different concentrations, and they can modulate the imbalance of intestinal microecology.
- Citation: Yan CL, Liu B, Liu WS. Effect of chitooligosaccharides and its derivatives on oral glucose tolerance test and intestinal microecological balance in diabetic rats. Shijie Huaren Xiaohua Zazhi 2007; 15(11): 1202-1207
- URL: https://www.wjgnet.com/1009-3079/full/v15/i11/1202.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i11.1202
糖尿病是一种危害人们生命并且难以治愈的顽症. 医学统计表明, 糖尿病及其并发症是仅次于心脑血管病和癌症的第三大疾病, 目前我国糖尿病患者约有3500多万人, 每年以75万人的速度增加. 目前, 糖尿病及其并发症的病因、发病机制尚未完全阐明. 国内外大量研究证实[1-2], 糖尿病患者的肠内细菌群往往结构紊乱, 肠道内有益菌数量低, 特别是双歧杆菌的数量和占有率远远低于正常人, 腐败菌的数量明显高于正常人, 这些状况给患者带来许多十分不利的影响. 通过食用一些含双歧因子(bifidusfactor, BF)较高的食物或双歧杆菌制剂, 使肠道内有益菌增加, 短链脂肪酸含量增加, 能够改变这种状况. 壳寡糖(chitooligosaccharides, COS)是BF的一种, 可以调节动物肠道内微生物的代谢活动, 改善肠道微生物区系分布, 促进双歧杆菌生长繁殖, 从而提高机体免疫力. 有关壳寡糖作为微生态调节剂的作用, 机制方面的报道, 国内已有相关报道[3-7], 但对链脲佐菌素(STZ)诱导的糖尿病大鼠的肠道微生态的调节作用还未见报道. 此外, 不同剂量、分子量的壳寡糖的抑菌效果和促菌增殖能力有所不同[8-11]. 本文从这个角度对不同剂量壳寡糖及N-乙酰氨基单糖对STZ诱导的糖尿病大鼠改善糖耐量和肠道微生态的作用进行了探讨.
♂Wistar大鼠89只, 体质量200±20 g. 壳寡糖, 本实验室制备, 分子质量2200 Da; N-乙酰氨基单糖(青岛海汇); 盐酸二甲双胍(北京中会药业); 链脲佐菌素(STZ)(Sigma); 血糖测定试剂盒(北京北化康泰临床试剂有限公司).
1.2.1 模型制作: 80只大鼠禁食12 h, 自由饮水. 按65 mg/kg ip STZ. 正常对照组注射等量的柠檬酸缓冲液. 注射7 d后, 眼眶静脉丛采血检测餐后2 h血糖(2 h PG), 定性尿糖. 尿糖在+++以上, 血糖>11.11 mmol/L, 有多食、多饮、多尿症状者为成模标准, 共有72只大鼠达到模型标准.
1.2.2 动物分组及受试物剂量: 大鼠分为9组: 正常对照组(未处理的正常大鼠, n = 9); 阴性对照组(单纯糖尿病模型组, DR, n = 9)、二甲双胍阳性对照组(Met, n = 9)、壳寡糖高、中、低剂量组(COS-H, COS-M, COS-L, n = 9)、N-乙酰氨基单糖高、中、低剂量组(NAG-H, NAG-M, NAG-L, n = 9)均来自成模大鼠; 正常对照组(normal control), 二甲双胍阳性对照组(Met), 阴性对照组(单纯糖尿病模型组, DR), 壳寡糖高、中、低剂量组(COS-H, COS-M, COS-L), N-乙酰氨基单糖高、中、低剂量组(NAG-H, NAG-M, NAG-L); 正常对照组、阴性对照组每天灌胃蒸馏水(10 mL/kg); 二甲双胍阳性对照组每天200 mg/kg灌胃; 壳寡糖、N-乙酰氨基单糖组分别按250, 500, 1500 mg/kg每天灌胃, 连续60 d.
1.2.3 观察指标: (1)一般状态观察: 观察各组大鼠的一般状况和饮食. 每天定时称质量, 灌胃给药, 根据体质量调整用药量; (2)糖耐量测定: 连续灌胃60 d后, 禁食12 h, 末次给药2 h后眼眶取血, 测空腹血糖(FPG), 大鼠灌胃葡萄糖水溶液(2.5 g/kg), 分别于给糖后0.5、1、2 h眼眶后静脉丛采血, 葡萄糖氧化酶法测血糖值, 以空腹血糖值作为零时血糖, 描制血糖值随时间变化曲线. 糖耐量曲线下面积(area under curve, AUC)用几何面积相加法计算[13]. 以阴性对照组糖耐量曲线下面积为100%, 计算糖耐量曲线下面积百分率; (3)肠道菌群检测: 以无菌方法取大鼠盲肠内容物0.1-0.2 g, 用稀释液稀释至10-7. 选择适当的稀释度取菌液50 μL接种于各种培养基上. EMB平板和Ec平板选用10-4, 10-5, 10-6三个稀释度, Lbs平板和Bs平板选用10-5, 10-6, 10-7三个浓度的菌液, 37 ℃培养24-48 h后观察结果; 用于乳杆菌培养的LBs平板和用于双歧杆菌培养的BS平板放入采用焦性没食子酸法造成厌氧环境的厌氧袋中37 ℃培养48-72 h. 培养结束后镜检并计算菌落数. 并进行大肠杆菌种属、肠球菌种属、乳酸杆菌种属和双歧杆菌种属鉴定[12-16].
统计学处理 全部资料用均数±标准差(mean±SD)表示, 采用SPSS软件进行分析.
STZ注射后72 h, 糖尿病大鼠逐渐出现多饮、多尿、多食、脱毛、消瘦、活动减少等特征. 不同剂量的壳寡糖对STZ诱导的糖尿病大鼠的一般状态都有明显的改善, 可以显著的改善糖尿病大鼠体质量减轻、多饮、多食等症状, 中、高剂量组的效果要优于低剂量组.
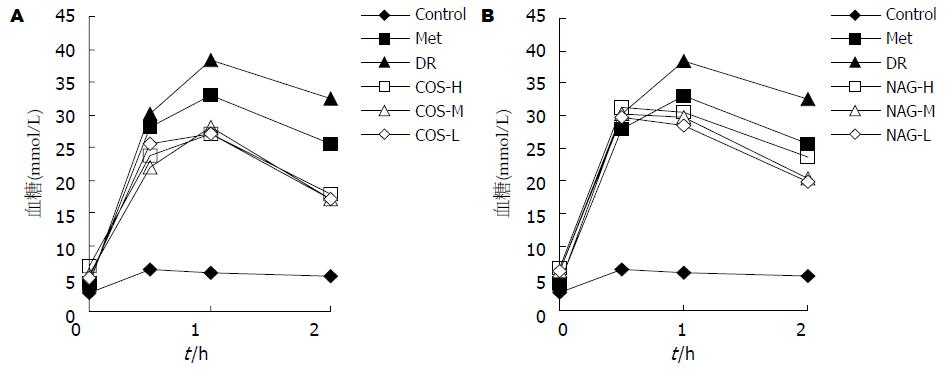
从各时相血糖值可知, 壳寡糖各组对0.5 h PG, 1 h PG, 2 h PG均有较大程度降低(图1A). N-乙酰氨基单糖对0.5 h PG均无降低作用, 与阴性对照组比较无显著差异, 而对1 h PG, 2 h PG均有较大程度降低(图1B).
各模型组的葡萄糖糖耐量均有不同程度受损, AUC与正常组比较均有显著差异(P<0.01). 壳寡糖各组与阴性对照组比较均有极显著差异(P<0.01), 中剂量组效果最好. N-乙酰氨基单糖低剂量组和中剂量组与阴性对照组比较有显著差异(P<0.05), 低剂量组效果最好(表1).
2.3.1 壳寡糖, N-乙酰氨基单糖对糖尿病大鼠肠道菌群数量的影响: 糖尿病大鼠肠道内大肠肝菌和肠球菌数量升高, 而乳酸杆菌和双歧杆菌的数量明显下降, 与正常组比较均有极其显著差异(P<0.01). 壳寡糖各剂量组可明显降低大肠肝菌和肠球菌的数量(P<0.01), 对双歧杆菌和乳酸杆菌的增殖作用与阴性对照组比较有显著差异(P<0.01), 且改善效果随着剂量的增加而增加; N-乙酰氨基单糖各剂量组随着剂量的增加使大肠杆菌和肠球菌的数量降低, 高剂量组对乳酸杆菌的增殖作用与阴性对照组比较有显著差异(P<0.01); 但各剂量组对双歧杆菌无增殖作用(表2).
| 分组 | EMB | Ec | Lbs | Bs |
| Control | 7.22±0.15b | 7.88±0.05b | 10.18±0.08b | 9.87±0.10b |
| Met | 8.52±0.31bd | 9.40±0.20ad | 9.82±0.05b | 8.51±0.19d |
| DR | 9.76±0.5d | 9.96±0.16d | 9.17±0.03d | 8.25±0.13d |
| COS-H | 8.43±0.48bc | 8.49±0.36bd | 9.69±0.22b | 9.17±0.06bd |
| COS-M | 8.15±0.07bd | 8.31±0.08b | 9.55±0.34d | 9.03±0.13bd |
| COS-L | 8.86±0.06bd | 7.87±0.16b | 8.81±0.17d | 9.01±0.20bd |
| NAG-H | 7.91±0.11bc | 10.02±0.15d | 9.84±0.05b | 8.30±0.09d |
| NAG-M | 8.71±0.81bd | 9.07±0.80bd | 9.49±0.37d | 8.34±0.53d |
| NAG-L | 8.92±0.11bd | 8.83±0.12bd | 9.17±0.49d | 8.14±0.16d |
2.3.2 壳寡糖, N-乙酰氨基单糖对DM大鼠肠道菌群厌氧菌与需氧菌之比和B/E值的影响: 单纯糖尿病大鼠组需氧菌总数量升高, 而厌氧菌总数量升高明显下降, 厌氧菌与需氧菌之比和B/E值<1, 与正常组比较均有显著差异(P<0.01). 壳寡糖各剂量组对需氧菌总数量, 厌氧菌总数量, 厌氧菌与需氧菌之比和B/E值均有改善作用, 与阴性对照组比较差异显著(P<0.01); N-乙酰氨基单糖各剂量组对需氧菌总数量有改善, 高剂量组对厌氧菌总数量的改善, 与阴性对照组比较有极显著差异(P<0.05), 各剂量组对厌氧菌与需氧菌之比和B/E值均有改善, 改善效果随着剂量的增加而增加(表3).
| 分组 | Aerobe (log CFU) | Anaerobe (log CFU) | Anaerobe/Aerobe | B/E |
| Control | 15.11±0.17b | 20.06±0.17b | 1.33±0.03b | 1.37±0.04b |
| Met | 17.93±0.45bd | 18.3±0.22bd | 1.02±0.03bd | 0.99±0.05bd |
| DR | 19.36±0.20d | 17.24±0.33d | 0.89±0.02d | 0.86±0.02d |
| COS-H | 16.89±0.18bd | 18.97±0.2bd | 1.12±0.02bd | 1.15±0.07bd |
| COS-M | 16.47±0.14bd | 18.58±0.3bd | 1.13±0.02bd | 1.11±0.01bd |
| COS-L | 16.74±0.18bd | 17.82±0.35d | 1.06±0.01bd | 1.02±0.02bd |
| NAG-H | 17.93±0.25bd | 18.48±0.49bd | 1.03±0.02bd | 1.09±0.06bd |
| NAG-M | 17.78±1.38bd | 17.83±0.84d | 1.00±0.03bd | 0.96±0.05bd |
| NAG-L | 17.75±0.22bd | 17.31±0.65d | 0.97±0.04bd | 0.91±0.03d |
以往评价药物的降血糖作用, 往往采用测定空腹血糖(fasting plasma glucose, FPG)或随机血糖, 来判断药物是否有效, 但这两者均不能真正反映机体的血糖水平. 国内外已有报道反映了FPG的局限性及不敏感性[17-19]. 葡萄糖耐量试验(oralglucosetolerancetest, OGTT), OGTT是一种葡萄糖负荷试验, 用以了解机体对葡萄糖的调节能力, 一直被公认为诊断糖尿病的金标准[20], 而餐后2 h PG是糖尿病慢性并发症的独立高危因素[21-23], 其敏感性要高于空腹血糖. 本实验结果表明, 不同剂量的壳寡糖对糖尿病大鼠60 d前后餐后2 h PG均有不同程度的降低, 壳寡糖中剂量组(500 mg/kg)的降血糖效果最好, 可使血糖降至16.14 mmol/L, 降糖率为47.481%, 与阴性对照组比较有显著差异(P<0.01). 壳寡糖各组糖耐量曲线下面积(AUC)较低, 与阴性对照组比较均有显著差异(P<0.01), 中剂量组效果最好, 仅为68.694%. 壳寡糖的降血糖作用与壳寡糖可以调节机体的酸碱平衡进而增加胰岛素的敏感性[24-25]以及能有效的促进胰岛细胞的增殖, 促进受损胰岛细胞的恢复等方面有关[26]. 本研究结果表明, N-乙酰氨基单糖各组也可不同程度降低AUC. 从各时相血糖值可知, 壳寡糖各组对0.5 h PG, 1 h PG, 2 h PG均有较大程度降低. 而N-乙酰氨基单糖对0.5 h PG均无降低作用, 而对1 h PG, 2 h PG均有较大程度降低. 提示N-乙酰氨基单糖和壳寡糖的降糖机制可能不同.
糖尿病患者由于饮食受到严格的限制, 特别是对碳水化合物的摄入限制很严, 导致肠内细菌群的结构紊乱, 腐败菌以及腐败产物的数和量比普通人高, 而肠道内有益菌数量低, 特别是双歧杆菌的数量和占有率远远低于正常人. 且Ⅱ型糖尿病患者、Ⅰ型糖尿病患者的肠内菌群变化依次恶化. 这些状况给糖尿病患者带来许多十分不利的影响. 本研究表明, 壳寡糖各剂量组可以显著降低大肠杆菌, 肠球菌和需氧菌总的数量, 促进双歧杆菌, 乳酸杆菌的增殖, 提高厌氧菌的总数量, 提高厌氧菌与需氧菌之比和B/E值, 与任林et al[6]报道相符. 而N-乙酰氨基单糖各剂量对厌氧菌与需氧菌之比和B/E值也有升高, 但对乳酸杆菌和双歧杆菌的增殖作用不明显, 其机制可能主要是N-乙酰氨基单糖可以抑制需氧菌大肠杆菌, 肠球菌的数量, 且随着剂量的增高而效果显著.
壳寡糖降低大肠杆菌, 肠球菌和需氧菌总的数量, 促进双歧杆菌, 乳酸杆菌的增殖, 提高厌氧菌的总数量, 提高厌氧菌与需氧菌之比和B/E值的机制可能有以下3点: (1)壳寡糖作为双歧因子(bifidusfactor, BF)对肠道有益微生物的增殖作用[27-28]. 动物对碳水化合物的消化主要限于α-1, 4糖苷键, 对其他糖苷键的分解能力较弱或不能分解, 因此, 壳寡糖在小肠内不能被分解, 只能以未降解的形式进入后段肠道被有益微生物如乳酸杆菌、双歧杆菌等分解利用, 使肠道有益微生物得到大量繁殖, 成为肠道内优势菌群; (2)动物消化道内微生物对外源性病原菌存在着竞争性排斥作用. 壳寡糖在肠道内占据肠黏膜表面的定植位点, 形成生物学屏障, 构成肠道的定植抗力, 阻止致病菌的定植和侵入, 减轻糖尿病的肠道菌群紊乱程度; (3)壳寡糖对大肠杆菌的直接抑制作用: 赵玉清et al[29]用圆滤纸片法测定了壳聚糖对大肠杆菌的抑制效果, 证明壳聚糖对大肠杆菌的抑制作用达到极显著差异. 此外, 有研究[30]发现有一种大肠杆菌能产生胰岛素样物质, 这种物质进入血行后, 先与胰岛素的靶细胞接触封闭了胰岛素受体. 当真正的胰岛素与靶细胞接触时已无法发挥作用, 于是血糖不能被吸收和利用而发生糖尿病. 此种情况下应用具有扶植双歧杆菌、乳杆菌等的壳寡糖, 使之发挥生物拮抗作用, 排除能产生胰岛素样物质的大肠杆菌, 糖尿病即可得到缓解. 因此壳寡糖的降糖机制与其调节肠道菌群, 改善肠道微生态的作用有这必然联系.
糖尿病及其并发症是仅次于心脑血管病和癌症的第三大疾病, 糖尿病合并感染是威胁糖尿病患者生命的重要并发症之一. 近年来, 糖尿病合并感染的发生率有上升趋势, 感染与糖尿病之间的关系已为人们所重视, 随着医疗技术的发展, 糖尿病并发感染的死亡率虽有所下降, 但其发病率仍居高不下, 达36.8%-55.9%.
糖尿病患者的肠内细菌群往往结构紊乱, 肠道内有益菌数量低, 腐败菌的数量明显高于正常人, 这给患者带来许多十分不利的影响. 双歧杆菌、乳杆菌是肠道内主要的生理性有益菌, 与其他厌氧菌一起形成肠道的生物屏障, 作为一种天然自动免疫, 维持肠道菌群平衡, 在预防、保健医学中是许多学者所关注的热门课题之一.
本文的创新之处在于研究了不同剂量的壳聚糖及其衍生物对链脲佐菌素(STZ)诱导的糖尿病大鼠糖耐量作用及肠道微生态平衡的影响, 壳聚糖无毒、无抗原性、资源丰富, 开发应用于微生态调节剂具有较广泛的前景.
水溶性壳聚糖无毒无味, 并且有一定的免疫功能和抗菌活性, 由于他水溶性好, 使用方便, 用于食品不但可作为防腐剂延长食品保质期, 而且使食品具有营养保健作用, 因而具有广阔的开发和利用前景.
葡萄糖耐量(OGTT)试验: OGTT试验是一种口服葡萄糖负荷试验, 用以了解人体对进食葡萄糖后的血糖调节能力. 通过OGTT试验, 可以早期发现糖代谢异常, 早期诊断糖尿病;
肠道微生态: 正常情况下, 肠道微生态处于平衡状态, 正常菌群中的专性厌氧菌如双歧杆菌可形成一层菌膜屏障, 抑制肠道内(主要为肠杆菌科细菌)以及外源性潜在致病菌对肠上皮细胞的黏附, 其功能主要在于防止肠道内细菌及内毒素移位.
本文通过动物模型研究壳寡糖和N-乙酰氨基单糖对糖尿病大鼠的糖耐量作用及肠道微生态平衡的影响, 取题新颖, 实验设计合理, 内容充分, 实验结果对临床有一定的指导意义.
编辑:张焕兰 电编:张敏
| 1. | Hansen AK, Ling F, Kaas A, Funda DP, Farlov H, Buschard K. Diabetes preventive gluten-free diet decreases the number of caecal bacteria in non-obese diabetic mice. Diabetes Metab Res Rev. 2006;22:220-225. [PubMed] [DOI] |
| 7. | 任 林, 陈 超群, 李 邦良, 薛 金华, 刘 小军, 高 仕瑛. 甲壳低聚糖对小鼠肠道正常菌群的影响. 南华大学学报·医学版. 2001;29:4-5. |
| 9. | Tsai GJ, Wu ZY, Su WH. Antibacterial activity of a chitooligosaccharide mixture prepared by cellulase digestion of shrimp chitosan and its application to milk preservation. J Food Prot. 2000;63:747-752. [PubMed] |
| 10. | Tsai GJ, Zhang SL, Shieh PL. Antimicrobial activity of a low-molecular-weight chitosan obtained from cellulase digestion of chitosan. J Food Prot. 2004;67:396-398. [PubMed] |
| 11. | Choi BK, Kim KY, Yoo YJ, Oh SJ, Choi JH, Kim CY. In vitro antimicrobial activity of a chitooligosaccharide mixture against Actinobacillus actinomycetemcomitans and Streptococcus mutans. Int J Antimicrob Agents. 2001;18:553-557. [PubMed] [DOI] |
| 12. | 韩 文瑜, 何 昭阳, 刘 玉斌. 病原细菌检验技术. 长春: 吉林科学技术出版社 1992; 438-439. |
| 13. | 甘肃农业大学. 兽医微生物学实验指导. 北京: 农业出版社 1991; 23-26. |
| 14. | 肖 干雄. 微生物学与微生物检验. 天津: 天津科技出版社 1991; 481-482. |
| 15. | 李 影林. 临床微生物学及检验. 北京: 人民卫生出版社 1995; 83-85. |
| 16. | 杨 洁彬, 郭 兴华. 乳酸菌. 北京: 中国轻工业出版社 1996; 43-44. |
| 17. | Sorkin JD, Muller DC, Fleg JL, Andres R. The relation of fasting and 2-h postchallenge plasma glucose concentrations to mortality: data from the Baltimore Longitudinal Study of Aging with a critical review of the literature. Diabetes Care. 2005;28:2626-2632. [PubMed] [DOI] |
| 18. | Haeckel R, Raber R, Wosniok W. Prevalence-dependent decision limits for the early detection of type 2 diabetes mellitus in venous blood, venous plasma and capillary blood during glucose challenge. Clin Chem Lab Med. 2006;44:1462-1471. [PubMed] [DOI] |
| 19. | Anand SS, Razak F, Vuksan V, Gerstein HC, Malmberg K, Yi Q, Teo KK, Yusuf S. Diagnostic strategies to detect glucose intolerance in a multiethnic population. Diabetes Care. 2003;26:290-296. [PubMed] [DOI] |
| 20. | 蒋 国彦. 糖尿病学. 北京: 人民卫生出版社 1992; 105. |
| 21. | Kondo Y, Nakatani A, Hayashi K, Ito M. Low molecular weight chitosan prevents the progression of low dose streptozotocin-induced slowly progressive diabetes mellitus in mice. Biol Pharm Bull. 2000;23:1458-1464. [PubMed] [DOI] |
| 22. | Streja D. Metabolic syndrome and other factors associated with increased risk of diabetes. Clin Cornerstone. 2004;6 Suppl 3:S14-S29. [PubMed] [DOI] |
| 23. | Bonora E, Muggeo M. Postprandial blood glucose as a risk factor for cardiovascular disease in Type II diabetes: the epidemiological evidence. Diabetologia. 2001;44:2107-2114. [PubMed] [DOI] |
| 25. | 艾 永循, 王 胜男, 杨 德森, 周 国勇. 几丁质降血糖作用的实验研究. 武汉市职工医学院学报. 2000;28:21-22. |
| 27. | 蒋 国彦. 糖尿病学. 北京: 人民卫生出版社 1992; 1-2. |