修回日期: 2006-05-25
接受日期: 2006-05-29
在线出版日期: 2006-10-08
目的: 观察航天应急返回过程中高正加速度(+Gx)对肝脏细胞c-fos基因表达的影响.
方法: 选用♂猕猴(共9只)为对象, 随机分为4组, 对照组承受+1Gx, 300 s的超重作用; 实验组根据承受过载峰值的大小分为3个亚组, 其承受过载峰值分别为+15Gx, 200 s; +18Gx, 165 s; +21Gx, 140 s. 观察高+Gx对猴肝脏细胞c-fos基因表达的影响.
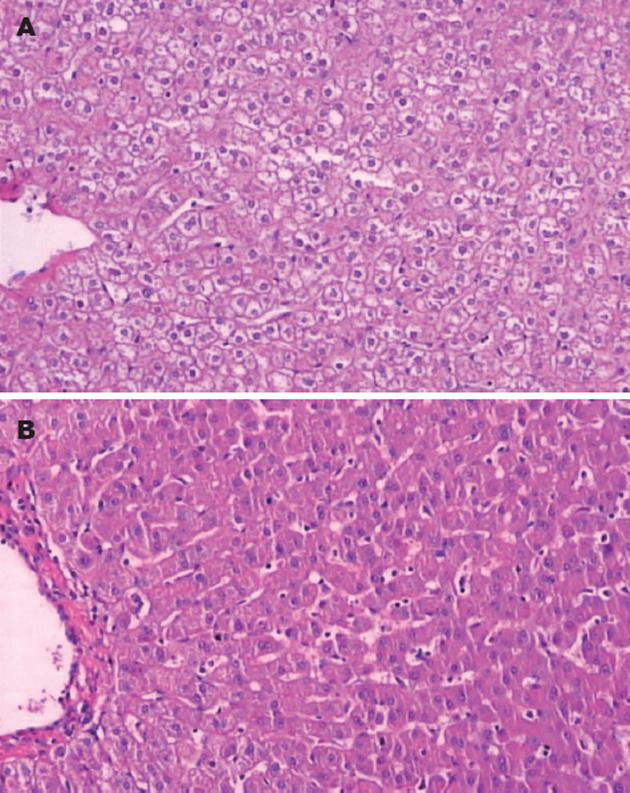
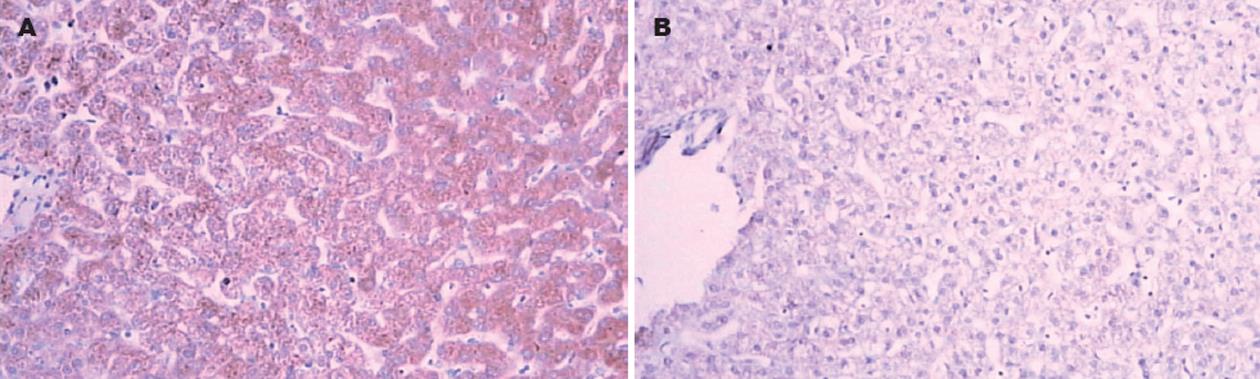
结果: 实验组肝脏细胞胞质呈现不同程度的水肿及泡状变性, c-fos基因表达明显增强, 呈弥漫性细胞质内棕黄色着色; 肝细胞c-fos基因表达程度随超重剂量的增加有增强趋势. 对照组肝脏组织病理学改变程度明显较实验组轻微, c-fos基因表达亦明显减弱.
结论: +Gx可引起猴肝脏组织细胞c-fos基因表达增强, 提示有早期肝脏组织损伤.
引文著录: 牛忠英, 张建中, 施生根, 吴斌, 李冬, 党平, 阚广捍. 高+Gx对猴肝细胞c-fos表达的影响. 世界华人消化杂志 2006; 14(28): 2793-2795
Revised: May 25, 2006
Accepted: May 29, 2006
Published online: October 8, 2006
AIM: To detect the expression of c-fos in the hepatocytes of Rhesus macaque under hypergravity (+Gx) loads.
METHODS: A total of 9 male Rhesus macaques were randomly divided into experiment groups (n = 7) and control group (n = 2). The animals in control group was exposed to +1Gx/300s overloads, and those in the experimental groups were exposed to the overloads of +15Gx/200s (n = 2), +21Gx/165s (n = 2) and +21Gx/140s (n = 3), respectively. Liver tissue was fixed with 40 g/L buffered formaldehyde and embedded with paraffin, and histopathological changes were observed under microscope. The expression of c-fos was detected by an immunohistochemical method.
RESULTS: In the experimental groups, cytoplasmic swelling and alveolar degeneration were found in the liver; the expression of c-fos was detected in the cytoplasm of hepatocytes, with a tendency of enhancement as the dosage of hypergravity increased. In the control group, no significant histopathological changes were observed and the expression of c-fos was also remarkably decreased.
CONCLUSION: Overload of gravity can induce significant injuries of the liver in Rhesus macaque.
- Citation: Niu ZY, Zhang JZ, Shi SG, Wu B, Li D, Dang P, Kan GH. Effect of hypergravity on expression of c-fos gene in hepatocytes of Rhesus macaque. Shijie Huaren Xiaohua Zazhi 2006; 14(28): 2793-2795
- URL: https://www.wjgnet.com/1009-3079/full/v14/i28/2793.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i28.2793
载人飞船上升和返回过程中, 特别是在应急返回时, 航天员可能会受到较大的胸-背向高正加速度(+Gx)的作用或失重后+Gx的影响[1]. 有研究表明, 超过+3Gx负荷可引起大鼠脑组织能量代谢变化, +Gx负荷可以导致脑组织缺血缺氧, 引起脑功能的改变和工作效率的降低[2-3]. c-fos基因是一种即刻早期基因, c-fos基因的表达产物Fos蛋白与靶基因的特异序列结合, 调节其转录水平发挥信使作用, 参与调节细胞内诸多下游基因的转录[4]. 本研究目的旨在探讨模拟飞船应急返回时高+Gx对猴肝脏细胞c-fos基因表达的影响, 以期能更深入的了解高+Gx作用对机体重要器官造成的早期损伤, 为进一步研究改善和提高机体抗损伤能力提供实验依据.
实验用♂恒河猴9只, 年龄5-12岁(青壮年), 体质量5-8 kg, 健康, 无人畜共患病, 不携带B病毒、结核杆菌等致病因子. 随机分为对照组和实验组. 对照组: +1 Gx, 300 s(n = 2只); 实验组: 根据承受+Gx峰值的大小分为3个亚组. 1组为15 Gx, 200 s(n = 2只); 2组为18 Gx(n = 2只), 165 s; 3组为21 Gx, 140 s(n = 3只).
实验在航天医学工程研究所离心机实验室进行, 采用3/4过技术改造后的五八型动物离心机. 该离心机在计算机控制下, 模拟飞行器应急返回时产生的抛物线型高+Gx. 动物禁食8 h后运至离心机实验室, 使用846合剂(0.15-0.2 mL/kg)进行后肢肌肉注射麻醉, 仰卧固定于离心机吊篮中, 背角700. 离心机在动物清醒后开始运转, 对照组与实验组动物分别承受相应的胸-背向+Gx 作用. 实验结束后, 动物由吊篮移到解剖台, 放血处死, 取材. 取实验动物的肺组织用40 g/L中性缓冲甲醛溶液固定, 采用常规方法进行脱水, 石蜡包埋, 5 μm连续切片, 苏木精伊红染色, 光学显微镜下(×100)观察. 采用免疫组化PicTureTM两步法, 观察模拟+Gx环境对肝组织c-fos表达的影响(PV-6000试剂盒为美国Zymed公司产品, 抗c-fos为美国Santa Cruz公司产品). 实验步骤按照试剂盒要求程序进行, 光学显微镜下分别观察对照组、实验组高+Gx对肝组织细胞c-fos表达的影响. 判断结果的指标: c-fos阳性反应细胞为细胞质和细胞膜着棕色.
对照组: 肝脏表面无明显变化; 实验组: 肝脏表面均可见多个大小不等的出血点或出血斑, 这些改变随着+Gx值的加大而更加明显.
c-fos基因是一种即刻基因, 与多数细胞增殖有关, 其编码蛋白在细胞核内起着转录因子即"第三信使"的作用, 参与调节细胞内诸多下游基因的转录. 正常状态时该转录因子参与调节细胞凋亡与增殖以及信号传递等生理过程, 并参与脑功能活动的信号转导和调控过程[5]. 在非正常条件下, 多种刺激因子, 如自由基、细胞因子(IL-6, TNF)、缺氧、缺血、光线刺激、机械力刺激、疼痛刺激等均可以诱导细胞中c-fos基因的表达. 缺血-再灌注可诱导心肌细胞c-fos基因表达明显增强[6]. c-fos基因的表达产物Fos蛋白与靶基因的特异序列结合, 可以调节其转录水平并发挥信使作用, 靶基因为阿片肽基因, 通过调节中枢神3/4系统阿片肽的水平调控痛觉[7]. c-fos基因可作为观察高+Gx对猴肝脏肝细胞刺激作用的一个标志物, 了解机体重要器官的早期响应及其程度. 高+Gx是航天活动中的对机体产生较大影响重要因素之一, 动物实验研究已3/4证实, +Gx负荷可以导致脑组织缺血缺氧[8-9]. 随着航天科技的高速发展, 航天器所产生的+Gx逐渐减小, 一般在+5Gx以内. 但是, 在航天器应急返回过程中仍然可能产生+10-+15 Gx, 甚至更大的+Gx[10]. 为了保证航天员的安全, 载人飞船在应急返回时, 其过载最好不要超过15G, 应避免出现更高G值的工况[11]. 本研究以猴为实验动物, 采用组织病理学和免疫组织化学的方法, 观察了不同+Gx对猴肝脏组织肝细胞c-fos基因表达的变化. 本研究结果显示, 高+Gx可诱导猴肝脏肝细胞c-fos基因的表达增强, 其表达程度随+Gx值的加大而增加. 提示在高+Gx作用下猴肝脏肝细胞c-fos基因被激活, 参与调节细胞的凋亡过程, 还可能参与调节细胞的增殖过程. 细胞凋亡与细胞增殖的双重调控意义在于受损细胞发生凋亡被淘Ì的同时, 促使细胞增殖以替代凋亡细胞用于修复损伤, 从而维持重要脏器细胞增殖与凋亡的平衡.
高+Gx作用对机体重要器官的损伤是一个复杂的病理生理过程, c-fos基因作为核转录因子, 是调控器官和组织对刺激应答合成效应蛋白的重要开关之一, 通过研究即刻基因c-fos基因在高+Gx作用肝脏组织细胞损伤中的表达规律, 有助于深入探讨其在肝脏组织损伤发生和损伤后修复中的作用及其机制及进一步提出相应的防护措施.
载人飞船在上升或返回, 特别是在主动段大气层外弹道式应急返回时, 航天员会遇到强大的胸 - 背向超重(+Gx)作用. 高过载环境是航空航天活动中对人体有较大影响的因素之一, 阐明其发生发展机制, 对于+Gx的致伤效应的防治具有重要意义. 高+Gx作用对机体重要器官的损伤是一个复杂的病理生理过程, c-fos基因作为核转录因子, 是调控器官和组织对刺激应答合成效应蛋白的重要开关之一, 通过研究即刻基因c-fos基因在高+Gx作用肝脏组织细胞损伤中的表达规律, 有助于深入探讨其在肝脏组织损伤发生和损伤后修复中的作用及其机制及进一步提出相应的防护措施.
为了保证航天员的安全, 载人飞船在应急返回时, 其过载最好不要超过15G, 应避免出现更高G值的工况.
+Gx: (飞行器运行过程中的)超重或过载, 本文是指飞船乘员在上升或返回途中受到强大的胸-背向超重作用.
c-fos: 是一种即刻反应基因. 人体在受到缺氧、疼痛、机械和光电等刺激后, 体内一些重要器官功能活动的信号转导和调控过程发生应急反应, c-fos等基因首先活化和表达.
高+GX对猴肝细胞影响的研究较少, 因此, 研究有一定的新颖性, 能较好地反映航天医学基础研究的先进水平.
电编:李琪 编辑:王晓瑜
| 1. | 刘 光远, 沈 羡云, 陈 涤明. 重力生理学. 北京: 国防工业出版社 2001; 37-40. |
| 3. | Kotovskaya AR, Vil-Viliams IF. tolerance following one-year real and simulated microgravity. Physiologist. 1992;35:S208-S209. [PubMed] |
| 7. | 卢 静, 戴 体俊, 曾 因明. c-fos基因表达的相关机制和意义. 国外医学麻醉学与复苏分册. 2004;25:273-275. |
| 8. | Baranov VM, Tikhonov MA, Kotov AN. The external respiration and gas exchange in space missions. Acta Astronaut. 1992;27:45-50. [PubMed] [DOI] |
| 10. | 中国人民解放军总装备部军事训练教材编辑委员会. 航天重力生理学与医学. 北京: 国防工业出版社 2001; 60-68. |