修回日期: 2006-06-26
接受日期: 2006-07-10
在线出版日期: 2006-09-08
哺乳动物大肠中的厌氧微生物能发酵产生大量的短链脂肪酸(SCFA), 包括乙酸、丙酸和丁酸, 其中丁酸是结肠能量的首选来源, 对肠黏膜修复及结肠炎和结肠癌的预防起作用. 近年来, 随着分子生物学技术的发展, 关于肠道产丁酸菌种类、数量及发酵特性的研究有了很大进展. 本文就单胃动物肠道产丁酸菌种类、丁酸产生途径的研究新进展进行综述.
引文著录: 于卓腾, 杭苏琴, 姚文, 朱伟云. 肠道产丁酸细菌及其丁酸产生机制的研究进展. 世界华人消化杂志 2006; 14(25): 2531-2534
Revised: June 26, 2006
Accepted: July 10, 2006
Published online: September 8, 2006
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2006; 14(25): 2531-2534
- URL: https://www.wjgnet.com/1009-3079/full/v14/i25/2531.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i25.2531
哺乳动物大肠中的厌氧微生物可发酵产生大量的短链脂肪酸(SCFA), 包括乙酸、丙酸和丁酸. 这些SCFA能够为结肠提供能量, 其中丁酸是肠黏膜细胞的主要能量来源[1]. 人肠道细胞体外研究表明, 丁酸可促进肠黏膜修复及其功能恢复, 并且能抑制炎症细胞因子的形成, 从而起抗炎症作用[2-3]. 通过肠道灌注, 丁酸钠可促进三硝基苯磺酸实验性结肠炎的愈合[4]. 体外研究表明, 丁酸还具有抗肿瘤作用, 他可减少肠道上皮细胞的肿瘤坏死因子的分泌[3], 能诱导肿瘤细胞分化和凋亡, 从而抑制肿瘤生长, 并且这种作用对肿瘤等转化细胞具有特异性[1]. 国内外已有许多关于丁酸对肠道功能的报道, 但对肠道内产丁酸菌的报道还较少, 肠道内产丁酸菌可产生大量丁酸, 因此本文就肠道产丁酸菌的种类及其产丁酸的调控作一综述.
在正常生理状态下, 胃肠道微生物的生态环境保持相对稳定, 但不同肠段因环境条件不同其微生物的种类和数量存在差异. 胃中的低pH (2.5-3.5)对大多数微生物有抑制作用, 细菌平均数量为103 CFU/mL; 小肠由于胆汁和胰液的作用, 停留在其中的微生物种类和数量也相对较少, 细菌平均数量为108 CFU/mL. 大肠由于特殊的位置、结构、酸碱条件和厌氧环境使得其中的微生物种类最复杂, 数量最多. 有研究表明在健康成年人结肠中栖息的细菌数量达到1013-1014 CFU/L, 有300-400种, 主要为Bacteroides, Eubacterium, Bifidobacterium, Peptostreptococcus, Clostridium, Enterobacteria-ceae, Streptococcus, Faecalibacterium和Lactobacillus等[5].
产丁酸菌主要存在于盲肠和结肠, 主要属于梭菌属(Clostridium)、真杆菌属(Eubacterium)和梭杆菌属(Fusobacterium). 由于传统培养方法的限制, 关于肠道中产丁酸菌的种类和数量知之甚少. 近年来, 随着分子生物学技术的发展, 肠道产丁酸菌的研究有了很大进展, 许多产丁酸菌得以被认识或重新被命名. 过去的研究认为, Fusobacterium prausnitzii的一些菌株是肠道中主要的产丁酸菌之一[6]. 但是最近研究发现, 表型上属于F. prausnitzii的产丁酸菌菌株在16S rDNA序列遗传进化上并不与真正的Fusobacterium菌株相关[7], 进一步研究被鉴定归为新属的种, 即Faecalibacterium prausnitzii[8]. Eubacterium菌也是肠道和粪样中主要产丁酸菌, 如E. rectale, E. ramulus, E. ventriosum, E. oxidoreducens等都可在人粪样中分离到. Duncan et al[9-10]从人粪样中除分离到E. oxidoreducens和F. prausnitzii外, 还发现了5株与已有菌不同的产丁酸菌. 这5株菌之间其16S rDNA序列相似性在98.5%以上, 表型及发酵特性相似, 且均与E. rectale最为接近, 但通过16S rDNA序列分析后发现这些菌株与R. cecicola关系更近, 但与所有已知菌的相似性都低于95%, 经进一步研究鉴定认为属于新种Roseburia intestinalis. 迄今, 根据16S rRNA (rDNA)进化树分析, 肠道中产丁酸的Eubacterium属的菌以及R. cecicola, R. intestinalis和F. prausnitzii种的菌株都属于梭菌聚类(Clostridial clusters), 但分散在不同的亚群, 其中R. cecicola, R. intestinalis属于Cluster XIVa, 与E. rectale最接近, 而F. prausnitzii与其他产丁酸菌的进化关系稍远, 而与多个Ruminococcus种相近, 属同一个亚群Cluster Ⅳ[1].
不同人个体中其肠道产丁酸菌在种类和数量分布上存在差异. Barcenilla et al[11]利用厌氧滚管技术从3个健康人(婴儿, 成年素食者和成年杂食者)的新鲜粪样中分离了313株产丁酸菌, 发现有74株细菌体外发酵产丁酸量大于2 mmol/L, 其中从婴儿粪样中分离到的产丁酸菌产丁酸浓度最高, 约有50%的菌株产丁酸量大于10 mmol/L. 通过16S rDNA和RFLP分析进一步发现, 3种粪样中的主要产丁酸菌种类存在很大差异: 婴儿粪样中产丁酸菌种类最多, 而素食者次之, 杂食者粪样中产丁酸菌种类要明显少于前两者. 通过对24株代表性菌株进行全序列测定分析, 发现其中10株分别属于E. rectale, E. ramulus或R. cecicola, 有部分菌株与E. ventriosum或F. prausnitzii的全序列相似性大于97%, 另有部分为未知菌. Hold et al[12]利用16S rRNA种特异性探针对10人粪样中产丁酸菌Eubacterium hallii, F. prausnitzii, R. intestinalis和Coprococcus eutactus进行流式细胞计数, 发现每个人粪样中至少栖息着3种产丁酸菌, 即E. hallii, F. prausnitzii, R. intestinalis, 分别占整个粪样中细菌总数0.6%, 3.8%, 2.3%, 其中R. intestinalis和F. prausnitzii相关菌株是人粪样中数量最多的产丁酸菌. 与人肠道产丁酸菌研究相比, 对动物的研究较少. Gong et al[13-14]利用16S rRNA基因克隆和序列技术研究肉仔鸡肠道微生物菌群结构, 在发现肉仔鸡盲肠和回肠中产丁酸菌和乳酸杆菌、真杆菌一起为三大主要菌群的同时, 平板计数分析发现产丁酸菌F. prausnitzii在盲肠中数量最多, 其他肠道部位较少. 但是, 其他产丁酸菌的种类和数量尚不清楚.
以上研究表明, F. prausnitzii和R. intestinalis可能是人和动物肠道中优势的产丁酸菌. 而且最新研究还表明, 这两种菌在体外发酵时可产生大量丁酸, 丁酸产量高于10 mmol/L[8-9]. 因此, 这两种产丁酸菌可能对肠道健康起着重要的作用.
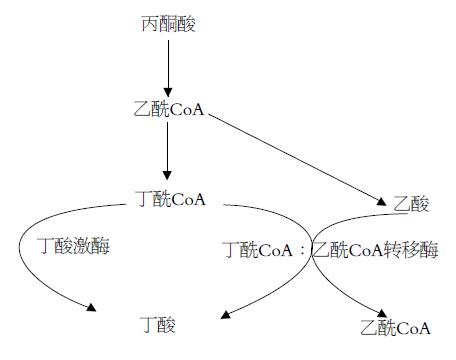
产丁酸菌可通过丙酮酸途径经过丁酰CoA生成丁酸(图1). 一般认为, 丁酸激酶作用是生成丁酸的主要途径. 但近年来研究表明, 丁酰CoA: 乙酰CoA转移酶可能是丁酸形成过程中的主要酶. Barcenilla et al[11]体外培养研究发现, 分离自人粪样的74株产丁酸菌中50%需要消耗乙酸产生丁酸, 表明他们都是利用丁酰CoA: 乙酰CoA转移酶来形成丁酸.
Duncan et al[15-16]发现来自人粪样的R. intestinalis, F. prausnitzii和Coprococcus sp., 在体外培养时均可产生大量丁酸, 其中R. intestinalis和F. prausnitzii具有丁酰CoA: 乙酰CoA转移酶的活性, 而无丁酸激酶活性, 当以葡萄糖为底物进行体外培养时需要添加乙酸才能产生丁酸, 说明这两种菌是纯乙酸利用菌. 相反, Coprococcus sp.本身能够产生乙酸, 在其培养液中能同时检测到丁酰CoA: 乙酰CoA转移酶和丁酸激酶的活性. Louis et al[17]利用对丁酸激酶基因的检测, 发现来自不同梭菌亚群(Cluster Ⅳ, XIVa和XVI)的38株代表性产丁酸菌中只有4株具有丁酸激酶活性, 而酶活分析表明38株菌都有丁酰CoA: 乙酰CoA转移酶活性. 一般情况下, 肠道中乙酸是浓度最高的一种脂肪酸, 因此, 丁酰CoA: 乙酰CoA转移酶可能是肠道中生成丁酸的主要途径. Charrier et al[18]在结肠细菌Roseburia sp.中发现了一种新的CoA转移酶的基因, 他与乙酰CoA水解酶和4-羟基丁酰CoA转移酶的序列相似, 在大肠杆菌中表达后在乙酸存在时表现出利用丁酰CoA的活性. 这种新发现的CoA转移酶可能在结肠丁酸的形成过程中起重要作用.
我们研究发现在仔猪后肠甘露寡糖显著降低乙酸含量, 而显著提高丁酸含量; 甜菜汁组乙酸比例随剂量增加而下降, 而丁酸则随之显著上升, 因此可能存在明显的乙酸转化为丁酸的过程.
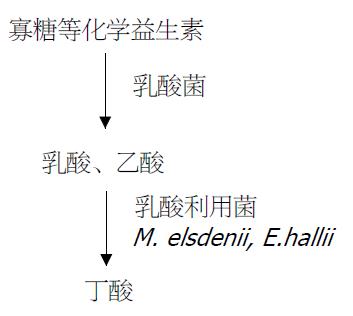
结肠中许多细菌包括双歧杆菌和乳杆菌可产生乳酸, 但在正常状态下乳酸不能在健康人肠道中积聚; 相反, 当结肠产生病变如发生结肠炎时, 乳酸却会积聚. 乳酸浓度升高将会影响营养、水的吸收, 改变结肠微生物区系及结肠pH值. 因此维持结肠生态系统中乳酸利用菌和产丁酸菌的平衡对于防止乳酸积累以及稳定结肠代谢有重要作用(图2). Duncan et al[19]从粪样中分离到9株乳酸利用菌, 他们均能利用乳酸和乙酸产生丁酸, 其中4株经序列鉴定为E. hallii, 两株为Anaerostipes caccae. E. hallii代谢35 mmol/L乳酸可生成25 mmol/L丁酸, 但在葡萄糖存在时其活性受到抑制. 当以淀粉为底物, 乳酸利用菌株与淀粉利用菌双歧杆菌Bifidobacterium adolescentis菌株共培养时, 该双歧杆菌产生的所有乳酸全部转化成丁酸. 这种交互作用有助于解释日粮抗性淀粉的产丁酸作用(图2). 体外研究Bifidobacterium adolescentis, 乳酸利用菌和产丁酸菌如E. hallii, Anaerostipes caccae的相互作用时发现, E. hallii, A. caccae在用淀粉纯培养时不能生长, 但与B. adolescentis共生时则可产生丁酸[20]. Bourriaud et al[21]通过体外培养发现人肠道微生物可利用D型和L型乳酸作为前体合成丁酸. Tsukahara et al[22]利用猪粪研究发现, 葡萄糖酸可刺激丁酸的产生, 并经鉴定发现猪粪中Megasphaera elsdenii和Mitsuokella multiacida可利用乳酸和乙酸产生丁酸. 因此由乳酸转变为丁酸需要不同细菌的协同作用.
结肠中丁酸的产生与抗小肠消化而进入结肠的底物种类和含量相关. 食物中纤维成分是细菌发酵产丁酸的主要来源, 每天大约消耗80 g纤维残渣生成300-400 mmol短链脂肪酸, 其中60-80 mmol为丁酸[1]. Schneider et al[23]研究发现高纤维含量的食物可使人粪便丁酸浓度提高20%.
结肠内淀粉含量与丁酸产量也有密切的关系. Duncan et al[10]通过体外发酵发现支链淀粉和菊糖可促进产丁酸菌Roseburia菌株的生长, 而果胶和木聚糖则无促增殖作用. 当结肠内抗性淀粉的量增加时, 结肠丁酸浓度增加, 其在短链脂肪酸中所占的比例也随之增加. 抗性淀粉在盲肠和结肠中均可被发酵产生丁酸, 而添加麦麸可抑制抗性淀粉在盲肠中的发酵, 从而提高其在结肠的发酵, 使结肠中丁酸浓度显著增加[24].
除抗性淀粉和菊糖外, 许多报道表明, 其他可作为化学益生素的非降解寡糖如大豆纤维、异麦芽低聚糖、果寡糖、棉子糖和龙胆二糖等可以通过调控肠道微生物区系特别是促进乳酸杆菌和双歧杆菌的增殖从而起到保健作用[24]. Weaver et al[25]报道阿卡波糖是Actinoplanes形成的一种寡糖, 他能抑制双糖和淀粉的消化, 人服用后, 粪便中丁酸产量显著增加, 而乙酸和丙酸的产量下降. 而这些肠道有益菌的主要发酵产物通常是乳酸, 因此, 很多化学益生素可能通过促进产乳酸间接地提高了丁酸的产量(图2). 本实验室在研究外源乳酸菌对仔猪肠道微生物发酵时发现, 仔猪断奶后, 结肠挥发性脂肪酸浓度明显下降, 但外源乳酸菌可促进仔猪结肠丁酸的产生[26]. 因此, 用于调控乳酸菌群的益生素和化学益生素可能都具有促进产丁酸的功能. pH也是影响丁酸产生的一个重要因素, 在添加混合碳水化合物时通过体外持续厌氧培养人粪样微生物发现, pH 5.5时丁酸浓度(24.9 mmol/L)显著高于pH 6.5时丁酸浓度(13.8 mmol/L), 同时发现低pH条件下产丁酸菌的数量增加[27].
丁酸对肠道健康起重要作用, 产丁酸菌的研究正引起很多研究工作者的兴趣. 近年来随着分子生物学技术的发展, 关于肠道产丁酸菌群组成及丁酸调控的研究有了很大的进展, 肠道产丁酸菌及其丁酸产生、食物或日粮及宿主健康三者之间的关系将会进一步阐明, 而调控肠道丁酸产量的新型益生素和化学益生素将具有良好的应用前景.
丁酸是结肠能量的首选来源, 对肠黏膜修复及结肠炎和结肠癌的预防起作用. 肠道产丁酸菌是丁酸产生的主要来源, 国内外已有许多关于丁酸对肠道功能的报道, 但对肠道内产丁酸菌的报道还较少, 近年来随着分子生物学技术的发展, 关于肠道产丁酸菌群组成及丁酸调控的研究有了很大的进展, 肠道产丁酸菌及其丁酸产生、食物或日粮及宿主健康三者之间的关系将会进一步阐明, 而调控肠道丁酸产量的新型益生素和化学益生素将具有良好的应用前景.
本文语言流畅, 对肠道产丁酸细菌及其丁酸产生机制的研究进展作了综述, 思路清晰, 能反映研究工作的科学问题和特定内容, 文章科学性和可读性较好.
电编:张敏 编辑:张焕兰
| 1. | Pryde SE, Duncan SH, Hold GL, Stewart CS, Flint HJ. The microbiology of butyrate formation in the human colon. FEMS Microbiol Lett. 2002;217:133-139. [PubMed] [DOI] |
| 2. | Augenlicht LH, Mariadason JM, Wilson A, Arango D, Yang W, Heerdt BG, Velcich A. Short chain fatty acids and colon cancer. J Nutr. 2002;132:3804S-3808S. [PubMed] |
| 3. | Segain JP, Raingeard de la Bletiere D, Bourreille A, Leray V, Gervois N, Rosales C, Ferrier L, Bonnet C, Blottiere HM, Galmiche JP. Butyrate inhibits inflammatory responses through NFkappaB inhibition: implications for Crohn's disease. Gut. 2000;47:397-403. [PubMed] [DOI] |
| 4. | 胡 仁伟, 欧阳 钦, 王 皓. 丁酸钠对三硝基苯磺酸实验性结肠炎的疗效研究. 四川大学学报(医学版). 2003;34:562-564. |
| 5. | Holzapfel WH, Haberer P, Snel J, Schillinger U, Huis in't Veld JH. Overview of gut flora and probiotics. Int J Food Microbiol. 1998;41:85-101. [PubMed] [DOI] |
| 6. | Moore WE, Moore LH. Intestinal floras of popula-tions that have a high risk of colon cancer. Appl Environ Microbiol. 1995;61:3202-3207. [PubMed] |
| 7. | Wang RF, Cao WW, Cerniglia CE. Phylogenetic analysis of Fusobacterium prausnitzii based upon the 16S rRNA gene sequence and PCR confirmation. Int J Syst Bacteriol. 1996;46:341-343. [PubMed] [DOI] |
| 8. | Duncan SH, Hold GL, Harmsen HJ, Stewart CS, Flint HJ. Growth requirements and fermentation products of Fusobacterium prausnitzii, and a pro-posal to reclassify it as Faecalibacterium prausnitzii gen. nov., comb. nov. Int J Syst Evol Microbiol. 2002;52:2141-2146. [PubMed] |
| 9. | Duncan SH, Hold GL, Barcenilla A, Stewart CS, Flint HJ. Roseburia intestinalis sp. nov., a novel saccharolytic, butyrate-producing bacterium from human faeces. Int J Syst Evol Microbiol. 2002;52:1615-1620. [PubMed] [DOI] |
| 10. | Duncan SH, Scott KP, Ramsay AG, Harmsen HJ, Welling GW, Stewart CS, Flint HJ. Effects of alternative dietary substrates on competition between human colonic bacteria in an anaerobic fermentor system. Appl Environ Microbiol. 2003;69:1136-1142. [PubMed] [DOI] |
| 11. | Barcenilla A, Pryde SE, Martin JC, Duncan SH, Stewart CS, Henderson C, Flint HJ. Phylogenetic relationships of butyrate-producing bacteria from the human gut. Appl Environ Microbiol. 2000;66:1654-1661. [PubMed] [DOI] |
| 12. | Hold GL, Schwiertz A, Aminov RI, Blaut M, Flint HJ. Oligonucleotide probes that detect quantita-tively significant groups of butyrate-producing bacteria in human feces. Appl Environ Microbiol. 2003;69:4320-4324. [PubMed] [DOI] |
| 13. | Gong J, Forster RJ, Yu H, Chambers JR, Sabour PM, Wheatcroft R, Chen S. Diversity and phylogenetic analysis of bacteria in the mucosa of chicken ceca and comparison with bacteria in the cecal lumen. FEMS Microbiol Lett. 2002;208:1-7. [PubMed] [DOI] |
| 14. | Gong J, Forster RJ, Yu H, Chambers JR, Wheatcroft R, Sabour PM, Chen S. Molecular analysis of bacterial populations in the ileum of broiler chickens and comparison with bacteria in the cecum. FEMS Microbiol Ecol. 2002;41:171-179. [PubMed] [DOI] |
| 15. | Duncan SH, Barcenilla A, Stewart CS, Pryde SE, Flint HJ. Acetate utilization and butyryl coenzyme A (CoA):acetate-CoA transferase in butyrate-producing bacteria from the human large intestine. Appl Environ Microbiol. 2002;68:5186-5190. [PubMed] [DOI] |
| 16. | Duncan SH, Holtrop G, Lobley GE, Calder AG, Stewart CS, Flint HJ. Contribution of acetate to butyrate formation by human faecal bacteria. Br J Nutr. 2004;91:915-923. [PubMed] [DOI] |
| 17. | Louis P, Duncan SH, McCrae SI, Millar J, Jackson MS, Flint HJ. Restricted distribution of the butyrate kinase pathway among butyrate-producing bacteria from the human colon. J Bacteriol. 2004;186:2099-2106. [PubMed] [DOI] |
| 18. | Charrier C, Duncan GJ, Reid MD, Rucklidge GJ, Henderson D, Young P, Russell VJ, Aminov RI, Flint HJ, Louis P. A novel class of CoA-transferase involved in short-chain fatty acid metabolism in butyrate-producing human colonic bacteria. Microbiology. 2006;152:179-185. [PubMed] [DOI] |
| 19. | Duncan SH, Louis P, Flint HJ. Lactate-utilizing bacteria, isolated from human feces, that produce butyrate as a major fermentation product. Appl Environ Microbiol. 2004;70:5810-5817. [PubMed] [DOI] |
| 20. | Belenguer A, Duncan SH, Calder AG, Holtrop G, Louis P, Lobley GE, Flint HJ. Two routes of metabolic cross-feedingbetween Bifidobacterium adolescentis and butyrate-producing anaerobes from the human gut. Appl Environ Microbiol. 2006;72:3593-3599. [PubMed] [DOI] |
| 21. | Bourriaud C, Robins RJ, Martin L, Kozlowski F, Tenailleau E, Cherbut C, Michel C. Lactate is mainly fermented to butyrate by human intestinal microfloras but inter-individual variation is evident. J Appl Microbiol. 2005;99:201-212. [PubMed] [DOI] |
| 22. | Tsukahara T, Koyama H, Okada M, Ushida K. Stimulation of butyrate production by gluconic acid in batch culture of pig cecal digesta and identification of butyrate-producing bacteria. J Nutr. 2002;132:2229-2234. [PubMed] |
| 23. | Schneider SM, Girard-Pipau F, Anty R, van der Linde EG, Philipsen-Geerling BJ, Knol J, Filippi J, Arab K, Hebuterne X. Effects of total enteral nutrition supplemented with a multi-fibre mix on faecal short-chain fatty acids and microbiota. Clin Nutr. 2006;25:82-90. [PubMed] [DOI] |
| 24. | Govers MJ, Gannon NJ, Dunshea FR, Gibson PR, Muir JG. Wheat bran affects the site of fermentation of resistant starch and luminal indexes related to colon cancer risk: a study in pigs. Gut. 1999;45:840-847. [PubMed] [DOI] |
| 25. | Weaver GA, Tangel CT, Krause JA, Parfitt MM, Jenkins PL, Rader JM, Lewis BA, Miller TL, Wolin MJ. Acarbose enhances human colonic butyrate production. J Nutr. 1997;127:717-723. [PubMed] |
| 26. | 苏 勇, 姚 文, 黄 瑞华, 朱 伟云. 芽孢乳杆菌S1对断奶前后仔猪肠道乳酸菌、大肠杆菌和挥发性脂肪酸含量变化的影响. 福建农林大学学报(自然科学版). 2006;35:73-76. |
| 27. | Walker AW, Duncan SH, McWilliam Leitch EC, Child MW, Flint HJ. pH and peptide supply can radically alter bacterial populations and short-chain fatty acid ratios within microbial communities from the human colon. Appl Environ Microbiol. 2005;71:3692-3700. [PubMed] [DOI] |