修回日期: 2005-03-01
接受日期: 2005-03-22
在线出版日期: 2005-05-01
目的: 克隆并表达Clostridium difficile (C difficile)细胞毒素B羧基末端功能区基因, 为探索高效的防治C difficile感染的疫苗和诊断抗原奠定基础.
方法: 提取C difficile染色体基因, 用PCR方法扩增Toxin B3基因, 将其克隆至表达载体PET22b(+), 用重组质粒转化大肠杆菌[E. coli BL21(DE3)], 并在大肠杆菌BL21(DE3)中表达. 用SDS-PAGE方法对表达产物进行分析.
结果: 从C difficile基因组DNA中成功地克隆了毒素B的羧基末端重复区域的1 848 bp基因, 经过双酶切、PCR和测序鉴定分析, 插入到载体的基因与GenBank中公布的C difficile VPI10463的Toxin B3基因序列的同源性为99%. SDS-PAGE显示, 目的基因表达产物的分子质量为71.3 ku, 利用表达载体PET22b(+)表达出蛋白质, 重组蛋白表达量占菌体总蛋白的34.8%.
结论: 含C difficile Toxin B3基因的PET22b(+)重组质粒能高效表达目的基因. 该重组子的构建为Clostridium difficile相关性疾病的诊断及后期制备疫苗, 提供了有力的保障.
引文著录: 刘红升, 姜泊, 陈村龙, 陈学清. Clostridium difficile细胞毒素B羧基末端功能区的克隆与表达. 世界华人消化杂志 2005; 13(9): 1136-1138
Revised: March 1, 2005
Accepted: March 22, 2005
Published online: May 1, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(9): 1136-1138
- URL: https://www.wjgnet.com/1009-3079/full/v13/i9/1136.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i9.1136
C difficile是肠道感染中仅次于弯曲杆菌的常见致病菌, 现已被公认为发达国家中最重要的院内感染源之一[1]. 已论证约25%的抗生素相关性腹泻(AAD)、75%的抗生素相关性结肠炎以及近90%假膜性结肠炎(PMC)均与他的感染有关[2-3]. 尤其是患严重的或多种基础性疾病而长期住院治疗老年人、或是使用广谱抗生素以及免疫功能抑制者更易感染C difficile, 导致艰难梭菌相关性疾病(CDAD), 从而延长住院时间、增加医疗费用, 有时甚至因该病引起的严重并发症而死亡. 虽然以口服甲硝唑或万古霉素治疗可取得较好的疗效, 但目前依然存在因对甲硝唑、万古霉素耐药问题及停药后的复发等问题[3]. 疫苗接种可使高危人群获得持久和较强的免疫力, 是预防与控制感染的有效措施. 随着分子生物学技术的发展, 有关C difficile重组抗原的研究已见较多的报道, 但多数是集中在毒素A上[4-5], 而对毒素B的研究则相对较少. 我们根据Genth et al[6]的文章将毒素B分成3个氨基酸片段: CDB1(氨基酸1-546, 包含接触反应区), CDB2(氨基酸 901-1750, 含有假定的跨膜区), CDB3(氨基酸1751-2366, 被认为是受体结合区), 发现抗毒素B抗体与毒素B羧基末端(氨基酸1751-2366)可以发生强烈反应, 说明该段很有可能成为制备疫苗和诊断抗原的重要候选蛋白. 故我们选取了毒素B羧基末端CDB3(氨基酸1751-2366)进行克隆与表达, 为以后的疫苗和抗原鉴定的研究建立基础.
1.1.1 菌株与质粒: 用于本实验的C difficile VPI10463从兰州生物制品研究所购买. 大肠杆菌菌株BL21(DE3)及质粒PET22b(+)系南方医科大学消化研究所存.
1.1.2 工具酶:EcoRI与XhoI限制性核酸内切酶, T4DNAligase酶均为New England Biolab公司产品.
1.1.3 试剂: 厌氧发生剂、脑心浸液(干粉)购自生物梅里埃公司(BioMerieux). 细菌基因组DNA提取试剂盒、PCR扩增试剂盒购自北京赛百胜生物制品公司, 琼脂糖、DNA Marker4由天为时代生物科技公司提供, 质粒小量提取试剂盒、DNA凝胶回收试剂盒、IPTG、SDS-PAGE低分子质量标准蛋白质购自上海博彩生物科技有限公司. 引物合成及PCR产物、重组质粒测序由上海博亚生物科技公司完成. 其他试剂为国产分析纯.
1.2.1 C d: ifficile标准株的培养:C difficile VPI 10463接种于脑心浸液(BHI)培养基中, 传种后按5%接种于含有生理盐水的透析袋内, 置BHI培养基中37℃厌氧环境中透析培养72 h.
1.2.2 细菌基因组DNA和质粒的提取: 分别采用细菌基因组DNA提取试剂盒与质粒小量提取试剂盒中的方法提取.
1.2.3 目的基因(CDB3)扩增: 参考GenBank收录的C difficile VPI 10463基因序列, 应用Omiga 2.0和primer 5.0设计引物, 并在其5'端加上合适的限制性核酸内切酶的酶切位点[7], 由上海博亚公司合成序列表1. 反应条件: 采用50 μL反应体系, 按照常规PCR条件进行扩增, 热启动法, 94℃变性45 s, 60℃退火60 s, 72℃延伸150 s, 39个循环后再延伸10 min.10 g/L琼脂糖凝胶电泳观察扩增结果. PCR产物送上海博亚生物科技公司测序. 目的基因DNA经EcoRI与XhoI双酶切, DNA凝胶回收试剂盒回收酶切片段.
| 正义链: | 5'-TCCGAATTCGCTTATGTCAACTAGTGAA-3', |
| EcoRI | |
| 反义链: | 5'-GCACTCGAGTTCACTAATCACTAATTG-3', |
| XhoI |
1.2.4 质粒PET22b(+)的酶切鉴定和纯化: 用EcoRI与XhoI限制性核酸内切酶对质粒进行双酶切后, 将酶切产物用10 g/L琼脂糖凝胶电泳, 计算产物条带分子质量, 然后用DNA凝胶回收试剂盒回收.
1.2.5 重组质粒的构建与鉴定: 将经酶切纯化的目的基因、质粒PET22b(+)按10: 1(摩尔数)进行连接, 反应体系为20 μL, 在T4 DNAligase酶作用下16℃连接12 h, 取100 μL常规方法制备的(大肠杆菌菌株BL21(DE3)感受态细胞, 加入10 μL的连接产物, 于冰上放置30 min, 于42℃水浴中热休克90 s, 置冰上5 min, 加入600 μL的SOC培养基, 37oC摇床上180次/min摇动1 h, 5 000 r/min离心1 min, 弃上清液约600 μL, 将细菌重悬后, 取100 uL培养物涂于含氨苄青霉素(100 mg/L)LB固体培养基平皿中, 37℃孵育约16 h. 挑取单个菌落, 接种在含氨苄青霉素(100 mg/L)LB液体培养基中, 37℃摇床上200次/min摇菌致A600值达0.6, 然后提取重组质粒. 重组质粒的鉴定: 将重组质粒用EcoRI与XhoI双酶切鉴定; 以重组质粒为模板, 用前述已合成的引物进行PCR反应; 重组质粒送上海博亚生物科技公司测序.
1.2.6 目的基因表达: 将经过鉴定的阳性克隆菌落接种到2 mLLB培养液(含200 mg/L氨苄青霉素)中37℃摇床上180 次/min摇菌8 h致A600值达0.6, 4℃过夜, 然后按2%转接至(含200 mg/L氨苄青霉素)LB培养液中, 继续培养3 h至A600值为0.8, 加IPTG至终浓度为1 mmol/L, 诱导后按1 h间隔, 进行取样, 共取样4次.
1.2.7 基因表达产物的SDS-PAGE分析: 将菌液样品2 mL 5 000 r/min离心, 5 min, 用500 μL的PBS将细菌重悬后, 加入同等量的2XSDS-PAGE样品缓冲液, 于100℃水浴5 min, 10 000 g离心, 10 min, 取上清加样. 采用5 g/L的浓缩胶和8 g/L的分离胶, 电泳2.5 h. 凝胶用考马斯亮兰R250染色.
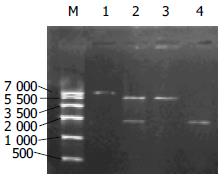
C difficile细胞毒素B基因经PCR扩增结果电泳分析发现在1 800 bp左右有一条带, 大小与预计相符(图1).
将PCR产物经EcoRI与XhoI双酶切后, 定向插入经同样双酶切的PET22b(+)载体中, 获得重组质粒命名为PET22b(+)CDB3. 重组质粒经EcoRI与XhoI双酶切后电泳初步鉴定结果与预期相符. 直接以重组质粒PET22b(+)CDB3为模板进行测序, 得到了克隆片段的DNA序列, 与GenBank记录的C difficile VPI10463的ToxinB3基因序列的同源性为99%.
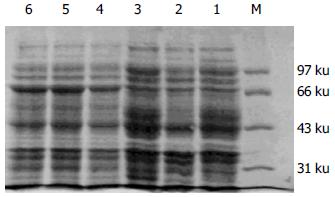
阳性克隆子在IPTG的诱导下, 表达出的蛋白相对分子质量为71.3 ku, 与预期的蛋白大小一致(图2), 凝胶自动扫描分析, 其PET22b(+)CDB3重组蛋白占菌体总蛋白的34%, 其中分泌表达占周质总蛋白的22.7%, 可溶性表达占上清的14%, 包涵体占沉淀的82.7%.
目前, 在艰难梭菌相关性疾病(CDAD)的研究中发现, 难辨梭菌产毒株主要产生的两种外毒素: 毒素A(为分子质量308 ku的肠毒素), 毒素B(为分子质量270 ku的细胞毒素)[8]. 毒素A具有弱细胞毒作用, 毒素B有极强的细胞毒性, 为毒素A的10倍. 动物模型已证明毒素A与B就是导致腹泻与肠炎症的原因, 多数的C difficile产毒株均可以合成这两种毒素, 而非产毒株艰难梭菌在临床上不具有致病性. 但在动物模型中, 毒素B必须在有小量的毒素A提前给予的情况下才具有致死性, 因为毒素A必须和肠上皮细胞刷状缘上的受体相结合才能改变肠黏膜上皮细胞的电阻抗, 进而改变其完整性, 从而导致上皮细胞膜破坏, 毒素B可进入肠上皮细胞, 然而长期没有发现人类毒素B的受体[9]. 故上世纪90年代初以前一直认为毒素B仅在毒素A损伤肠黏膜细胞基础上而致病, 因此对CDAD的诊断、预防的研究主要是针对C difficile 毒素A. 但近十多年来在一些大的综合性医院出现的爆发性的CDAD流行中, 经鉴定发现毒素A阴性而毒素B阳性的C difficile造成的, 证实以前观点是不正确的[10-11]. 近年的研究发现, 人肠黏膜细胞表面上, 葡萄糖基变位受体是毒素B的受体, 并据此假设毒素B无须毒素A先致人上皮细胞膜损害, 即可进入细胞, 并引起肠局限性炎症, 致中性粒细胞聚集以及从中性粒细胞、巨噬细胞释放炎症递质[12-13]. 分子生物学研究表明, 毒素B的氨基酸序列有3个显著结构: (1)位于毒素中央由疏水氨基酸组成并且具有高度保守性的序列, 起跨膜、转运的作用. (2)位于C端的重复序列, 起结合膜受体作用. (3)N端序列为毒素酶的作用及毒性作用区[14]. Fred et al分别克隆并在大肠杆菌内表达了毒素B基因的3个氨基酸片段aa1-900, aa901-1750, aa1751-2366, 发现毒素B酶活性作用和细胞毒性作用位于N'端. Genth et al[6]通过将毒素B分成3个片段CDB1、CDB2、CDB3, 发现抗毒素B抗体与CDB3可以发生强烈反应, 而与CDB1反应微弱, 抗C difficile抗体既与CDB1又能与CDB3反应, CDB2则与两抗体均不反应, 说明CDB3是良好的抗原. 进一步实验发现, 只有抗受体结合区域的抗体(抗CDB3抗体)才能保护完整细胞免受毒素B的细胞毒性攻击, 而抗接触反应区的抗体(抗CDB1抗体)只有进入细胞内才能起保护作用. 现有的研究表明, C difficile Toxin B3是一种理想的疫苗候选抗原.
目前, 在C difficile感染的诊断中, 传统实验室诊断的方法有细菌培养和组织培养检测毒素. 细菌培养敏感, 但时间长, 缺乏特异性. 组织培养敏感度、特异性都很高, 但是受设备与技术水平的限制. 而酶联免疫检测法则是缺乏组织培养条件的实验室首选方法, 可以与组织培养相媲美, 其优点是灵敏度和特异度高, 并且几乎接近组织培养, 快速、准确[15]. C difficile抗毒素B抗体与CDB3可以发生强烈反应, 故本研究为C difficile感染诊断抗原的研究也奠定了一定的基础.
我们参考C difficile国际标准株VPI 10463基因序列, 用自行设计的CDB3引物在PCR反应中表现出较高的特异性, 为理想的引物序列. 在上、下游引物中分别加入EcoRI与XhoI酶切位点, 保证了读码方向的正确性. 为便于下一步的表达和纯化工作又将其装入了末端带有His标签的融合表达载体, 酶切鉴定和测序结果显示获得了带有特异的C difficile CDB3基因. 蛋白电泳分析表明获得了高效表达的C difficileToxinB3克隆株, ToxinB3重组蛋白占菌体总蛋白的34%, 定位分析显示分泌表达占周质总蛋白的22.7%, 可溶性表达占上清的14%, 包涵体占沉淀的82.7%, 为进一步研究C difficile相关性疾病的诊断和免疫保护作用奠定了重要的实验基础.
编辑: 张海宁
| 1. | Bartlett J G. Clinical practice Antibiotic-associated diarrhea. N Engl J Med. 2002;346:334-339. [PubMed] |
| 2. | Kelly CP, Pothoulakis C, LaMont JT. Clostridium difficile colitis. N Engl J Med. 1994;330:257-262. [PubMed] |
| 3. | 齐 锡位, 刘 世琴, 许 晓. 抗生素相关性腹泻患者艰难梭菌的鉴定和敏感药物治疗. 第一军医大学分校学报. 2002;25:88. |
| 4. | Kink JA, Williams JA. Antibodies to recombinant Clostridium difficile toxin A and B are an effective treatment and prevent relapse of C. difficile associated disease in a hamster model of infection. Infect Immun. 1998;66:2018-2025. [PubMed] |
| 5. | Ward SJ, Douce G, Figueiredo D, Dougan G, Wren BW. Immunogenicity of a salmonella typhimurium aroA aroD vaccine expressing a nontoxic domain of Clostridium difficile toxin A. Infect Immun. 1999;67:2145-2152. [PubMed] |
| 6. | Genth H, Selzer J, Busch C, Dumbach J, Hofmann F, Aktories K, Just I. New Method to generate enzymatically deficient clostridium difficile toxin B as an antigen for immunization. Infect Immun. 2000;68:1094-1101. [PubMed] |
| 8. | von Eichel-Streiber C, Laufenberg-Feldmann R, Sartingen S, Schulze J, Sauerborn M. Comparative sequence analysis of the clostridium difficile toxins A and B. MolGen Genet. 1992;233:260-268. [PubMed] |
| 9. | Neunlist M, Barouk J, Michel K, Just I, Oreshkova T, Schemann M, Galmiche JP. Toxin B of Clostridium difficile activates human VIP submucosal neurons, in part via an IL-1beta-dependent pathway. Am J Physiol Gastrointest Liver Physiol. 2003;285:G1049-1055. [PubMed] |
| 10. | Moncrief JS, Zheng L, Neville LM, Lyerly DM. Genetic characterization of toxin A-negative, toxin B-positive Clostridium difficile isolates by PCR. J Clin Microbiol. 2000;38:3072-3075. [PubMed] |
| 11. | Limaye AP, Turgeon DK, Cookson BT, Fritsche TR. Pseudo-membranous colitis caused by a toxin A (-) B (+) strain of Clostridium difficile. J Clin Microbiol. 2000;38:1696-1697. [PubMed] |
| 12. | Mitty RD, LaMont JT. Clostridium difficile diarrhea: pathogenesis, epidemiology and treatment. Gastroenterologist. 1994;2:61-69. [PubMed] |
| 13. | Miller PD, Pothoulakis C, Baeker TR, LaMont JT, Rothstein TL. Macrophage-dependent stimulation of T cell depleted spleen cells by Clostridium difficile toxin A and calcium ionophore. Cell Immunol. 1990;126:155-163. [PubMed] |
| 14. | Hofmann F, Busch C, Prepens U, Just I, Aktories K. Localization of the Glucosyltransferase activity or Clostridium difficile Toxin B to the N-terminal part of the holotoxin. J Biol Chem. 1997;272:11074-11078. [PubMed] |
| 15. | Wilkins TD, Lyerly DM. Clostridium difficile testing: after 20 years, still challenging. J Clin Microbiol. 2003;41:531-534. [PubMed] |