修回日期: 2002-11-20
接受日期: 2002-11-29
在线出版日期: 2003-05-15
探讨长期应用大黄对结肠肌电、肠神经系统的影响.
建立大鼠"泻剂结肠"模型, 应用电生理、组化及免疫组化技术研究大黄对大鼠结肠动力、ENS多种神经递质及Cajal间质细胞(ICC)的影响.
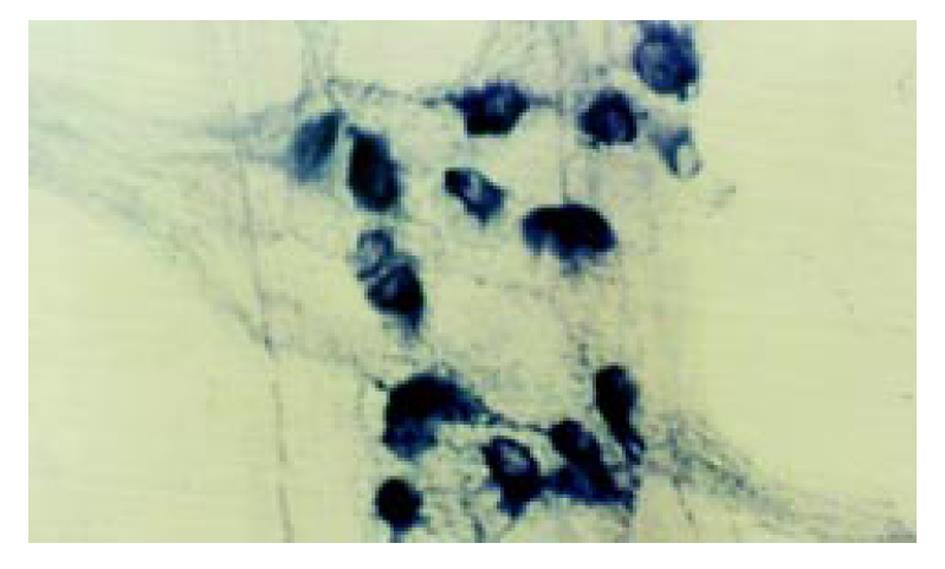
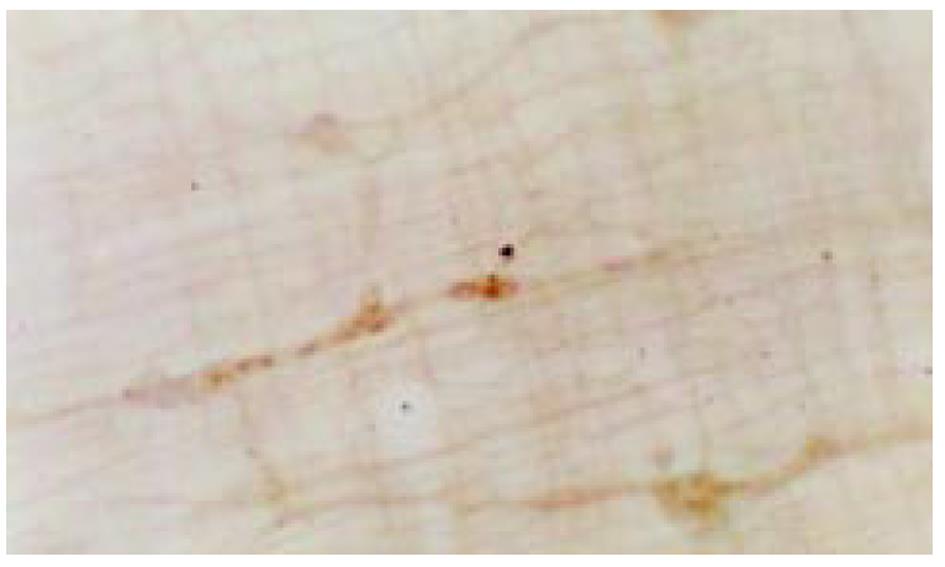
大鼠饲养大黄3 mo后, 结肠慢波频率减慢; 结肠肌间丛NADPH阳性神经细胞数目增多, AchE阳性神经细胞数目减少; NOS免疫反应性增强, SOM免疫反应性减弱; 肌间丛ICC分布不均匀, 突起连接杂乱.
长期应用大黄对结肠动力和ENS有损害作用, 在临床治疗顽固性便秘时应避免长期应用大黄等刺激性泻剂.
引文著录: 童卫东, 张胜本, 刘宝华, 张连阳, 黄显凯, 高峰. 大黄对大鼠结肠动力及肠神经系统的影响. 世界华人消化杂志 2003; 11(5): 665-667
Revised: November 20, 2002
Accepted: November 29, 2002
Published online: May 15, 2003
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2003; 11(5): 665-667
- URL: https://www.wjgnet.com/1009-3079/full/v11/i5/665.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i5.665
大黄是慢传输性便秘( slow transit constipation, STC)患者常用的一种泻剂, STC结肠动力和多种肠神经递质有异常变化, 但这些变化是否继发于长期服用大黄等刺激性泻剂争议较多[1].我们用大黄建立大鼠"泻剂结肠"模型, 用电生理、肌间神经丛铺片、免疫组化、碘化锌-锇酸(zinc iodide-osmic acid, ZIO)染色等方法, 检测结肠肌电、肠神经递质及Cajal间质细胞(interstitial cells of cajal, ICC)变化, 探讨大黄对结肠动力和肠神经系统(enteric nervous system, ENS)的影响及其可能机制.
成年Wistar大鼠32只随机分为对照组和大黄组, 每组16只.
1.2.1 模型建立 对照组饲以普通干饲料. 大黄组饲以含大黄饲料, 起始剂量为200 mg/(kg·d), 半数致泻剂量为1000 mg/(kg·d), 维持此剂量直到稀便消失, 再按200 mg/(kg·d)递增, 如此保持半数以上动物有下泻作用饲养3 mo, 最终调整剂量为2400 mg/(kg·d).
1.2.2 结肠肌电测定 禁食24 h, 在结肠近段(距盲肠约2 cm)安置一对银丝电极, 导线经切口引出连接胃肠电放大器.灵敏度2 mV/cm, 连续记录3 h左右.以5 min为一个时间段, 分别计算每个时间段的频率、振幅及变异系数.
1.2.3 结肠神经病理学研究 (1) 肌间丛铺片NADPH-d组织化学染色: 肌间神经丛铺片制作参照肖岚et al [2]肠道铺片法.配制作用液: 1.0 g/L β-NADPH diaphorase, 0.25 g/L NBT, 0.01 mol/L PBS pH 7.2). 将铺片标本37 ℃孵育30-40 min , PBS漂洗终止反应, 光镜观察. 对照实验于作用液中不加β-NADPH diaphorase. (2)肌间丛铺片乙酰胆碱酯酶(AchE)组化染色: 按照Karnovsky-Root[3]法配制作用液, 铺片入作用液中孵育90 min(37 ℃). 对照实验以10-4 mol/L毒扁豆碱代替异-OMPA. (3)NOS、SOM、5-HT免疫组织化学染色: 采用SP法, 按照试剂盒说明书操作. (4)碘化锌-锇酸(ZIO)染色: 作用液配制: 将20 g/L锇酸与30 g/L碘化锌1:3混合, 二者均新鲜配制, 新鲜混合. (5)图像分析: 在显微镜物镜放大倍数20×下, 视野摄入计算机(分辩率为512×476), 测量每个视野阳性染色区域的表面积密度, 即面密度.
统计学处理 数据以平均值北曜疾(x±s)表示, 采用Microsoft Excel 7.0进行单因素方差分析, 计数资料用二维列联表分析.
与对照组相比, 大黄组结肠慢波频率明显减慢, 慢波频率变异系数在25-30%之间, 振幅无明显变化, 振幅变异系数在45-50%之间(表1).
| 频率(次/5min) | 频率变异系数(%) | 振幅(mV/5min) | 振幅变异系数(%) | |
| 对照组 | 35.06±8.94 | 25.50 | 11.83±5.34 | 45.12 |
| 大黄组 | 27.07±7.87a | 29.07 | 13.41±6.16 | 45.94 |
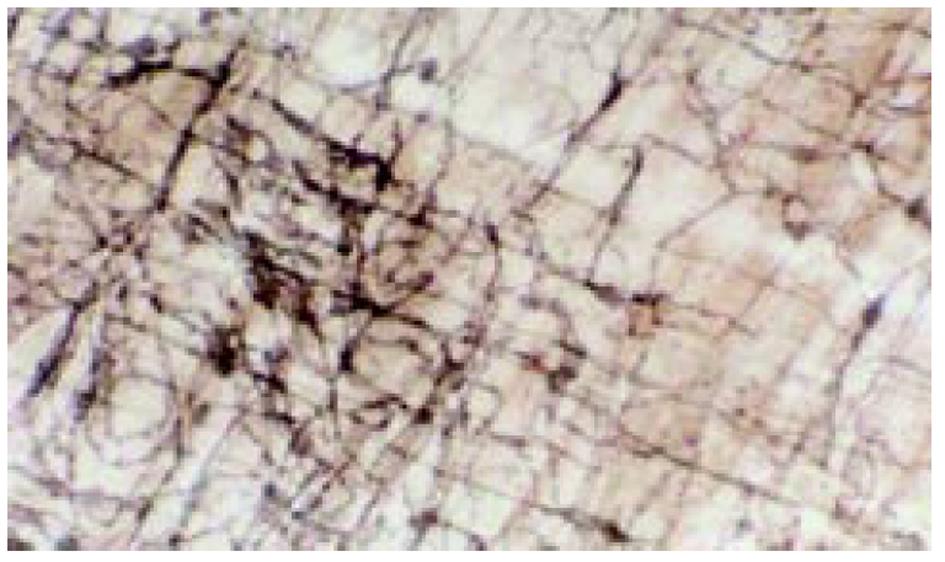
(1)肌间神经丛NADPH-d染色: 结肠肌间丛神经纤维纵横交错呈网状分布, 在100倍光镜下对阳性细胞计数, 每例随机选取10个神经节, 每组共100个神经节进行计数. 结果大黄组阳性细胞数明显高于对照组(图1). (2)肌间神经丛铺片AchE组化染色: 肌间丛神经节细胞及纤维呈棕红色. 对神经节阳性细胞计数, 与对照组相比, 大黄组阳性细胞在结肠近段和远段均明显减少, 大黄组仅在结肠近段明显减少(图2). (3)NOS、SOM、5-HT免疫组化染色: 大黄组肌间丛NOS免疫反应性明显增强, SOM免疫反应性降低, 而5-HT免疫反应性无明显变化(表2). (4)ZIO染色: 对照组ICC突起相互连接形成网络, ICC分布比较均匀; 而大黄组ICC分布极不均匀, 有的视野ICC密集, 突起连接杂乱, 有的视野ICC稀少, 突起不能相互连接形成网络(图3). 高倍镜观察ICC的形态, 实验组与对照组无明显差别.
1973年, Smith[4]报道"泻剂结肠"结肠的主要病理特征包括: 肌间丛嗜银性神经元数目减少, 平滑肌层变薄, 结肠黏膜黑变. 近年的研究发现"泻剂结肠"ENS的多种神经递质含量或分布异常, 但争议较多[5,6]. 本研究没有发现结肠扩张、黏膜黑变和平滑肌萎缩等改变, 但存在ENS神经递质分布和含量的异常, 与文献报道一致. 我们认为, "泻剂结肠"是指长期应用刺激性泻剂造成结肠ENS紊乱和相应的功能失调, 导致结肠动力障碍, 对泻剂反应性下降, 使患者对泻剂产生依赖性的一种状况.
Frieri et al [7]报道长期服用泻剂的便秘患者结肠慢波频率较对照组升高(P<0.05), 提示慢波异常与结肠动力障碍有关, 但这种改变是服用泻剂引起的还是该病固有的肌电异常不能确定. 为此, 有人测定了饲以番泻叶6 mo的大鼠结肠在体肌电未发现异常[8]. 我们发现结肠慢波频率减慢, 提示长期大剂量应用大黄影响结肠慢波的产生或传导, 与文献报道不同. 造成结果差异的原因可能与文献中的泻剂用量较小, 10-40 mg/(kg·d), 恒定剂量饲养, 不符合STC患者泻剂用量越用越大的过程有关.
本研究发现饲养大黄3 mo可导致大鼠结肠NOS免疫反应性增强. NADPH-d组化染色与免疫组化的结果一致. Izzo et al[9]报道芦荟(含蒽醌)的致泻作用依赖内源性NOS的调解, 提示NO在"泻剂结肠"的病理生理机制中起重要作用. 结肠AchE阳性神经元数目减少, 提示Ach合成或释放减少. Ach的释放与ENS其他神经递质密切相关, 神经肽Y和内源性NO可抑制Ach释放, 蛙皮素、SOM、降钙素基因相关肽及某些5-HT受体激动剂可促使Ach释放, 而Ach又可促进VIP的释放[10]. 目前尚不能明确在这种作用中是否存在反馈调节机制, Ach含量的异常变化是泻剂的直接作用, 还是肠壁内NO含量增多后的继发反应有待进一步研究.
SOM对肠道运动有抑制作用. Tzavella et al[11]报道大剂量蒽醌500 mg/(kg·d)饲养大鼠6 mo后, 放免法测定结肠壁神经肽含量发现SOM含量明显下降. 我们的结果表明应用大黄3 mo, 大鼠结肠肌间丛SOM免疫反应性降低, 与Tzavella结果一致. 而Kiernan et al[12]观察了饲养番泻叶5 mo的大鼠未发现SOM异常, 这种结果的不同可能与其所用泻剂剂量较小有关, 剂量为95 mg/(kg·d).
Kiernan未发现"泻剂结肠"5-HT免疫反应异常. 我们发现黏膜层免疫阳性反应有增强的表现, 可能与肠黏膜分泌功能增强有关. 从神经免疫生理学的角度来看, 黏膜干细胞释放的5-HT也可通过某种方式作用于神经丛的特异性受体从而发挥调节作用, 因此"泻剂结肠"黏膜层5-HT含量的增多很可能与ENS其他递质的变化有内在联系.
ICC对胃肠动力有重要的调控作用[13]. 一方面ICC可能是胃肠道慢波的起搏者(pacemaker cells), 另一方面ICC可能参与了NANC神经信息传递过程[14]. 有报道Hirschsprung's病及慢性特发性假性肠梗阻之病变肠段缺乏c-kit免疫反应阳性细胞, 提示ICC发育不良或数目减少与胃肠动力紊乱性疾病的发病有关[15]. 最近有报道STC患者结肠壁内ICC减少可能与其发病有关[16]. 目前未见有关"泻剂结肠"ICC变化的报道. 我们发现大黄组肌间丛ICC分布不均匀, ICC密集区域其突起相互连接杂乱无章, 而ICC稀少区域则无明显的网络形成. 既然ICC是肠道慢波的起搏者, 其突起形成的网络可能与慢波的传播有关, 推测大鼠"泻剂结肠"结肠肌间丛ICC分布和网络的杂乱性与慢波频率减慢有关.
| 1. | Knowles CH, Martin JE. Slow transit constipation: a model of human gut dysmotility. Review of possible aetiologies. Neurogastroenterol Motil. 2000;12:181-196. [PubMed] [DOI] |
| 4. | Smith B. Pathologic changes in the colon produced by anthraqvinone purgatives. Dis Colon Rectum. 1973;16:455-458. [DOI] |
| 5. | Krishnamurthy S, Schuffler MD, Rohrmann CA, Pope CE. Severe idiopathic constipation is associated with a distinctive abnormality of the colonic myenteric plexus. Gastroenterology. 1985;88:26-34. [DOI] |
| 6. | Xing JH, Soffer EE. Adverse effects of laxatives. Dis Colon Rectum. 2001;44:1201-1209. [PubMed] [DOI] |
| 7. | Frieri G, Parisi F, Corazziari E, Caprilli R. Colonic electromyography in chronic constipation. Gastroenterology. 1983;84:737-740. [PubMed] |
| 8. | Fioramonti J, Dupuy C, Bueno L. In vivo motility of rat colon chronically pretreated with sennosides. Pharmacology. 1993;47:155-161. [PubMed] [DOI] |
| 9. | Izzo AA, Sautebin L, Borrelli F, Longo R, Capasso F. The role of nitric oxide in aloe-induced diarrhoea in the rat. Eur J Pharmacol. 1999;386:43-48. [DOI] |
| 11. | Tzavella K, Schenkirsch G, Riepl RL, Odenthal KP, Leng-Peschlow E, Muller-Lissner SA. Effects of long-term treatment with anthranoids and sodium picosulphate on the contents of vasoactive intestinal polypeptide, somatostatin and substance P in the rat colon. Eur J Gastroenterol Hepatol. 1995;7:13-20. |
| 12. | Kiernan JA, Heinicke EA. Sennosides do not kill myenteric neurons in the colon of the rat or mouse. Neuroscience. 1989;30:837-842. [DOI] |
| 15. | Vanderwinden JM, Rumessen JJ. Interstitial cells of Cajal in human gut and gastrointestinal disease. Microsc Res Tech. 1999;47:344-360. [DOI] |
| 16. | He CL, Burgart L, Wang L, Pemberton J, Young-Fadok T, Szurszewski J, Farrugia G. Decreased interstitial cell of Cajal volume in patients with-slow transit constipation. Gastroenterology. 2000;118:14-21. [DOI] |