修回日期: 2002-09-30
接受日期: 2002-10-12
在线出版日期: 2003-05-15
构建含Hp热休克蛋白60 (Hsp60)基因的重组载体并在大肠杆菌BL21(DE3)中表达, 为进一步研究Hsp60的佐剂功能和免疫原性奠定基础.
提取Hp染色体基因, 用PCR方法扩增Hsp60基因, 将其克隆至表达载体pET-22b(+), 转化大肠杆菌BL21(DE3), IPTG诱导表达并通过免疫印迹实验研究其免疫原性.
分离得到了1.6 kb的Hsp60基因片段, 并在大肠杆菌中实现了该基因的高效表达, 在37 ℃诱导表达3 h后, 表达产物占细菌总蛋白的27.2%. 表达以可溶性蛋白和包涵体两种形式存在, 其中主要是包涵体的形式, 目的蛋白占不溶性蛋白的76.6%. 经免疫印迹证实该重组蛋白可以被Hp感染患者血清所识别.
成功地克隆并表达Hp Hsp60基因, 为Hp疫苗的研制打下了基础.
引文著录: 白杨, 黄文, 林焕健, 王继德, 陈烨, 张兆山, 周殿元, 张亚历. 表达幽门螺杆菌热休克蛋白60克隆的构建. 世界华人消化杂志 2003; 11(5): 547-550
Revised: September 30, 2002
Accepted: October 12, 2002
Published online: May 15, 2003
To construct a recombinant vector containing gene encoding Hsp60 gene of Helicobacter pylori and to express the vector in E.coli BL21.
The Hsp60 gene was amplified from H.pylori chromosome by PCR and inserted into the prokaryotie expression vector pET-22b (+). The recombinant vector was transformed and expressed in E.coli BL21 (DE3). Recombinant Hsp60 protein immunogenicity was studied by Western blot.
The 1.6 kb Hsp60 gene was successfully isolated. Recombinant E.coli strains expressed Hsp60 were obtained, the expression protein amounted to 27.2% of the total bacterial protein after induced with IPTG for 3 h at 37 ℃, which included inclusion body and soluble protein. Inclusion body was the major pattern of the expression that amounted to 76.6% of the insoluble protein. Western blot analysis of rHsp60 confirmed that it could be specially recognized by serum from Hp infected patients.
The gene coding for Hp Hsp60 is cloned and expressed successfully. The results obtained lay the foundation for constructing the H.pylori vaccine.
- Citation: Bai Y, Huang W, Lin HJ, Wang JD, Chen Y, Zhang ZS, Zhou DY, Zhang YL. Construction of clone expressing adhesin Hsp60 of Helicobacter pylori. Shijie Huaren Xiaohua Zazhi 2003; 11(5): 547-550
- URL: https://www.wjgnet.com/1009-3079/full/v11/i5/547.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i5.547
幽门螺杆菌(Helicobacter pylori, Hp)已被确认是慢性胃病(包括胃炎和消化性溃疡)的主要病原因子[1-7], 同时与胃腺癌、胃黏膜相关淋巴组织淋巴瘤的发生亦密切相关[8-20]. WHO已将其列为胃癌等肿瘤发生的相关致病菌[21]. 此外, 血清流行病学研究表明Hp感染与循环、呼吸以及自身免疫疾病的发生也有关[22-24]. 我国是Hp高感染率国家, 并仍以每年1-2%的速度增加[25]. 目前临床根除Hp的主要手段是抗菌疗法, 但有相当的局限性. 根除某种感染性疾病最有效的方法是疫苗接种, 故Hp疫苗的研制是目前的热点[26-29]. 已知在小鼠和人类的分枝杆菌感染模型中, Hsp60的免疫应答处于优先地位, HpHsp60也许是防治Hp的疫苗候选成分. 据此, 我们对HpHsp60基因进行了克隆和表达, 为构建Hp基因工程疫苗打下了基础.
菌株大肠杆菌BL21(DE3)、质粒pET-22b(+)及HpSS1为本所保存. 限制性内切酶Not I, Nco I及T4DNA聚合酶、Vent DNA聚合酶购自New England Biolabs公司, Taq DNA聚合酶、DNA分子质量标准λDNA/EcoR I +Hind Ⅲ购自华美生物工程公司, 琼脂糖、dNTPs、DNA快速纯化试剂盒购自Promega公司, 测序质粒纯化试剂盒购自德国Qiagen公司, Hp感染患者血清来自本院内镜中心, 其他试剂为国产分析纯.
收集Hp菌液1 ml或刮取数环菌落, TE(pH8.0)洗涤后重悬, 加SDS至终浓度为10 g/L, 蛋白酶K至终浓度0.1 g/L, 55-60 ℃水浴30 min, 分别用等体积酚: 氯仿: 异戊醇(25:24:1)、氯仿∶异戊醇(24:1)各抽提1次, 上层水相加2.5倍预冷的无水乙醇, 1/10体积3 mol/L乙酸钠沉淀, 700 mL/L乙醇洗2 次, 抽干后溶于dd H2O或TE中. 根据文献[30]设计引物, 在其5'端加上合适的限制性酶切位点, 由博亚公司合成. 序列如下: Hsp601: 5'-TG GCC ATG GAT GGG CCA AGA GGC AGG AAT-3'; Hsp602: 5'-AG TGC GGC CGC CAT CAT GCC GCC CAT G-3'. 热启动法进行PCR, 95 ℃变性30 s, 55 ℃退火50 s, 72 ℃延伸90 s, 35个循环后再延伸10 min. 8 g/L琼脂糖凝胶电泳观察扩增结果.
1.2.1 重组质粒构建、酶切鉴定及序列 采用碱变性法制备质粒pET-22b(+). 目的基因与载体的连接: 反应体系20 ?L中依次加入10×Not I缓冲液, Not I和Nco I各10 U, 目的DNA片断2 μL或pET-22b(+)1 μg, 补足水至20 μL, 37 ℃水浴2 h. 采用冻融法回收及纯化酶切产物. 在连接反应体积10 μL中加入目的DNA与载体DNA的浓度约为2:1, 10×连接缓冲液1 μL , T4 DNA 连接酶1 U, 16 ℃水浴4-12 h. BL21(DE3)感受态细胞的制备: 从LB平板上挑取BL21(DE3)单菌落接种于LB液体培养基5 mL中, 37 ℃培养过夜, 将上述菌液以1%接种量转接于5 ml LB液体培养基, 37 ℃, 150 r/min振摇1.5-2 h, 至A600约为0.3-0.4; 培养物冰浴10 min, 4 000 g离心10 min, 菌体悬浮于冰预冷的0.1 mol/L CaCl2 2.5 mL中, 混匀, 冰浴30 min, 离心后用冰预冷的CaCl2 0.3 mL重悬菌体, 分装0.15 mL/管备用. 转化: 取连接产物8-10 μL加入感受态细菌150 μL中, 冰浴30 min, 42 ℃热休克2 min后置冰上2 min, 加入LB液体培养基800 μL, 37 ℃摇床复苏45 min. 取菌液200 μL, 在含氨苄青霉素的LB平板上涂布均匀, 37 ℃培养12-16 h. 次日挑选单个菌落, 提取质粒进行酶切鉴定. 对酶切鉴定后重组自采用373A DNA自动分析仪进行全自动测序.
1.2.2 重组子的诱导表达及表达产物的定位分析 不同条件下的诱导表达: 经测序鉴定正确的重组子转化BL21(DE3), 以10 g/L的过夜培养物接种LB液体培养基, 在不同的诱导前菌浓度(A600分别为0.1, 0.3, 0.45, 0.6, 0.8, 1.0)下, 以不同的IPTG浓度(0.1, 0.5, 1.0, 2.0 mmol/L)诱导不同的时间(2 h, 3 h, 4 h, 5 h), 分别收集菌液1 mL进行电泳, 测定不同条件下重组蛋白的表达量. 表达产物的定位: 外周质部分在4 ℃, 12000 g离心1 min收集IPTG诱导培养物, 将细菌沉淀悬于30 mmol/L Tris-Cl(pH8.0), 1 mmol/L EDTA(pH8.0), 200 g/L蔗糖中, 冰浴10 min, 12000 g离心10 min, 上清为外周质部分; 胞内可溶和包涵体部分同上收集IPTG诱导培养物, 弃上清, 重悬沉淀于1/10培养物体积的50 mmol/L Tris-Cl(pH8.0)、2 mmol/L EDTA和0.1 mg/ml溶菌酶中, 并加TritonX-100至终浓度10 g/L, 30 ℃放置20 min后冰浴下超声破碎至溶液较清亮, 12000 g, 4 ℃离心15 min, 上清为可溶性部分, 沉淀为包涵体. 取全菌及其周质的渗透休克液、菌体超声后的上清以及沉淀进行100 g/L SDS-PAGE电泳分析, 上样前加适量双蒸水复悬菌体后加入等体积2×凝胶上样缓冲液(40 g/LSDS、2 g/L溴酚兰、200 mL/L甘油、100 mmol/L Tris-Cl pH6.8、100 g/L β-巯基乙醇), 混匀, 100 ℃水浴10 min, 冷却后取8-10 μL上样, 180V恒压电泳至溴酚兰到达凝胶底部, 取下凝胶置于考马斯亮兰(R250)染色液(45%甲醇、45%水、10%冰乙酸、0.25%考马斯亮兰R250)中染色1-2 h.
1.2.3 免疫印迹分析 SDS-PAGE电泳结束后将凝胶用转移缓冲液(39 mmol/L甘氨酸, 48 mmol/L Tris-Cl, 0.37 g/L SDS, 150 g/L甲醇)漂洗, 同时剪取与凝胶大小一致的滤纸和PVDF膜, PVDF膜在甲醇中浸泡1 min后与滤纸一起放入转移缓冲液中平衡15 min; 将3张滤纸、凝胶、PVDF膜、另3张滤纸逐层放入凝胶夹夹紧, 置转移槽中30 V, 150 mA转移约1.5 h; 取出PVDF膜, 50 g/L脱脂奶封闭过夜, TBST缓冲液(100 mmol/L Tris-Cl, 9 g/L NaCl、5 g/L Tween 20)室温下漂洗3次, 每次10 min; 用Hp感染血清(封闭液1: 50稀释)为一抗, 室温孵育2 h; 羊抗人IgG-HRP(封闭液1:200稀释)为二抗, 室温孵育1 h, 漂洗后加入底物溶液(0.05 mmol/L Tris-Cl pH7.4, 0.5 mol/L NaCl, 0.6 g/L DAB、2 mL/LH2O2)室温下显色, 待显色适度时以2 mol/L H2SO4 终止, 水漂洗后阴干.
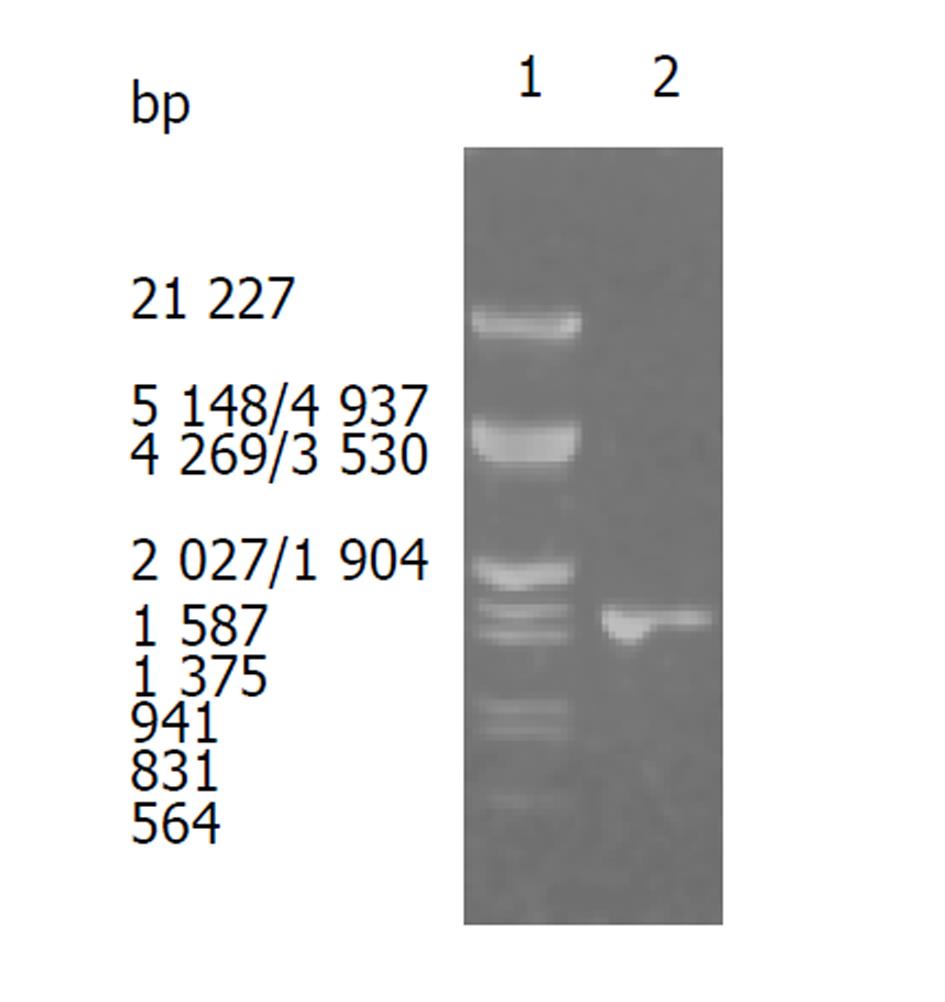
两条PCR引物合成时5'端分别加上Not I和Nco I酶切位点以方便操作.为提高PCR的特异性, 扩增时采用了热启动法, 并以具3:5修复作用的Vent酶代替常规使用的Taq酶. PCR结果电泳分析发现在1600 bp左右有一条带, 大小与预计相符(图1). 将PCR产物经Not I和Nco I双酶切后, 定向插入经同样双酶切的pET-22b(+)载体中, 获得重组质粒命名为pET-22b(+)/Hsp60. 重组质粒pET-22b(+)/Hsp60经Not I、Nco I双酶切鉴定结果与预计相符. 直接以重组质粒pET-22b(+)/Hsp60为模板进行测序, 得到了克隆片段的DNA序列, 与基因库公布的一致.
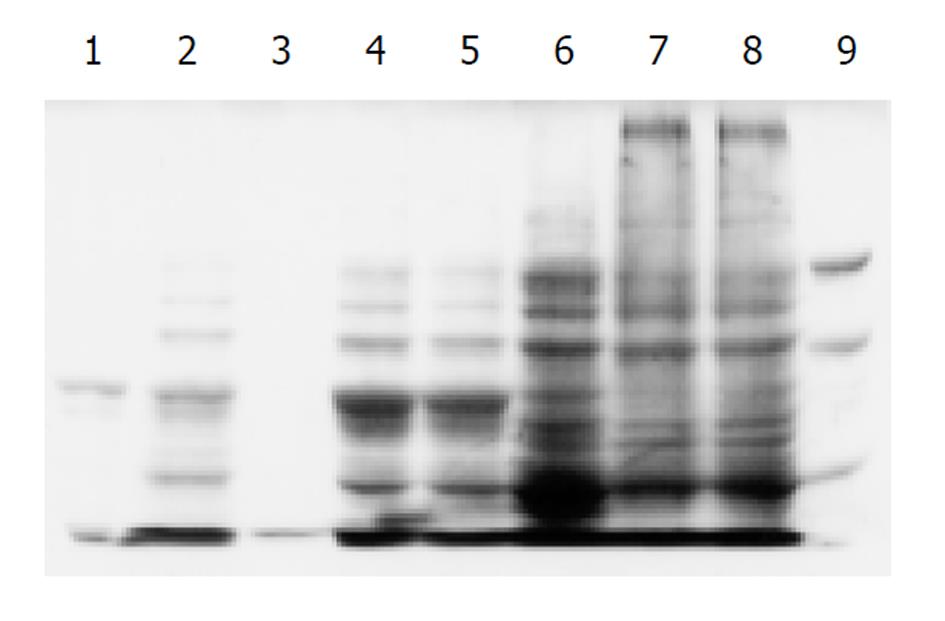
将鉴定正确的阳性克隆株在LB培养液(含100 mg/L氨苄青霉素)中37 ℃培养过夜, 然后按1%转接至含氨苄青霉素的LB培养液中, 其后在不同条件下进行诱导表达.取全菌及其周质的渗透休克液和菌体超声后的沉淀和上清进行100 g/LSDS-PAGE电泳分析(图2). 结果发现, 经诱导后高效表达Mr 60000的外源蛋白, 与预期分子大小一致. 凝胶自动扫描分析, 在A600值为0.6, IPTG终浓度为0.1 mmol/L, 诱导表达3 h时Hsp60表达量有明显提高, 占菌体总蛋白的27.2%, 其中可溶性表达占上清的14.7%, 包涵体部分占沉淀的76.6%.
用Hp阳性患者血清作为一抗, 正常人血清作为对照, 在Mr60000处出现1条阳性反应带; 而正常人血清对照未见任何条带.
在Hp疫苗的研制中, 已经采用的基因重组抗原包括尿素酶、细胞空泡毒素、过氧化氢酶等, 尽管获得了不同程度的保护作用[31-36], 但仍不理想. 特别是尿素酶作为Hp最有希望的一种保护性抗原, 虽然在动物模型中已取得理想的效果, 但在作为Hp自然宿主的人体上的免疫保护效果尚不令人满意[37,38]. 这一方面是由于作为黏膜佐剂的CT或LT存在毒副作用, 影响了他在人体中的应用, 另一方面也可能是由于尿素酶单一抗原尚不能起到全面保护的效果.未来的方向应该考虑采用更多的保护性抗原, 同时找到更有效和安全的刺激机体产生黏膜免疫应答的方法. 近来研究表明, 当人或动物受到细菌和寄生虫感染时, 病原体来源的Hsp是一种非常重要的保护性抗原, 到目前为止, 已经报道了20多种传染病的保护性免疫应答是针对Hsp的, 如结核、麻风等, 其中对Hsp60的免疫应答最多. 尤其是在感染结核的小鼠实验模型中, Hsp60的特异性抗体可与原核细胞的Hsp60相应物产生交叉反应, 而不与小鼠自身的Hsp60相应物反应, 这解决了长期以来困扰人们的Hsp60作为疫苗成分由于其高度保守性所引起的自身免疫问题. 此外, 在小鼠和猴疟疾模型中, 与Hsp60交联的多肽诱导的抗疟疾特异性免疫应答并不依赖于佐剂, 显示了Hsp60具有类似佐剂的作用. 由此将Hp Hsp60纳入Hp疫苗成分, 有可能解决尿素酶在人体实验中出现的问题, 即作为佐剂解决了CT或LT作为佐剂价格昂贵和具有潜在毒性的缺点, 作为抗原解决单一尿素酶保护效果不理想的问题. 因此, 我们克隆了该基因, 并使该基因在大肠杆菌中获得了高效表达, 其表达量超过了菌体总蛋白的1/4. 在此基础上, 本研究还对重组Hsp60蛋白的表达进行了定位分析, 为大规模工业生产奠定了基础. 为了便于纯化, 我们采用了带有6个组氨酸的融合表达载体pET-22b(+), 外源氨基酸仅占重组蛋白的1%, 通常不影响重组蛋白的免疫原性, 免疫印迹实验表明其能够与Hp感染患者血清发生特异性反应, 进一步证明了重组Hsp60蛋白氮端融合的6个组氨酸并不影响其抗原性. 总之, 本研究为Hp基因工程亚单位疫苗和多价疫苗的研制打下了基础.
| 2. | Meyer JM, Silliman NP, Dixon CA, Siepman NY, Sugg JE, Hopkins RJ. Helicobacter pylori and early duodenal ulcer status post-treatment: a review. Helicobacter. 2001;6:84-92. [PubMed] [DOI] |
| 3. | Xia HX, Fan XG, Talley J. Clarithromycin resistance in Helicobacter pylori and its clinical relevance. World J Gastroenterol. 1999;5:263-266. [PubMed] [DOI] |
| 5. | Vandenplas Y. Helicobacter pylori infection. World J Gastroenterol. 2000;6:20-31. [DOI] |
| 6. | Casella G, Buda CA, Maisano R, Schiavo M, Perego D, Baldini V. Complete regression of primary gastric MALT-lymphoma after double eradication Helicobacter pylori therapy: role and importance of endoscopic ultrasonography. Anticancer Res. 2001;21:1499-1502. [PubMed] |
| 7. | Kate V, Ananthakrishnan N, Badrinath S. Effect of Helicobacter pylori eradication on the ulcer recurrence rate aftersimple closure of perforated duodenal ulcer: retrospective and prospective randomized controlled studies. Br J Surg. 2001;88:1054-1058. [PubMed] [DOI] |
| 8. | 郭 长青, 王 玉萍, 刘 国永, 马 社旺, 丁 贯一, 李 继昌. 胃黏膜癌变过程中幽门螺杆菌感染与P53、 c-erbB-2基因表达的研究. 世界华人消化杂志. 1999;7:313-315. |
| 9. | Hiyama T, Haruma K, Kitadai Y, Masuda H, Miyamoto M, Ito M, Kamada T, Tanaka S, Uemura N, Yoshihara M. Clinicopathological features of gastric mucosa-associated lymphoid tissue lymphoma: a comparison with diffuse large B-cell lymphoma without a mucosa-associated lymphoid tissue lymphoma component. J Gastroenterol Hepatol. 2001;16:734-739. [PubMed] [DOI] |
| 11. | Delchier JC, Lamarque D, Levy M, Tkoub EM, Copie-Bergman C, Deforges L, Chaumette MT, Haioun C. Helicobacter pylori and gastric lymphoma: high seroprevalence of CagA in diffuse large B-cell lymphoma but not in low-grade lymphoma of mucosa-associated lymphoid tissue type. Am J Gastroenterol. 2001;96:2324-2328. [PubMed] [DOI] |
| 12. | Morgner A, Miehlke S, Fischbach W, Schmitt W, Muller-Hermelink H, Greiner A, Thiede C, Schetelig J, Neubauer A, Stolte M. Complete remission of primary high-grade B-cell gastric lymphoma after cure of Helicobacter pylori infection. J Clin Oncol. 2001;19:2041-2048. [PubMed] [DOI] |
| 14. | Nakamura S, Matsumoto T, Suekane H, Takeshita M, Hizawa K, Kawasaki M, Yao T, Tsuneyoshi M, Iida M, Fujishima M. Predictive value of endoscopic ultrasonography for regression of gastric low grade and high grade MALT lymphomas after eradication of Helicobacter pylori. Gut. 2001;48:454-460. [DOI] |
| 15. | Uemura N, Okamoto S, Yamamoto S, Matsumura N, Yamaguchi S, Yamakido M, Taniyama K, Sasaki N, Schlemper RJ. Helicobacter pylori infection and the development of gastric cancer. N Engl J Med. 2001;345:784-789. [PubMed] [DOI] |
| 17. | Kate V, Ananthakrishnan N, Badrinath S. Effect of Helicobacter pylori eradication on the ulcer recurrence rate aftersimple closure of perforated duodenal ulcer: retrospective and prospective randomized controlled studies. Br J Surg. 2001;88:1054-1058. [PubMed] [DOI] |
| 18. | Gao HJ, Yu LZ, Bai JF, Peng YS, Sun G, Zhao HL, Miu K, L XZ, Zhang XY, Zhao ZQ. Multiple genetic alterations and behavior of cellular biology in gastric cancer and other gastric mucosal lesions: H. pylori infection, histological types and staging. World J Gastroenterol. 2000;6:848-854. [PubMed] [DOI] |
| 21. | Suganuma M, Kurusu M, Okabe S, Sueoka N, Yoshida M, Wakatsuki Y, Fujiki H. Helicobacter pylori membrane protein 1: a new carcinogenic factor of Helicobacter pylori. Cancer Res. 2001;61:6356-6359. [PubMed] |
| 22. | Gocyk W, Niklinski T, Olechnowicz H. Helicobacter pylori, gastrin and cyclooxygenase-2 in lung cancer. Med Sci Monit. 2000;6:1085-1092. [PubMed] |
| 23. | Tsai CJ, Huang TY. Relation of Helicobacter pylori infection and angiographically demonstrated coronary artery disease. Dig Dis Sci. 2000;45:1227-1232. [PubMed] [DOI] |
| 24. | Dauden E, Jimenez AI, Garcia DA. Helicobacter pylori and idiopathic chronic urticaria. Int J Dermatol. 2000;39:446-452. [PubMed] [DOI] |
| 26. | Lee MH, Roussel Y, Wilks M, Tabaqchali S. Expression of Helicobacter pylori urease subunit B gene in Lactococcus lactis MG1363 and its use as a vaccine delivery system against H. pylori infection in mice. Vaccine. 2001;19:3927-3935. [DOI] |
| 27. | Kleanthous H, Tibbitts TJ, Gray HL, Myers GA, Lee CK, Ermak TH, Monath TP. Sterilizing immunity against experimental Helicobacter pylori infection is challenge-strain dependent. Vaccine. 2001;19:4883-4895. [DOI] |
| 29. | Koesling J, Lucas B, Develioglou L, Aebischer T, Meyer TF. Vaccination of mice with live recombinant salmonella typhimurium aroa against H.pylori: parameters associated with prophylactic and therapeutic vaccine efficacy. Vaccine. 2001;20:413-420. [DOI] |
| 30. | Yamaguchi H, Osaki T, Kai M. Immune response against a cross-reactive epitope on the heat shock protein 60 homologue of Helicobacter pylori. Infect Immun. 2000;68:3448-3454. |
| 32. | Keenan J, Oliaro J, Domigan N, Potter H, Aitken G, Allardyce R, Roake J. Immune response to an 18-kilodalton outer membrane antigen identifies Lipoprotien 20 as a Helicobacter pylori vaccine candidate. Infect Immun. 2000;68:3337-3343. [DOI] |
| 33. | Ikewaki J, Nishizono A, Goto T, Fujioka T, Mifune K. Therapeutic oral vaccination induces mucosal immune response sufficient to eliminate long-term Helicobacter pylori infection. Microbiol Immunol. 2000;44:29-39. [DOI] |
| 34. | Jiang Z, Tao XH, Huang AL, Wang PL. A study of recombinant protective H. pylori antigens. World J Gastroenterol. 2002;8:308-311. [PubMed] [DOI] |
| 37. | Kotloff KL, Sztein MB, Wasserman SS, Losonsky GA, Di-Lorenzo SC, Walker RI. Safety and immunogenicity of oral inactivated whole-cell Helicobacter pylori vaccine with adjuvant among volunteers with or without subclinical infection. Infect Immun. 2001;69:3581-3590. [PubMed] [DOI] |
| 38. | Michetti P, Kreiss C, Kotloff K, Porta N, Blanco JL, Bachmann D, Herranz M, Saldinger P, Corthesy-Theulaz I, Losonsky G. Oral immunization with urease and escherichia coli heat-labile enterotoxin is safe and immunogenic in Helicobacter pylori-infected adults. Gastroenterology. 1999;116:804-812. [DOI] |