修回日期: 2002-11-05
接受日期: 2002-11-20
在线出版日期: 2003-02-15
目的: 了解金属蛋白酶组织抑制因子-1(TIMP-1)在正常及实验性肝纤维化大鼠肝组织中的定位及表达状态.
方法: 用人血白蛋白免疫攻击的方法制备实验性免疫性肝纤维化大鼠模型, 以正常大鼠为对照. 采用免疫组化法及原位杂交技术分别检测肝脏中TIMP-1 mRNA和相关抗原表达, 同时用PCR技术检测肝脏中TIMP-1基因水平.
结果: 实验组肝脏中TIMP-1相关抗原表达在肌成纤维细胞、成纤维细胞, 以汇管区及纤维间隔中最明显, 阳性信号位于细胞胞质中, 未见细胞核表达. 原位杂交检测结果也展示了上述相同的分布和定位. 正常大鼠肝组织中可见TIMP-1基因表达, 但表达水平极低. 实验组肝组织中TIMP-1呈高水平表达.
结论: 在肝纤维化中, 成纤维细胞及肌成纤维细胞是TIMP表达的主要细胞. 随着病损肝脏中肝纤维化程度的加重, TIMP-1基因表达水平随之增高.
引文著录: 聂青和, 谢玉梅, 周永兴, 程勇前, 罗红, 罗新栋. 正常及实验性肝纤维化大鼠肝脏中的金属蛋白酶组织抑制因子-1. 世界华人消化杂志 2003; 11(2): 204-208
Revised: November 5, 2002
Accepted: November 20, 2002
Published online: February 15, 2003
AIM: To investigate the expression of TIMP-1 in normal and experimental fibrotic livers in rats.
METHODS: Hepatic fibrosis rat models were induced with human serum albumin, and normal rats were used as control. TIMP-1 mRNA and its related antigens in liver were examined with immunohistochemistry and in situ hybridization. Expression of TIMP-1 gene was detected with PCR.
RESULTS: The positive signal of TIMP-1 proteins was mainly located in cytoplasm rather than nucleus in hepatic myofibroblasts and fibroblasts, which dominated in portal areas and fibrous septums fibrotic rats. Such distribution of expression of TIMP-1 detected with immunohistochemistry was consistent with that in situ hybridization. The level of TIMP-1 expression in fibrotic rats was obviously higher than that in normal ones.
CONCLUSION: TIMP-1 was expressed dominantly in fibroblast and myofibroblast in fibrotic liver, the expression level increased with progression of liver injury and severity of hepatic fibrosis.
- Citation: Nie QH, Xie YM, Zhou YX, Cheng YQ, Luo H, Luo XD. Expression of TIMP-1 in normal and fibrotic livers in rats. Shijie Huaren Xiaohua Zazhi 2003; 11(2): 204-208
- URL: https://www.wjgnet.com/1009-3079/full/v11/i2/204.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i2.204
肝硬化是严重危害人类健康的常见病之一, 其病理学基础是肝纤维化, 后者是各种损肝因素(如病毒性肝炎等)所致慢性肝病发展为肝硬化的必经病理过程[1-5]. 肝纤维化的主要病理变化就是肝细胞外基质(ECM)在肝脏中过多沉积[6-10]. 目前研究表明, 肝脏ECM的代谢主要由基质金属蛋白酶(MMPs)所调节, MMPs促进ECM的降解, 而TIMPs通过抑制MMPs阻止ECM的降解, 从而形成和促进肝纤维化[11-13]. 但在正常和纤维化肝脏中由哪些细胞表达和合成TIMP-1目前的认识还不尽-致. 为此, 我们应用TIMP-1单克隆抗体(McAb)为试剂, 采用免疫组织化学法, 同时应用TIMP-1 cDNA探针为试剂采用检测正常及实验性肝纤维化大鼠肝脏中TIMPs相关抗原和mRNA的定位及表达状态. 鉴于TIMP-1在肝纤维化形成机制中的重要地位我们还应用PCR技术对其肝脏中TIMP-1基因表达水平进行研究, 现报告如下.
Wistar大鼠♀, 体重120-150 g, 40只(购自本校动物中心). 参照王宝恩et al人应用的人血白蛋白免疫攻击的方法制备大鼠实验性免疫性肝纤维化模型[14], 抗大鼠IgG单克隆抗体购自法国Coulter公司. 同等条件下饲养正常Wistar大鼠20只做正常对照组. 具体选模过程如下: 将人血白蛋白(购自卫生部兰州生物制品研究所)用无菌生理盐水稀释, 与等量的不完全福氏佐剂(Sigma产品)乳化, 每只大鼠皮下多点注射, 每次注射0.5 mL(内含人血白蛋白4 mg), 共4次, 前2次间隔14 d, 第3、4次间隔10 d. 末次免疫后10 d取血测抗体, 取抗体阳性大鼠作实验. 尾静脉攻击注射人血白蛋白, 2次/wk. 第1周 2.5 mg/只, 以后再次攻击增加0.5 mg, 直至4.5 mg. 维持此量2 mo. 所有动物麻醉后处死取肝脏标本, -部分置于液氮中, -部分置于10%甲醛中固定统-备检, -部分置于戊二醛中固定电镜观察之用.
1.2.1 免疫组化染色: 具体实验操作参照我们既往开展的SP法免疫组化染色法[15-17]. 鼠抗TIMP-1 McAb购自美国Maxim生物技术公司, 产品编号为MAB-0282.主要步骤: (1)石蜡包埋4 mm连续切片, 脱蜡至水后; (2)抗原修复; (3)加10%正常血清封闭20 min; (4)加TIMP-1或TIMP-2 McAb(-抗) 4℃过夜; (5)加生物素二抗37℃, 恒温30-40 min; (6)加亲和素-过氧化酶溶液37℃, 20 min; (7)加DAB显色10 min; (8)苏木素复染, 酒精脱水, 二甲苯透明, 树胶封片, 镜检并照像记录.
1.2.2 免疫组化对照实验: 为保证实验结果的可靠性, 特别是免疫组织化学的特异性, 本实验采用省略-抗和二抗, 分别用兔血清和磷酸盐缓冲液代替-抗. 另设10例正常肝组织做对照.
1.2.3 图像分析: 每-玻片任选5个视野, 自动检测阳性细胞面密度, 取其平均值, 进行统计分析. 利用本校统计学教研室的统计程序包进行方差分析.
1.3.1 肝组织原位杂交: 具体实验操作参照我们既往开展的地高辛素标记探针原位杂交法[18-20]. TIMP-1原位杂交试剂盒购自武汉博士德生物工程有限公司, 试剂号MK1 549.基本步骤为石蜡包埋4 um连续切片, 80℃烤片后, 二甲苯脱蜡, 酒精逐级水化, 盐酸酸化30 min, 30%过氧化氢3 mL封闭10 min, 加蛋白酶K消化30 min, 酒精逐级脱水固定, 37℃-40℃水浴箱内预杂交2 h; 将TIMP-1或TIMP-2 cDNA探针95℃ 10 min变性后迅速放入-20℃的冰箱内10 min, 滴加在经过预杂交处理的肝组织切片上, 置37℃水浴箱内过夜, 依次用2×SSC、1×SSC、0.2×SSC等洗片, 滴加BuffⅠ缓冲液, 滴加封闭液, 室温20 min, 滴加兔抗地高辛, 37℃、60 min, 滴加生物素化羊抗兔, 37℃、30 min, 滴加SABC, 37℃、30 min, DAB显色, 苏木素复染, 酒精脱水, 二甲苯透明, 封片, 镜检并照相记录.
1.3.2 图像结果判定: 原位杂交法半定量判断指标: 未见阳性细胞(-); 阳性细胞占肝小叶部分肝细胞的1/3以下(+); 1/3-2/3为(++); 2/3以上为(+++).
1.3.3 原位杂交特异性确证实验: (1)空白对照: 以预杂交液替代TIMP-1和TIMP-2 cDNA探针对阳性肝组织切片进行杂交. (2)阴性对照: 用TIMP-1和TIMP-2 cDNA探针对10例正常肝组织进行原位杂交试验.
1.4.1 TIMP-1 PCR引物序列: 见表1.
| 引物 | 核苷酸序列 | 产物位置(bp) |
| TIMP-1 正义链 | 5'-TTCGTGGGGACACCAGAAGTC-3' | 482 |
| 反义链 | 5'-TATCTGGGACCGCAGGGACTG-3' | |
| b-actin 正义链 | 5'-GGAGAAGATGACCCAGATCA-3' | 234 |
| 反义链 | 5'-GATCTTCATGAGGTAGTCAG-3' |
1.4.2 PCR反应: 用Promega公司生产的Total RNA Isolation System提取肝组织总RNA. PCR反应体系为20 μl, 内含cDNA 2 μL, 10×buffer 2 μL, 4×dNTP(2 mM) 2 μL, TIMP-1、β-actin引物(10mM)各2 μL, Taq酶1 U超重水补至20 μl. 反应参数为: 97℃预变性2 min; 94℃变性30 s, 56℃退火30 s, 72℃延伸50 s, 30个循环; 最后72℃延伸7 min.
1.4.3 扩增产物定量分析: 取PCR扩增产物10 mL加入2%的琼脂糖凝胶孔中在TAE缓冲液50V, 电压电泳1 h, 溴化乙锭显色后成像定量分析, 用TIMP-1/β-actin比值表示TIMP-1表达水平.
常规HE染色观察肝组织学改变, Von Gieson、Masson胶原纤维特殊染色观察胶原增生情况等.
取正常及实验性肝纤维化大鼠新鲜肝脏, 戊二醛固定电镜检查.
统计学处理 数据用mean±SD表示. 利用本校统计学教研室的统计程序包行方差分析.
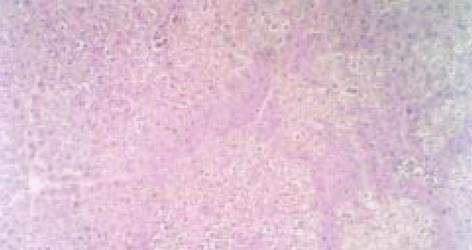
光镜下可见实验性肝纤维化大鼠肝组织中网状纤维及胶原纤维于汇管区增生, 且向外延伸. 同时, 于中央静脉周围增生并沿肝窦散在分布, 互相连结, 纤维结缔组织围绕肝小叶, 可见假小叶形成(图1). 并可在汇管区及中央静脉周围有炎性细胞浸润. 对照组肝脏呈正常结构.
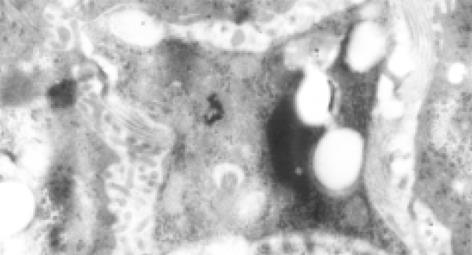
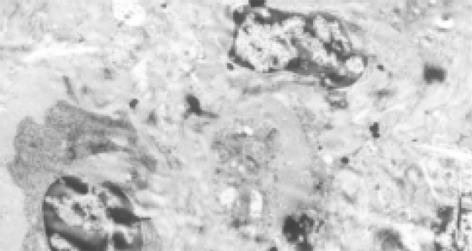
早期可见肝星状细胞(HSC)增生活跃, 内有丰富的粗面内质网和脂质, HSC周围可见较明显的胶原纤维(图2). 以后可见肌成纤维细胞形成, 分布于汇管区, 其周围有大量胶原沉积, 沉积的胶原形成较宽的分隔(图3). Disse间隙内大量胶原纤维沉积. 变性的肝细胞中可见大量肿胀的线粒体和少量脂滴.
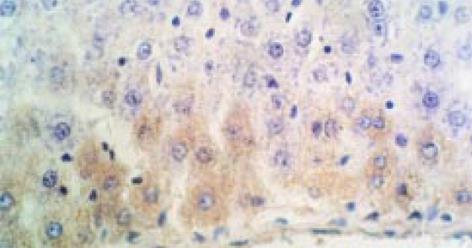
实验性肝纤维化大鼠肝脏中TIMP-1相关抗原表达在肌成纤维细胞、成纤维细胞、血管内皮细胞中, 以汇管区及纤维间隔中最明显. 阳性信号呈棕黄色颗粒状, 分布于上述细胞质内, 未见细胞核着色(图4). 正常大鼠肝脏仅在血管内皮细胞中有弱阳性表达. 图像分析显示实验组显著高于正常组(P<0.001), 见表2.原位杂交检测结果也展示了上述相同的分布及定位(图5).
| 组别 | n | TIMP-1 |
| 实验组 | 20 | 482.50±65.00 |
| 正常组 | 10 | 59.80±20.31 |
为保证免疫组化实验结果的可靠性, 本实验采用省略-抗和二抗, 分别用鼠血清和磷酸盐缓冲液代替. 检测结果均为阴性, 实验证实此免疫组化实验结果是特异的.
用预杂交液代替TIMP-1 cDNA探针杂交后, 结果为阴性.
选择和建立理想的动物模型是肝纤维化研究的必要条件之一, 因为可对其相关病因, 重要发病机制, 诊断条件的摸索以及研究行之有效的治疗方法并筛选评价抗肝纤维化药物均具有重要意义. 理想的动物模型应当是: (1)与人类疾病特征相似; (2)病变有-定发展过程, 即明显分期; (3)形成率高, 死亡率低; (4)造模方法简便易行; (5)动物易获得, 经济实用.
早在1960年代Paronetto和Popper就证明了免疫反应能引起肝损伤[21]. 抗原可用猪、牛、马血清, 猪血白蛋白, 血清球蛋白等反复注射, 5 wk引起肝纤维化, 10 wk引起肝硬化, 但由于过敏反应动物死亡率较高. 我们在国内王宝恩et al[14]介绍的实验性免疫性肝纤维化模型的基础上, 参考多种肝纤维动物模型成功的经验, 加以改良, 即在造模型过程中第1、2次尾静脉攻击时给大鼠注射小剂量地塞米松, 使造模过程中动物死亡率明显下降, 成功率提高. 病理学诊断为肝纤维化, 而且肝纤维化持续时间长达363 d. 此模型形式机制为白蛋白免疫复合物所致的Ⅲ型变态反应. 电镜所见提示上述病理过程激发了静止的肝星状细胞(HSC)增生, 并向肌成纤维细胞转化, 进而分泌大量胶原.
MMPs活性组织抑制物TIMPs, 广泛存在于许多组织中. 目前发现有4种TIMP, 仅有TIMP-1、TIMP-2存在于肝组织中, 他与活性MMPs以1: 1浓度结合形成复合体, 从而抑制MMPs的活性, 这种结合是不可逆转的[22-26]. TIMPs对MMPs的抑制活性, 由于MMPs的种类不同, 其敏感性存在着差异, 如TIMP-1对MMP-1、前MMP-9; TIMP-2对MMP-2、MMP-9、前MMP-2均显示出较强的抑制活性. 目前发现在病损肝脏中TIMP-1明显增高, 出现的时间较早, 幅度较大, 因此有较多学者把他看作是肝纤维化发生过程中一个非常重要的促发因素, TIMP-1通过对MMP-1等金属蛋白酶活性的抑制促进ECM的沉积, 其中TIMP-1较TIMP-2升高明显. 故而TIMP-1的高表达严重抑制了MMP而反映了肝纤维化的严重程度. 我们进行免疫组化观察发现实验性免疫性肝纤维化大鼠肝脏中仅肌成纤维细胞、成纤维细胞有TIMP-1蛋白的高表达, 以汇管区及纤维间隔中最明显. 而正常大鼠肝仅在血管内皮细胞中有弱阳性表达. 原位杂交检测结果-致.
1997年Roeb et al[27]通过原位杂交显示在CC14和胆管结扎大鼠肝损伤模型中, 肝细胞和几乎所有间质细胞均有TIMP-1 mRNA的表达, 以炎症区域中的脂肪样细胞中表达最明显. 而我们观察仅有肌成纤维细胞, 成纤维细胞, 血管内皮细胞中有TIMP-1 mRNA的高表达, 以汇管区及纤维间隔中最为明显, 免疫组化也展示了相同的结果. 这种差异的原因是动物模型不同所致, 还是其他什么因素, 有待进一步研究证实.
TIMP-1基因表达结果分析, 随着肝纤维化程度的加重, 肝组织TIMP-1基因表达水平增强, 这是由于TIMP基因表达增强, 抑制了MMP-1对胶原纤维的降解, 使胶原纤维在肝脏中不断沉积, 导致肝纤维化. TIMP-1基因表达增加, 其表达产物也相应增高, 其血清TIMP-1水平也相应发生改变. 1996年Iredale et al[28]从实验性肝纤维化肝脏中分离出肝细胞、肝星状细胞(HSC)、Kupffer细胞, 并行细胞总RNA的Northern杂交发现肝细胞并不表达TIMP-1 mRNA. 我们应用PCR技术检测大鼠肝脏中TIMP-1基因表达, 因取材为肝脏, 包含了肝细胞、HSC、Kupffer细胞等肝脏中存在的细胞群. 正常大鼠肝脏中TIMP-1基因水平表达水平较低, 而肝纤维化大鼠肝脏中TIMP-1基因呈高水平表达. 是否肝细胞不表达TIMP-1有待实验的进一步研究确证. 肝纤维化过程中TIMP-1表达明显增加, 且主要为成纤维细胞, 肌成纤维细胞产生, 这可能是激活HSC的结果, 肝纤维化实质上是慢性肝损伤的修复反应, 主要是由于细胞因子介导的细胞-细胞相互作用, 以及基质细胞相互作用引起的HSC激活, 反复的肝损伤引起HSC活化的持续. 因此, HSC的激活是肝纤维化过程中的主要病理过程. 有趣的是, 急性肝损伤并不引起肝纤维化. 体外实验也证实, 静止的HSC未见凋亡现象存在[29]. 这说明肝纤维化的发生机制较为复杂[30-38], 仍有不少问题有待进一步研究和阐明.
虽然MMPs、TIMPs与肝纤维化的发病机制密切相关, 但对TIMPs的研究只是刚刚开始, 肝纤维化时TIMP-1表达增强的机制尚不十分清楚, 仍有许多问题尚在探索之中[38-43]. 加强TIMPs的研究对肝纤维化的诊治及其发病机制的研究具有重要意义.
编辑: N/A
| 1. | Nie Q, Zhou Y, Xie Y. [Expression and significance of tissue inhibitors of metallproteinases-1 and -2 in serum and liver tissue of patients with liver cirrhosis]. Zhonghua Yi Xue Za Zhi. 2001;81:805-807. [PubMed] |
| 2. | George DK, Ramm GA, Walker NI, Powell LW, Crawford DH. Elevated serum type IV collagen: a sensitive indicator of the presence of cirrhosis in haemochromatosis. J Hepatol. 1999;31:47-52. [PubMed] [DOI] |
| 3. | Wang FS, Wu ZZ. Current situation in studies of gene therapy for liver cirrhosis and liver fibrosis. Shijie Huaren Xiaohua Zazhi. 2000;8:371-373. [DOI] |
| 4. | Arthur MJ, Mann DA, Iredale JP. Tissue inhibitors of metalloproteinases, hepatic stellate cells and liver fibrosis. J Gastroenterol Hepatol. 1998;13:S33-S38. [PubMed] [DOI] |
| 5. | Du WD, Zhang YE, Zhai WR, Zhou XM. Dynamic changes of type Ⅰ, Ⅲ and Ⅳ collagen synthesis and distribution of collagen producing cells in carbontetrachloride induced rat liver fibrosis. World J Gastroenterol. 1999;5:397-403. [PubMed] [DOI] |
| 6. | Arthur MJ, Iredale JP, Mann DA. Tissue inhibitors of metalloproteinases: role in liver fibrosis and alcoholic liver disease. Alcohol Clin Exp Res. 1999;23:940-943. [PubMed] [DOI] |
| 7. | Sakaida I, Uchida K, Hironaka K, Okita K. Prolyl 4-hydroxylase inhibitor (HOE 077) prevents TIMP-1 gene expression in rat liver fibrosis. J Gastroenterol. 1999;34:376-377. [PubMed] [DOI] |
| 8. | Murawaki Y, Ikuta Y, Idobe Y, Kawasaki H. Serum matrix metalloproteinase-1 in patients with chronic viral hepatitis. J Gastroenterol Hepatol. 1999;14:138-145. [PubMed] [DOI] |
| 9. | Zhu YH, Hu DR, Nie QH, Liu GD, Tan ZX. Study on activation and cfos, cjun expression of in vitro cultured human hepatic stellate cells. Shijie Huaren Xiaohua Zazhi. 2000;8:299-302. [DOI] |
| 10. | Kossakowska AE, Edwards DR, Lee SS, Urbanski LS, Stabbler AL, Zhang CL, Phillips BW, Zhang Y, Urbanski SJ. Altered balance between matrix metalloproteinases and their inhibitors in experimental biliary fibrosis. Am J Pathol. 1998;153:1895-1902. [PubMed] [DOI] |
| 11. | Nie QH, Cheng YQ, Xie YM, Zhou YX, Bai XG, Cao YZ. Methodologic research on TIMP-1, TIMP-2 detection as a new diagnostic index for hepatic fibrosis and its significance. World J Gastroenterol. 2002;8:282-287. [PubMed] [DOI] |
| 12. | Alcolado R, Arthur MIP, Iredale JP. Pathogensis of liver fibrosis. Clin Sci. 1997;92:103-112. [DOI] |
| 13. | Olaso E, Friedman SL. Molecular regulation of hepatic fibrogenesis. J Hepatol. 1998;29:836-842. [DOI] |
| 14. | Wang BE. [Animals with liver fibrosis induced by albumin immunization]. Zhonghua Yi Xue Za Zhi. 1989;69:503-505, 36. [PubMed] |
| 15. | Nie QH, Hu DR, Li MD, Xie Q. The expression of HGV/GBV-C or HCV related antigens in the liver tissue of patients coinfected with hepatitis C and G viruses. Shijie Huaren Xiaohua Zazhi. 2000;8:114-115. [DOI] |
| 16. | Nie QH, Li MD, Hu DR, Li L. The expression of hepatitis G virus-related antigens in the liver tissues of with hepatitis patients. Zhonghua Chuanranbing Zazhi. 2000;18:173-175. |
| 17. | Nie QH, Xie Q, Hu DR, Li MD, Li L. The expression of hepatitis G virus-related antigens in the liver tissue of patients with HGV/GBV-C infection. Di-san Junyi Daxue Xuebao. 1997;19:394-396. |
| 18. | Nie QH, Hu DR, Li MD, Li L, Zhu YH. Detection of hepatitis G virus RNA in liver tissue using digoxigenin labelled probe by in situ hybridization. Shijie Huaren Xiaohua Zazhi. 2000;8:771-774. [DOI] |
| 19. | Nie QH, Li L, Li MD, Hu DR, Zhu YH. Clinical and immunopathological study on GB virus B (GBV-B) infection. Shijie Huaren Xiaohua Zazhi. 2000;8:775-781. [DOI] |
| 20. | Nie QH, Li MD, Hu DR. Detection of GB virus C (GBV-C) RNA in liver tissue using digoxigenin labelled probe by in situ hybridization. J Gastroenterol Hepatol. 1999;14:A365. |
| 21. | Paronetto F, Popper H. Chronic liver injury induced by immunology reactions. Am J Pathol. 1966;40:1087-1094. |
| 22. | Iredale JP. Tissue inhibitors of metallproteinases in liver fibrosis. Int J Biochem Cell Biol. 1997;29:43-54. [DOI] |
| 23. | Torres L, García-Trevijano ER, Rodríguez JA, Carretero MV, Bustos M, Fernández E, Eguinoa E, Mato JM, Avila MA. Induction of TIMP-1 expression in rat hepatic stellate cells and hepatocytes: a new role for homocysteine in liver fibrosis. Biochim Biophys Acta. 1999;1455:12-22. [PubMed] [DOI] |
| 24. | Murawaki Y, Ikuta Y, Kawasaki H. Clinical usefulness of serum tissue inhibitor of metalloproteinases (TIMP)-2 assay in patients with chronic liver disease in comparison with serum TIMP-1. Clin Chim Acta. 1999;281:109-120. [PubMed] [DOI] |
| 25. | Kossakowska AE, Edwards DR, Lee SS, Urbanski LS, Stabbler AL, Zhang CL, Phillips BW, Zhang Y, Urbanski SJ. Altered balance between matrix metalloproteinases and their inhibitors in experimental biliary fibrosis. Am J Pathol. 1998;153:1895-1902. [PubMed] [DOI] |
| 26. | Nie QH, Cheng YQ, Xie YM, Zhou YX, Cao YZ. Inhibiting effect of antisense oligonucleotides phosphorthioate on gene expression of TIMP-1 in rat liver fibrosis. World J Gastroenterol. 2001;7:363-369. [PubMed] [DOI] |
| 27. | Roeb E, Purucker E, Breuer B, Nguyen H, Heinrich PC, Rose-John S, Matern S. TIMP expression in toxic and cholestatic liver injury in rat. J Hepatol. 1997;27:535-544. [PubMed] [DOI] |
| 28. | Iredale JP, Benyon RC, Arthur MJ, Ferris WF, Alcolado R, Winwood PJ, Clark N, Murphy G. Tissue inhibitor of metalloproteinase-1 messenger RNA expression is enhanced relative to interstitial collagenase messenger RNA in experimental liver injury and fibrosis. Hepatology. 1996;24:176-184. [PubMed] [DOI] |
| 29. | Pinari M, Marra F, Carloni V. Signal transduction in hepatic stellate cells. Liver. 1998;18:2-13. |
| 30. | Liu F, Liu JX, Cao ZC, Li BS, Zhao CY, Kong L, Zhen ZR. elationship between TGF b1, serum indexes of liver fibrosis and hepatic tissue pathology in patients with chronic liver diseases. Shijie Huaren Xiaohua Zazhi. 1999;7:519-521. [DOI] |
| 31. | Nie QH, Li MD, Hu DR, Chen GZ. Study on the cause of human protective immunodeficiency after HCV infection. Shijie Huaren Xiaohua Zazhi. 2000;8:28-30. [DOI] |
| 32. | Wu YA, Kong XT. Anti-hepatic fibrosis effect of pentoxifylling. Shijie Huaren Xiaohua Zazhi. 1999;7:265-266. [DOI] |
| 33. | Wang GQ, Kong XT. Action of cell factor and Decorin in tissue fibrosis. Shijie Huaren Xiaohua Zazhi. 2000;8:458-460. [DOI] |
| 34. | Liu F, Wang XM, Liu JX, Wei MX. Relationship between serum TGF b1 of chronic hepatitis B and hepatic tissue pathology and hepatic fibrosis quantity. Shijie Huaren Xiaohua Zazhi. 2000;8:528-531. [DOI] |
| 35. | Gu SW, Luo KX, Zhang L, Wu AH, He HT, Weng JY. Relationship between ductule proliferation and liver fibrosis of chronic liver disease. Shijie Huaren Xiaohua Zazhi. 1999;7:845-847. [DOI] |
| 36. | Wang Y, Gao Y, Huang YQ, Yu JL, Fang SG. Gelatinase A proenzyme expression in the process of experimental liver fibrosis. Shijie Huaren Xiaohua Zazhi. 2000;8:165-167. [DOI] |
| 37. | Yao XX. Diagnosis and treatment of liver fibrosis. Shijie Huaren Xiaohua Zazhi. 2000;8:681-689. [DOI] |
| 38. | Nie QH, Zhou YX, Xie YM. The localization and expression of TIMP-2 in experiment hepatic fibrosis in rat. Med J Chin PLA. 2002;27:208-209. |
| 39. | Herbst H, Wege T, Milani S, Pellegrini G, Orzechowski HD, Bechstein WO, Neuhaus P, Gressner AM, Schuppan D. Tissue inhibitor of metalloproteinase-1 and -2 RNA expression in rat and human liver fibrosis. Am J Pathol. 1997;150:1647-1659. [PubMed] |
| 40. | Knittel T, Mehde M, Grundmann A, Saile B, Scharf JG, Ramadori G. Expression of matrix metalloproteinases and their inhibitors during hepatic tissue repair in the rat. Histochem Cell Biol. 2000;113:443-453. [PubMed] |
| 41. | Yata Y, Takahara T, Furui K, Zhang LP, Watanabe A. Expression of matrix metalloproteinase-13 and tissue inhibitor of metalloproteinase-1 in acute liver injury. J Hepatol. 1999;30:419-424. [PubMed] [DOI] |
| 42. | Yata Y, Takahara T, Furui K, Zhang LP, Jin B, Watanabe A. Spatial distribution of tissue inhibitor of metalloproteinase-1 mRNA in chronic liver disease. J Hepatol. 1999;30:425-432. [PubMed] [DOI] |
| 43. | Dudás J, Kovalszky I, Gallai M, Nagy JO, Schaff Z, Knittel T, Mehde M, Neubauer K, Szalay F, Ramadori G. Expression of decorin, transforming growth factor-beta 1, tissue inhibitor metalloproteinase 1 and 2, and type IV collagenases in chronic hepatitis. Am J Clin Pathol. 2001;115:725-735. [PubMed] [DOI] |