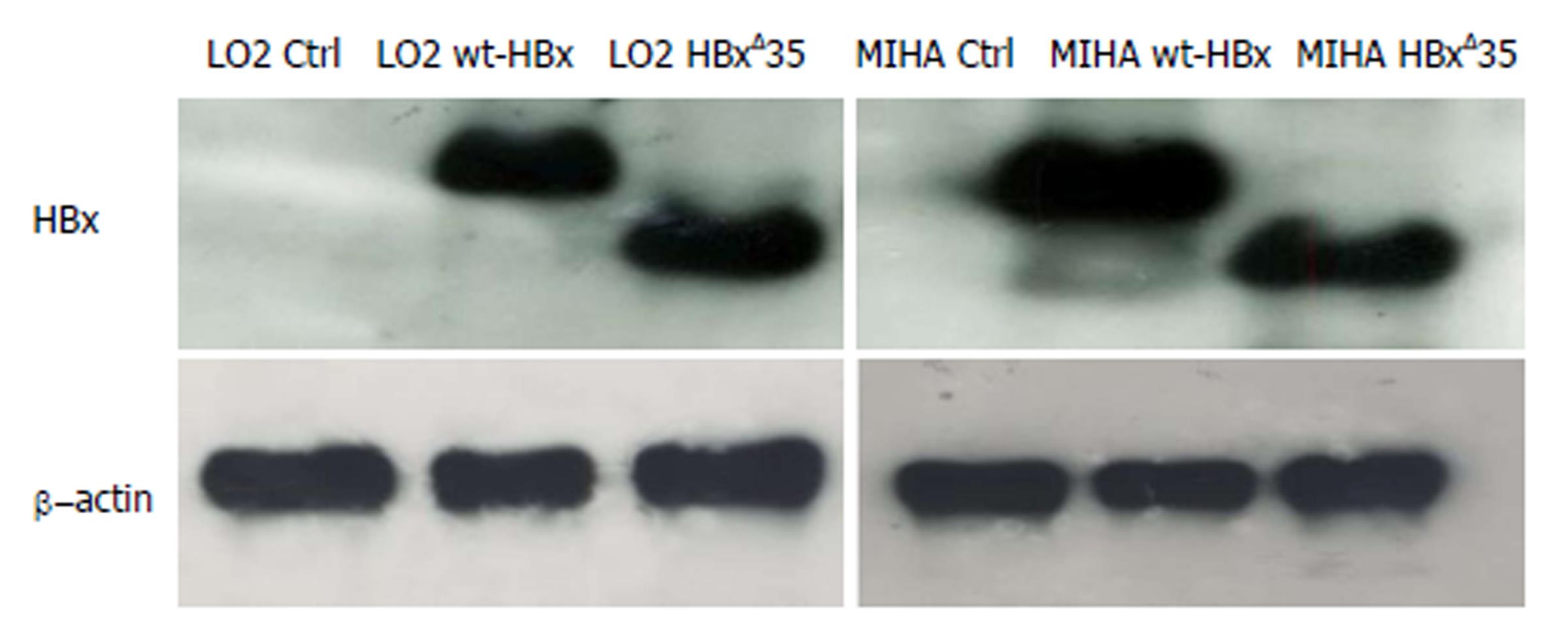
Copyright
©The Author(s) 2018.
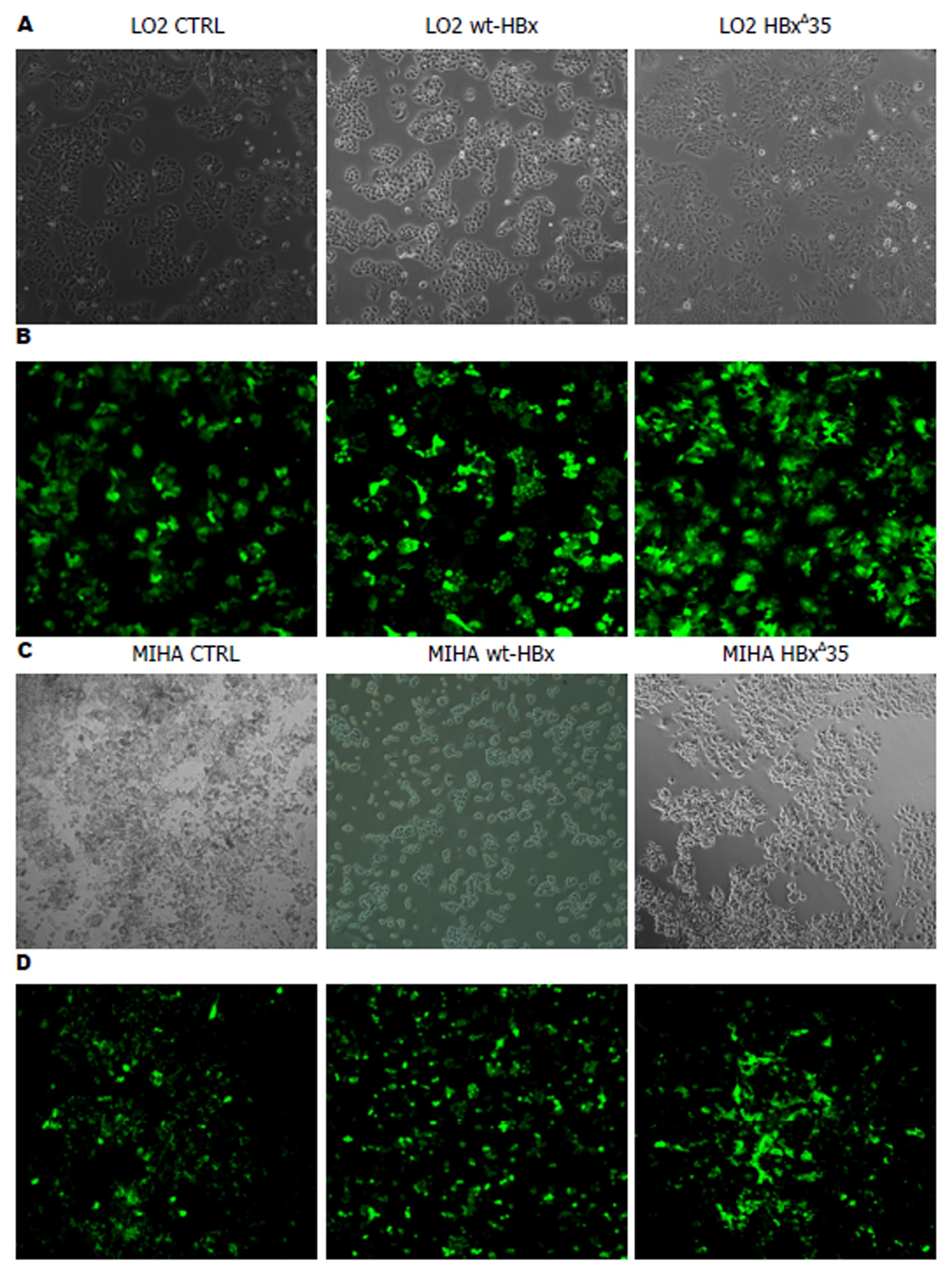
图1 重组慢病毒感染肝细胞LO2/MIHA感染效率的鉴定.
A: 重组慢病毒tHBxΔ35组, wt-HBx组, 对照组CTRL分别感染LO2在白光显微镜下; B: 重组慢病毒tHBxΔ35组, wt-HBx组, 对照组CTRL分别感染LO2在荧光显微镜下; C: 重组慢病毒tHBxΔ35组, wt-HBx组, 对照组CTRL分别感染MIHA在白光显微镜下; D: 重组慢病毒tHBxΔ35组, wt-HBx组, 对照组CTRL分别感染MIHA在荧光显微镜下.
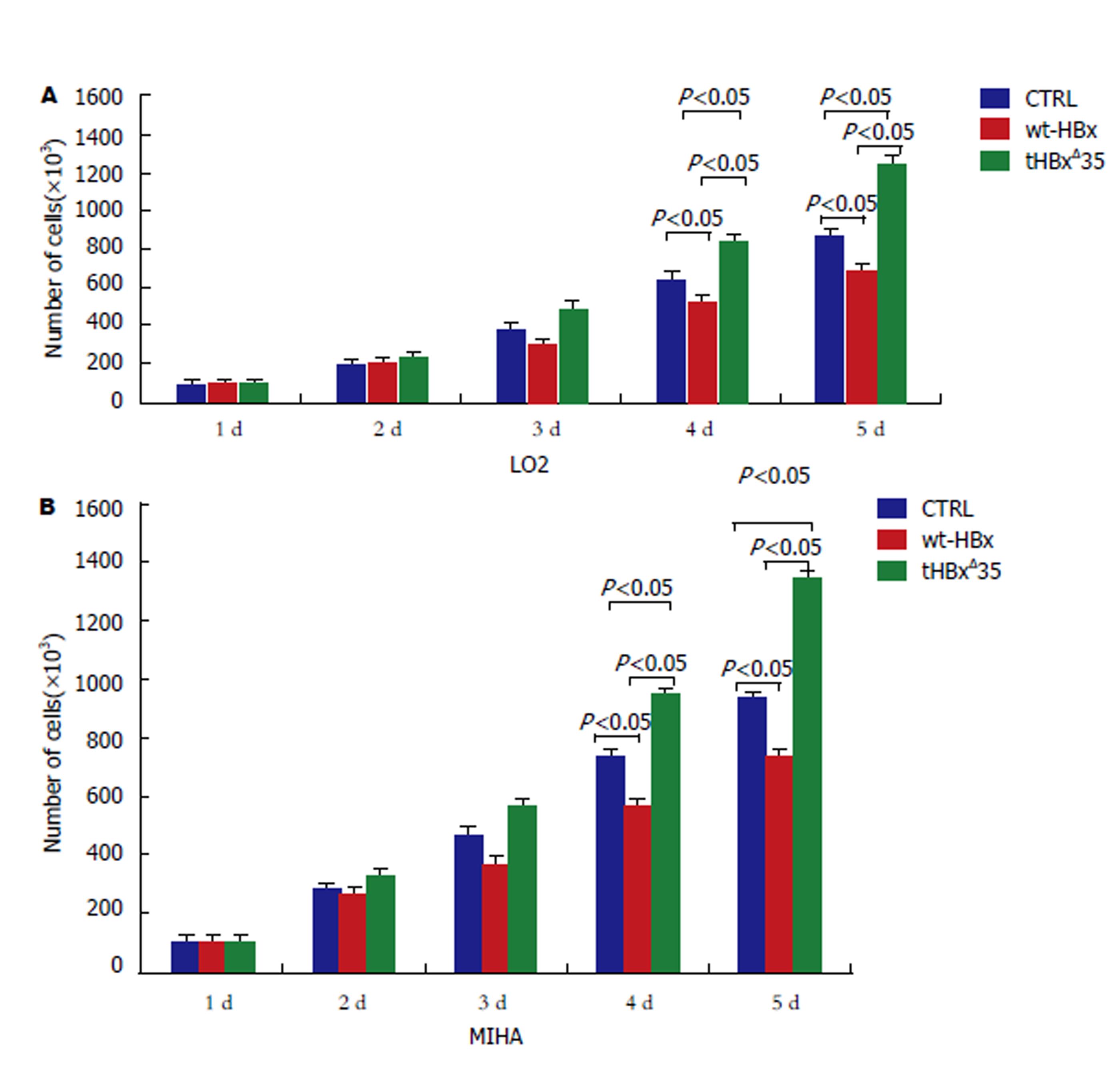
图3 tHBxΔ35和wt-HBx 基因在肝细胞的生长效应.
A: 重组慢病毒tHBxΔ35组, wt-HBx组, 对照组CTRL分别感染LO2时的生长情况; B重组慢病毒tHBxΔ35组, wt-HBx组, 对照组CTRL分别感染 MIHA时的生长情况.
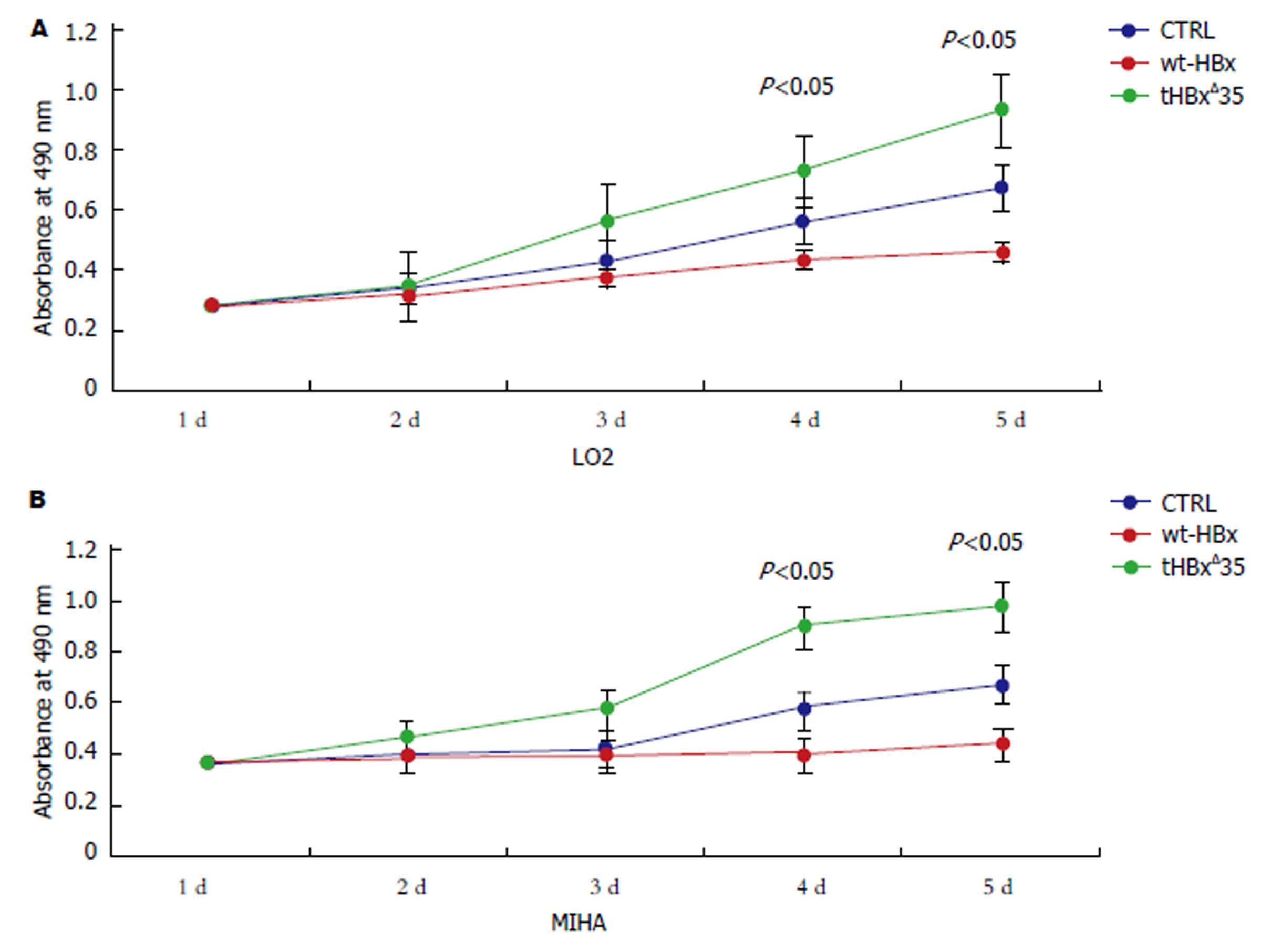
图4 MTS法检测重组慢病毒感染细胞的增殖性.
A: 示重组慢病毒tHBxΔ35组, wt-HBx组, 对照组CTRL分别感染LO2细胞的生长情况; B示重组慢病毒tHBxΔ35组, wt-HBx组, 对照组CTRL分别感染MIHA细胞的生长情况.
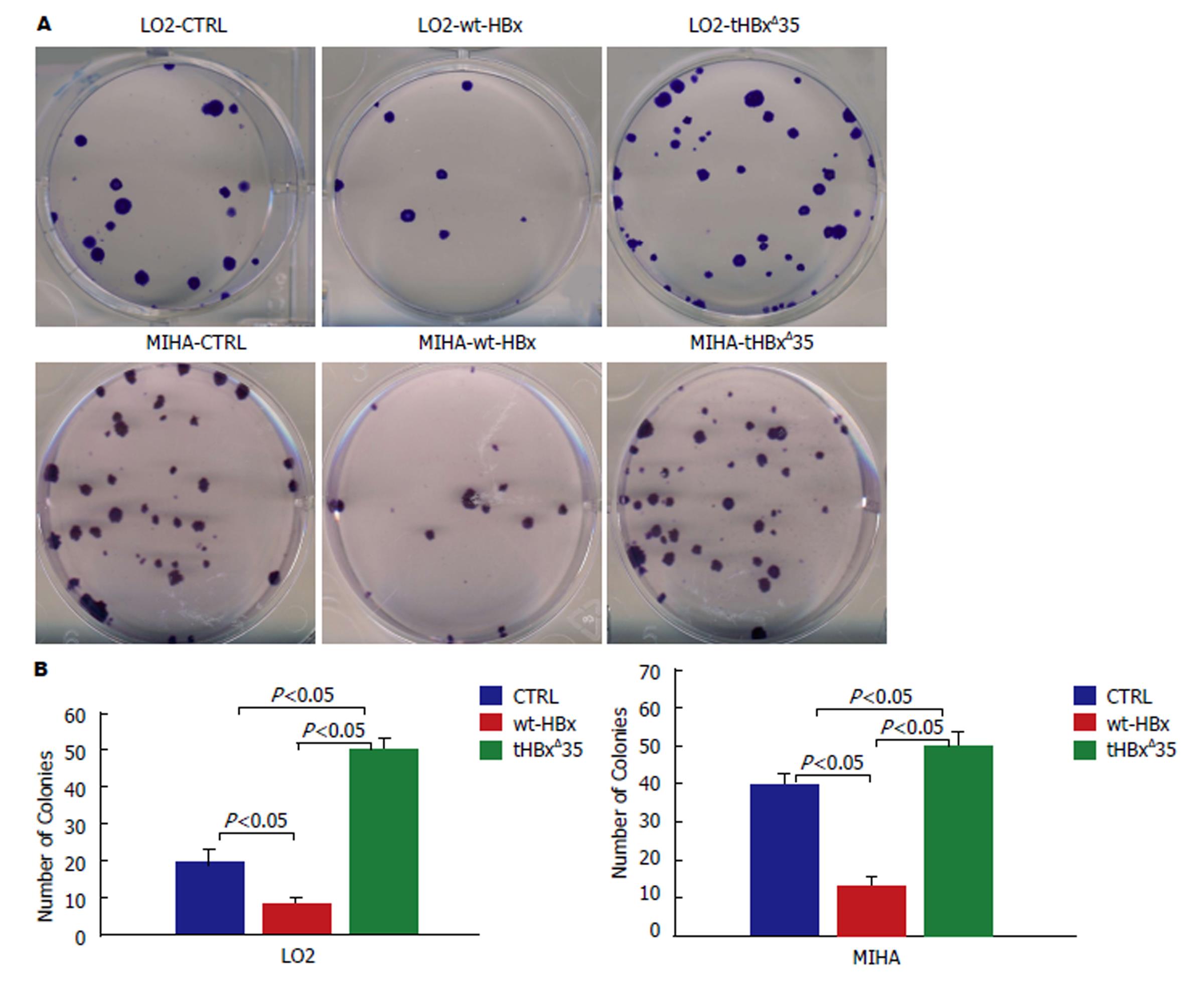
图5 集落形成实验检测重组慢病毒感染肝细胞LO2, MIHA后形成的集落.
A:重组慢病毒tHBxΔ35组, wt-HBx组, 对照组CTRL分别感染LO2和MIHA细胞而形成的集落; B: 重组慢病毒tHBxΔ35组, wt-HBx组, 对照组CTRL分别感染LO2和MIHA细胞形成集落的计数.
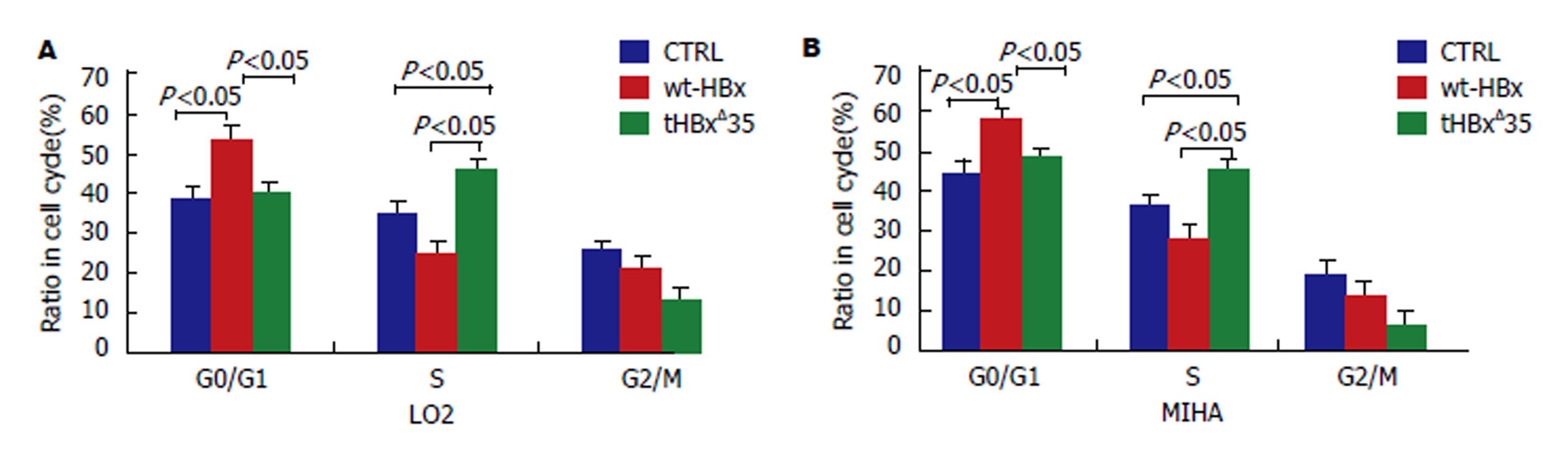
图6 流式细胞仪分析重组慢病毒感染肝细胞LO2/MIHA的细胞周期.
A: 重组慢病毒tHBxΔ35组, wt-HBx组, 对照组CTRL分别感染LO2的细胞周期; B重组慢病毒tHBxΔ35组, wt-HBx组, 对照组CTRL分别感染MIHA的细胞周期.
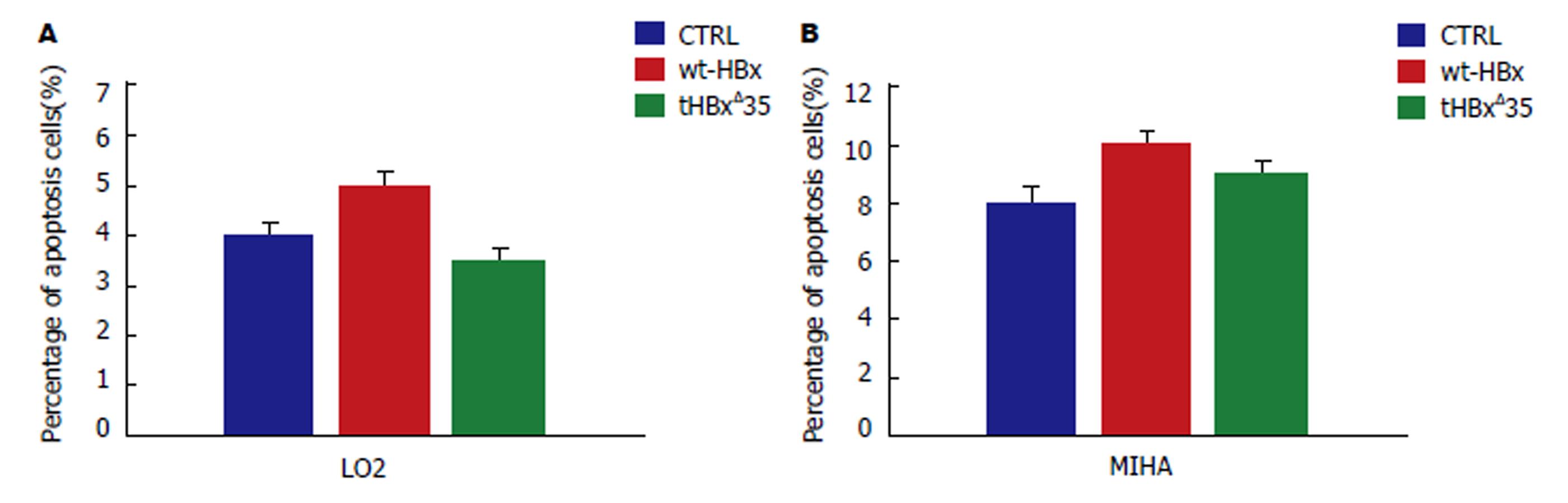
图7 流式细胞仪分析重组慢病毒感染肝细胞LO2/MIHA后的细胞凋亡.
A: 重组慢病毒tHBxΔ35组, wt-HBx组, 对照组CTRL分别感染LO2的细胞凋亡率; B: 重组慢病毒tHBxΔ35组, wt-HBx组, 对照组CTRL分别感染MIHA的细胞凋亡率. P>0.05, 无明显统计学差异.
引文著录: 朱冉旭, 羊东晔, 司徒伟基. HBx蛋白及其羧基末端缺失35个氨基酸的突变体对正常肝细胞增殖的影响. 世界华人消化杂志 2018; 26(13): 760-768