Copyright
©The Author(s) 2017.
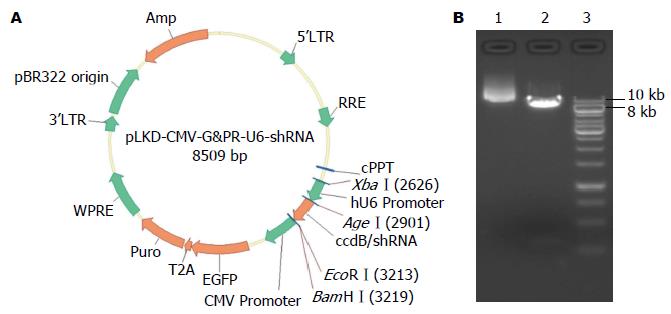
图1 慢病毒表达载体和表达载体的线性化.
A: 带有GFP荧光和puromycin抗性基因标记的KDM5C干扰慢病毒载体; B: 电泳图. 1: 未酶切的干扰载体; 2: 经AgeⅠ和EcoRⅠ双酶切的干扰载体; 3: DNA ladder Marker. GFP: 绿色荧光蛋白.
图2 菌落PCR鉴定图和重组载体测序图.
A, B, C分别为shKDM5C-1、shKDM5C-2及shKDM5C-3菌落PCR鉴定图; 1: 阴性对照(水); 2: 阴性对照(空载体质粒); 3: DNA Marker; 4-11为挑取的8个转化子. D, E, F: 分别为shKDM5C-1、shKDM5C-2及shKDM5C-3重组载体部分测序结果.
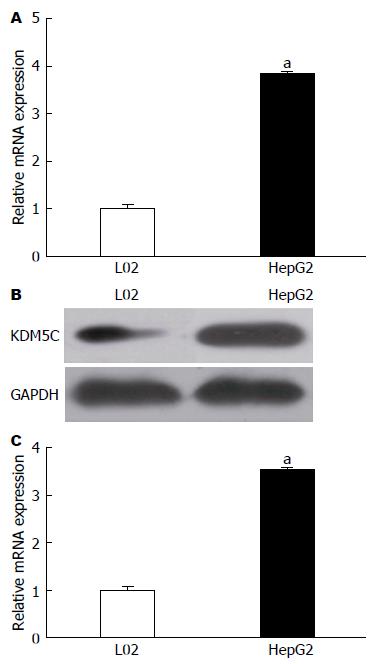
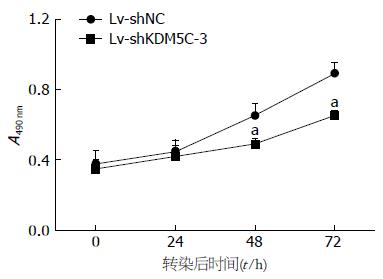
图4 qRT-PCR和Western blotting检测细胞KDM5C表达水平.
A: 正常肝细胞L02组和HepG2组细胞KDM5C的mRNA相对表达量; B: L02组和HepG2组细胞KDM5C蛋白电泳条带; C: L02组和HepG2组细胞KDM5C的蛋白相对表达量. aP<0.05 vs L02组.
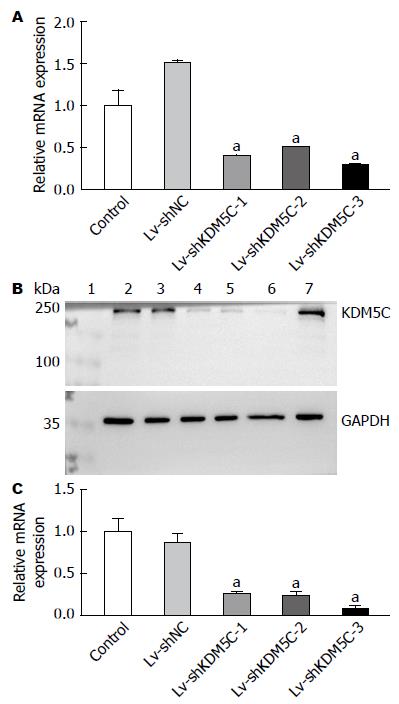
图5 qRT-PCR和Western blotting检测细胞KDM5C表达水平.
A: 各组细胞KDM5C的mRNA相对表达量; B: 各组细胞KDM5C的蛋白电泳图. 1: Marker; 2: Control; 3: Lv-shNC; 4: Lv-shKDM5C-1; 5: Lv-shKDM5C-2; 6: Lv-shKDM5C-3; 7: Control; C: 各组细胞KDM5C的蛋白相对表达量. aP<0.05 vs Lv-shNC组.
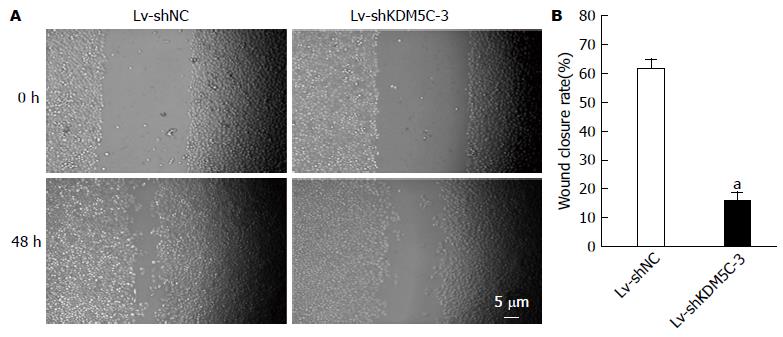
图7 Lv-shKDM5C对HepG2细胞迁移能力的影响.
A: 细胞划痕实验图(Bar = 5 μm); B: 空干扰病毒转染组及KDM5C干扰组细胞相对迁移速率的比较. aP<0.05 vs Lv-shNC组.
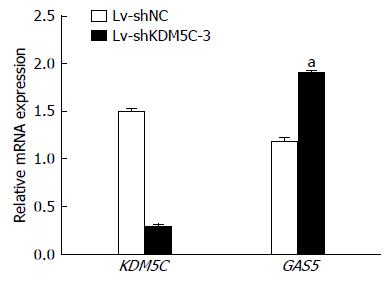
图8 qRT-PCR检测转染Lv-shKDM5C-3细胞KDM5C、GAS5的mRNA表达水平.
空干扰病毒转染(对照)组; Lv-shKDM5C-3为KDM5C慢病毒干扰组. aP<0.05 vs Lv-shNC组.
引文著录: 胡敏敏, 詹浩炼, 刘丽璇, 项梦琦, 蒲泽锦, 李国平, 吴灵飞. KDM5C基因shRNA重组慢病毒载体的构建及其对肝癌HepG2细胞的增殖和迁移的影响. 世界华人消化杂志 2017; 25(8): 691-701