Copyright
©The Author(s) 2007.
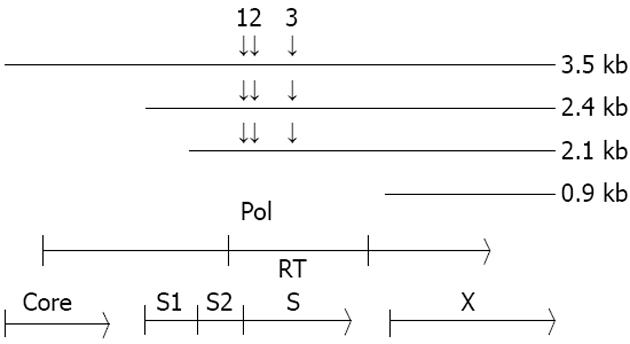
图1 HBV靶位序列的选择.
我们选择的154i(1), 312i(2)和734i(3)均针对HBV基因组Pol基因的RT区. 其中154i还对应了S基因的pre S2区, 312i和734i对应了S区. 3个靶位都同时针对了3.5 kb, 2.4 kb和2.1 kb 3条HBV前基因组的mRNA.
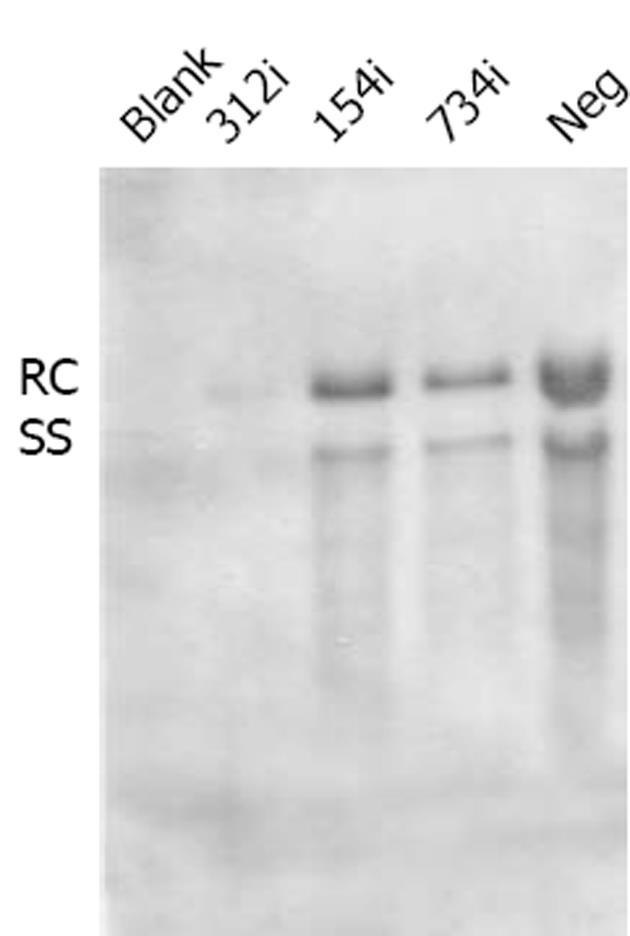
图2 HBV核心颗粒DNA Southern印迹结果.
使用8 mg干扰质粒(154i, 312i, 734i)以及阴性对照(Neg)分别与1.6 mg pHBV3.8共转染Huh-7, 48 h后收获细胞抽提HBV核心颗粒DNA将抽提得到的DNA上样电泳, 转膜, 固定, 并使用PCR合成的地高辛标记的探针杂交过夜, 使用CSPD发光后压片曝光. RC: 松弛环状DNA; SS: 单链DNA.
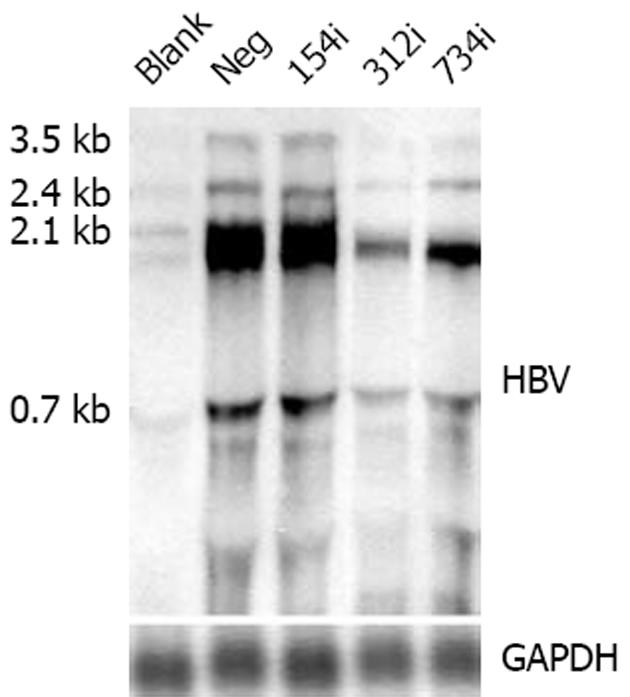
图3 HBV RNA的Northern杂交结果.
使用2 mg干扰质粒(154i, 312i, 734i)以及阴性对照(Neg)分别与0.4 mg pHBV3.8 共转染Huh-7, 48 h后收获细胞抽提RNA, 将抽提得到的RNA上样电泳, 转膜, 固定, 并使用PCR合成的地高辛标记的探针杂交过夜, 使用CSPD发光后压片曝光. 洗膜后再使用GAPDH(3-磷酸甘油醛脱氢酶)的探针杂交过夜, 再次CSPD发光后压片曝光.
引文著录: 王新宇, 张继明, 尹有宽, 谢怡, 黄玉仙, 邬祥惠, 翁心华. RNA干扰对乙型肝炎病毒复制的体外影响. 世界华人消化杂志 2007; 15(15): 1688-1694