Copyright
©The Author(s) 2006.
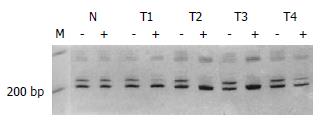
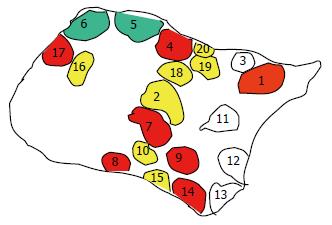
图3 例4之HA瘤组织四个不同部位(T1-T4)AR位点HhaI酶切前后改变, 酶切后上带明显减弱(T1, 57.
13%; T4, 71.8%)或消失(T2和T3). -: 酶切前; +: 酶切后; N: 正常肝组织.
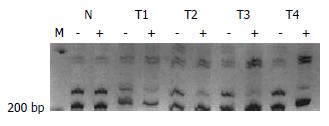
图4 例6之HCC四个不同部位(T1-T4)AR位点酶切前后改变, 酶切后上带明显减弱(T1, 57.
63%; T2, 72.6%; T3, 95.5%; T4, 89.8%). -: 酶切前; +: 酶切后; N: 正常肝组织.
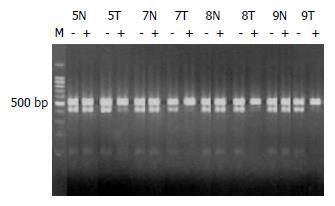
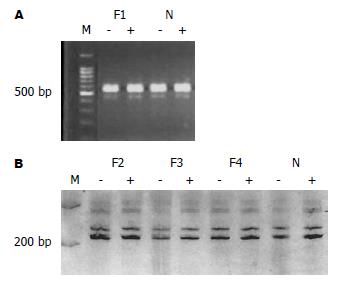
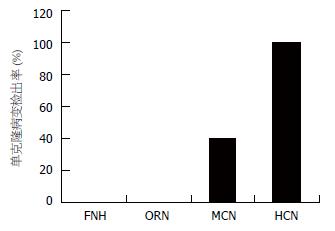
图9 3例FNH之4个病变(F1-F4) HpaⅡ(A)或Hha Ⅰ(B)酶切前后上下带强度无明显改变.
M: DNA标记物; -: 酶切前; +: 酶切后; N: 正常肝组织. A: 例1; B: 例2-4.
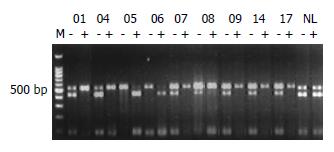
图11 例1中9个单克隆NAH PGK位点检测结果, 其中结节5和结节6酶切后上带几乎完全消失, 只保留下带, 而其余仅保留上带.
M: DNA标记物; -: 酶切前; +: 酶切后; NL: 正常肝组织.
引文著录: 巩丽, 张宏图, 张伟, 李爱宁, 刘杉, 孙耘田, 刘贵秋, 苏勤. 克隆性分析技术在肝脏局灶性结节性增生诊断中的应用. 世界华人消化杂志 2006; 14(6): 568-575