修回日期: 2018-01-31
接受日期: 2018-02-10
在线出版日期: 2018-03-08
上皮间质转化(epithelial mesenchymal transition, EMT)是上皮细胞向间充质细胞转化的过程, 他不仅在发育过程中具有重要作用, 而且还参与组织愈合、器官纤维化和肿瘤发生与转移等过程. 近年来研究发现, 肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)作为一种主要炎症因子, 可以通过激活核因子-κB(nuclear factor-κB, NF-κB)通路, 诱导Snail表达, 从而介导上皮间质转化. 本文旨对TNF-α/NF-κB/Snail通路介导EMT的作用作一简要介绍, 以期对TNF-α参与调控EMT有更进一步的认识.
核心提要: 本文主要通过对肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)/核转录因子-κB/Snail通路介导上皮间质转化(epithelial mesenchymal transition, EMT)的研究现状进行简要介绍, 以期对TNF-α参与调控EMT有更进一步的认识.
引文著录: 周竞, 吴焕淦, 施茵. TNF-α/NF-κB/Snail介导上皮间质转化的作用. 世界华人消化杂志 2018; 26(7): 441-448
Revised: January 31, 2018
Accepted: February 10, 2018
Published online: March 8, 2018
Epithelial-mesenchymal transition (EMT) is a process of transformation of epithelial cells to mesenchymal cells, and it not only plays an important role in the developmental process, but also participates in tissue healing, organ fibrosis, tumorigenesis, and metastasis. In recent years, it has been found that tumor necrosis factor-α (TNF-α) is a major inflammatory factor that can induce snail expression by binding to nuclear factor-κB (NF-κB), thus mediating EMT. This article briefly introduces the roles of the TNF-α/NF-κB/Snail pathway in mediating EMT, aiming to promote a further understanding of the mechanism of TNF-α in regulating EMT.
- Citation: Zhou J, Wu HG, Shi Y. Roles of TNF-α/NF-κB/Snail pathway in regulating epithelial-mesenchymal transition. Shijie Huaren Xiaohua Zazhi 2018; 26(7): 441-448
- URL: https://www.wjgnet.com/1009-3079/full/v26/i7/441.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i7.441
上皮间质转化(epithelial mesenchymal transition, EMT)是指上皮细胞失去细胞极性和细胞间黏附特征, 并具有迁移和侵袭特性, 由此成为间充质细胞的过程[1,2]. EMT对于包括中胚层形成和神经管形成在内的许多发育过程是必不可少的; 同时EMT也可出现在伤口愈合、器官纤维化和肿瘤的发生与转移过程中. 在EMT中, 细胞表型的改变是其最重要的特征. 其中E-钙黏蛋白(E-cadherin)的表达或功能丧失、紧密连接蛋白如闭锁小带蛋白1(zonula occludes protein-1, ZO-1)、咬合蛋白(occludin)以及细胞角蛋白(Cytokeratin)的数量减少, 间质细胞标记物如波形蛋白(Vimentin)、纤维连接蛋白(Fibronectin)、成纤维细胞特异性蛋白-1(fibroblast specific protein 1, FSP-1)、α-平滑肌肌动蛋白(α smooth muscle actin, α-SMA)以及N-钙黏蛋白(N-cadherin)的增加都标志着EMT的形成[3]. 研究显示, 肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)作为炎症性疾病的关键促炎因子, 可以通过调控Snail减少E-cadherin和ZO-1的表达, 增加间充质标志物N-cadherin和Fibronectin的表达, 最终介导EMT[4]. TNF-α的生物学特性主要通过激活核转录因子-κB(nuclear factor-κB, NF-κB). 随着对EMT研究的不断深入, 发现TNF-α/NF-κB可以调控Snail介导EMT[5]. 本文拟对TNF-α/NF-κB/Snail通路在介导EMT中的作用作一简要综述, 以期对TNF-α参与调控EMT有更进一步的认识.
EMT是通过上皮细胞基底面与基底膜相互作用, 使其呈现间质细胞表型, 表现为迁移能力、侵袭性、抗凋亡的作用显著增加的一种生物学过程[6]. 在EMT过程中, 上皮细胞失去细胞间黏附, 形成成纤维细胞样特征, 而且上皮细胞失去apical-basal极性, 细胞骨架重组, 细胞形状发生改变以及重新编码基因表达程序. 上述这些变化不仅增加了单个细胞的运动能力, 并且促进了其侵袭性表型的形成, 致使细胞的迁移和侵袭特性增加[1,2]. EMT分为三种亚型: Ⅰ型发生在胚胎形成及器官的发育过程中; Ⅱ型发生在组织修复和器官纤维化, 包括肝、肠等上皮组织或器官纤维化过程中[7,8]; Ⅲ型发生在肿瘤如胃癌、胰腺癌等[9,10]的转移扩散过程中. 这三种类型EMT都有一个共同的结果--细胞间质表型的产生[2,11].
EMT的形成最先从上皮细胞标志物的缺失开始, 以E-cadherin蛋白表达下降最为显著[12]. E-cadherin的功能是通过黏附连接维持上皮细胞之间的横向联系以及保持在组织中相对静止的状态[13,14]. E-cadherin的下调是通过上调Vimentin, 他是一种减少E-cadherin运输到细胞表面的中间丝[15,16]. 随后这些细胞通过获得间充质标记物和功能而向间充质表型发展. 这种变化涉及到一系列相关蛋白的表达, 包括Fibronectin、Vimentin、整联蛋白(Integrin)和基质金属蛋白酶(matrix metalloproteinase, MMPs)等等[2,16,17]. EMT是原发性肿瘤转移的重要过程, 作为关键促炎因子的TNF-α已被证实可以介导EMT的发生, 促进肿瘤的迁移和侵袭[18-20].
TNF-α是促炎症反应因子, 具有广泛的生物学效应, 在机体的细胞功能调节、肿瘤的形成以及免疫和炎症反应等过程中都具有重要作用[21]. 人TNF-α前体是由233个氨基酸组成(26 kDa), 其中包含由76个氨基酸残基组成的信号肽, 在TNF转化酶TACE的作用下, 切除信号肽, 形成成熟的157个氨基酸残基的TNF-α(17 kDa)[22]. 虽然活化的巨噬细胞是TNF-α的主要来源, 但他也可由多种其他细胞产生, 如成纤维细胞、星形胶质细胞、平滑肌细胞、角质形成细胞和多种肿瘤细胞, 包括B细胞淋巴瘤、乳腺癌和结肠癌细胞等[23]. TNF-α是Ⅱ型跨膜蛋白(C端在胞外, N端在胞浆内), C端胞外区150个氨基酸残基组成TNF同源区(TNF homology domain, THD), 结构上表现为10个β条带构成的β凝胶卷, THD常以β面用非共价键形式聚集成同源三聚体[24]. TNF-α以两种形式在体内存在: 可溶性TNF-α(sTNF-α)和膜相关的TNF-α(mTNF-α), 通常认为mTNF-α是sTNF-α的前体, 在膜金属蛋白酶作用下从膜上裂解, 脱落成为sTNF-α[23-26]. mTNF-α的表达以及其sTNF-α的产生是不同刺激反应中不可缺少的过程. TNF-α的生物学效应是通过与TNFR1和TNFR2结合实现的, TNFR1和TNFR2分子量分别为55 kDa和75 kDa, 分别含有455和461个氨基酸, 由信号肽、胞外结构域、跨膜区及胞内结构域4部分组成. 两类受体与不同的蛋白质作用, 激活特异的信号传递途径[26]. TNFR1作为TNF-α主要的信号通路受体可以被mTNF和sTNF激活, 并且在大多数组织中广泛表达, 在细胞损伤、成纤维细胞增殖以及细胞程序性死亡等多种生物活性的信号传递方面发挥重要作用; TNFR2则是参与免疫细胞应答以及介导少量生物学效应, 只被mTNF激活, 主要传递胸腺细胞和NK等淋巴细胞的增殖信号[27,28]. sTNF-α同TNFR1结合可以激活NF-κB, 从而诱导细胞的存活和凋亡. TNFR2主要激活NF-κB通路介导组织再生和免疫调节[28]. 由此可以看出, TNF-α同这两个不同受体结合后, 最终都会激活NF-κB; 但其诱导NF-κB的信号通路却有很大差异[29].
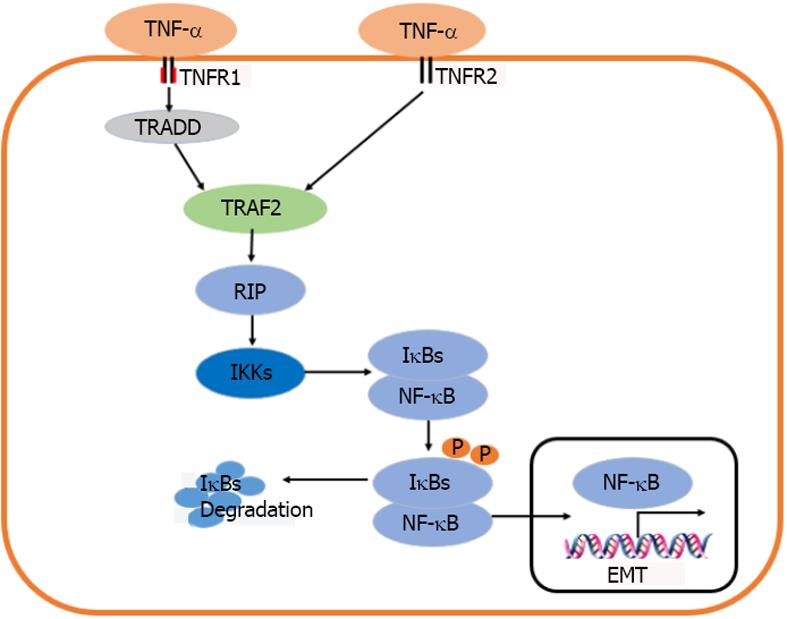
众所周知, TNF-α需要通过TNFR1和TNFR2这两种不同的细胞表面特异性受体介导其生物学活性. TNFR1和TNFR2胞外域均富含半胱氨酸, 能够与同一TNF配体结合. 然而, 他们的胞内域有很大差异. TNFR1含有"死亡结构域"(death domain, DD), 他是由80个氨基酸组成的序列, 形成一个特有的褶皱[30,31]. 该死亡域DD包含有一个N末端TRAF结合区域和一个C末端死亡结构域. 当TNFR1同TNF结合后能够招募适配器分子TNFR1相关的死亡域蛋白(TNFR1 associated death domainprotein, TRADD)和受体相互作用蛋白激酶1(receptor interacting protein kinase 1, RIPK1); 随后, TNFR1、TRADD以及RIPK1启动膜相关TNFR复合体1-肿瘤坏死因子受体相关因子(TNF receptor associated factor, TRAF)2或5同TRADD N末端TRAF结合区域结合激活IκB激酶(IkB kinase, IKK). TRAF2通过与IKKα和IKKβ的亮氨酸À链(leucine zipper, LZ)模式相互作用募集IKK复合体到活化的TNFR1[32,33]. 当细胞处于静息状态时, NF-κB二聚体与抑制性蛋白κB(IκBs)结合形成三聚体存在于细胞浆中. IκB同NF-κB亚基的RHD偶联覆盖核定位信号, 阻止NF-κB核易位. 对于IκBs, 目前发现有7种蛋白质: IκB-α、IκB-β, IκB-γ、IκB-ε、Bcl-3、p100和p105. 在经典通路中, 活化的IKKβ导致IκB-α的丝氨酸残基Ser32和Ser36及IκB-β的Ser19和Ser23发生磷酸化, 再在赖氨酸Lys21和Lys22残基泛素化, 促使IκBs被26S蛋白酶小体快速降解, 从而释放NF-κB, 转运至胞核内结合κB转录位点, 进而激活靶基因的表达[34]. TNFR2胞内区由于没有死亡结构域, 导致不能募集TRADD, 但TNFR2可以募集TRAF2, 从而激活NF-κB通路发挥相应生物学作用[35].
NF-κB是一种具有多向调节功能、广泛存在于各种细胞中的核转录因子, 可介导广泛的基因转录活动包括细胞存活, 增殖和炎性反应等. 因此, NF-κB的激活可以阻止细胞死亡. 现已知NF-κB的家族成员包括p50、p52、c-Rel、RelA和RelB. 这些成员以一定的组合形成不同的二聚体; 不同NF-κB二聚体同DNA结合的特异性不同, 有的可引起基因转录激活, 有的则可抑制转录, 其中p50/RelA激活转录, 因此NF-κB常常是指p50/RelA. 在几乎所有的细胞类型中, 当其暴露于TNF-α时, NF-κB即可被激活并导致各种炎症相关基因的表达[36]. 在TNF-α等细胞因子刺激下, NF-κB的激活不仅可引起炎症反应, 还可以介导EMT的产生. 有研究显示, 抑制NF-κB通路可减少细胞的入侵和转移, 降低EMT的发生, 并能增加E-Cadherin表达[37,38].
TNF-α作为主要由巨噬细胞产生的一种促炎性细胞因子, 是调节肿瘤炎症过程的关键分子. TNF-α不仅参与各种肿瘤浸润、侵袭和转移, 在某些肿瘤如口腔鳞癌, 结肠癌等肿瘤中可以促进EMT的发生[39-44]. 有研究显示, TNF-α处理肝癌细胞株Hep3B及SMMC-7721细胞24 h后, NF-κB p65活性上调, IκBa表达下调; 而用NF-κB抑制剂BAY11-7082处理细胞后, 则发现TNF-α诱导人肝癌细胞发生EMT的作用明显被抑制[43], 提示TNF-α可以通过NF-κB信号通路诱导EMT的发生(图1). 在用TNF-α刺激后口腔鳞癌细胞IKKβ和p65的mRNA和蛋白表达增加, 同时, 口腔鳞癌细胞的侵袭转移能力增强. TNF-α刺激后, 可以观察到HN4、HN6和CAL 27细胞的IKKβ和p65显著增加. 用10 ng/mL TNF-α处理0、3、6、12、24、48、72 h后, RT-PCR和Western blot分析显示, IKKβ和p65水平在24、48和72h显著升高. 其结果表明TNF-α通过激活口腔癌细胞NF-κB通路促进口腔癌细胞的侵袭和转移[44]. 在TNF-α诱导人下咽癌FaDu细胞EMT的研究中, 通过24h暴露于TNF-α, FaDu细胞运动加快, FaDu细胞的侵袭和转移性升高, 并且在用TNF-α干预后, 其入侵细胞较对照组显著升高, 表明TNF-α可以增加FaDu细胞的运动力、侵袭和转移力, 此外, TNF-α通过激活NF-κB通路破坏了正常的细胞与细胞之间的黏附, 改变细胞的极性, 增加Vimentin和N-cadherin的表达, 同时降低E-cadherin的表达[45].
在结肠癌细胞的EMT研究中发现, TNF-α抗体快速抑制由PMA处理的HL-60细胞和TGF-β共同诱导的EMT, 在TGF-β单独诱导EMT需要24 h才能出现降解产物, 而当TNF-α与TGF-β同时诱导EMT时, E-cadherin表达在8-12 h后就会完全消失. 但是TNF-α单独使用却不能影响E-cadherin表达水平. 由此表明巨噬细胞分泌的TNF-α可以与TGF-β协同加速EMT的产生[46]. 其机制可能是通过TNF-α活化ERK, 由此加速TGF-β通路介导EMT. 研究还发现, TNF-α同TGF-β相互协同激活转化生长因子-β激活激酶1(transforming growth fctor-1, TAK1)介导EMT[47]. 此外, 在一些癌细胞中, TNF-α通过NF-κB通路诱导趋化因子受体CXCR4、单核细胞、趋化蛋白-1(monocyte chemotactic protein 1, MCP-1)、IL-8和细胞间黏附分子-1(intercellular adhesion molecule-1, ICAM-1)增强细胞迁移和转移[48].
有研究显示, TNF-α通过调控转录因子Snail表达来介导EMT[49]. 而转录因子包括Snail、Slug、ZEB1和Twist, 都与EMT发生相关联[50]. 其中Snail首次是在果蝇中发现, 已被证明是一个关键的EMT调控因子[51]. 研究表明snail通过与E-cadherin启动子中E-box的结合来抑制E-cadherin的转录[52], 还可以上调vimentin诱导细胞骨架改变从而介导EMT[53]. 在脊椎动物的三种Snail蛋白中, Snail1和Snail2(又名SLUG)在EMT发生、组织纤维化以及肿瘤中激活其相关通路; 他们在与E-box的DNA序列结合之后, 通过其羧基末端的锌指结构域抑制上皮标志物的基因表达; 激活的Snail可以通过结合E-cadherin启动子区的三个E-boxes(5'-CAGGTG-3')抑制E-cadherin的基因表达[54]. 近年来, Snail在EMT和肿瘤转移中的作用越来越受到人们的关注. Snail高表达于胃癌、结肠癌、乳腺癌中[4,52,55]. Snail可以与许多靶基因相互作用, E-cadherin已被证实是Snail直接作用的靶基因. 在胃癌细胞中, Snail通过抑制E-cadherin的表达来诱导EMT的发生; 此外, Snail还可以下调上皮黏蛋白(mucin)和细胞角蛋白(cytokeratin, CK)等上皮标志物, 并上调Vimentin和Fibronectin等间充质标志物[4]. 同样, 在乳腺癌细胞中, Snail除可下调E-cadherin外, 还可下调闭合蛋白(claudin)、occludin和mucin, 同时也可上调Fibronectin、Vimentin、基质金属蛋白酶9(matrix metallopmteinase 9, MMP9)等[52]. 由此可见, Snail主要通过下调细胞的上皮标志物以及上调间充质标志物来介导EMT; 并且能够通过抑制E-cadherin的表达以及改变细胞骨架, 进而促进EMT的转变来增强肿瘤细胞的侵袭能力.
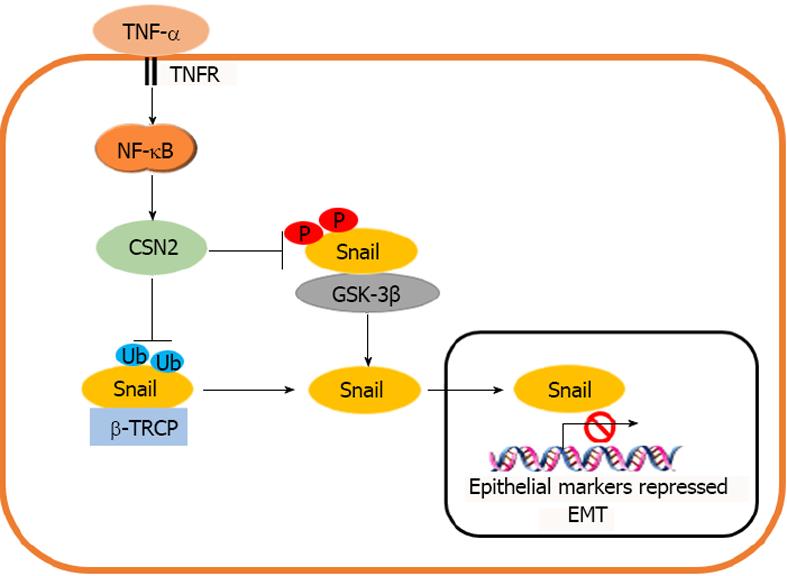
由于EMT发生在伤口愈合期间以及转移性癌浸润之前[56,57], 这两个过程都是受炎症微环境刺激物的影响. 由于Snail是诱导EMT的主要转录因子[2,52,58], 在肿瘤发生过程中, 肿瘤细胞在肿瘤和宿主之间的转移和浸润, 是由炎症细胞因子通过Snail诱导EMT引起的. Snail在非转移性乳腺癌细胞系中的表达稳定, 大大提高了这些细胞的侵袭能力, 表明Snail是介导炎症细胞因子侵袭的关键分子. 在研究众多由巨噬细胞分泌的TNF-α、IL-1β、IL-2、IL-6、IFN-γ等炎性细胞因子是否可以稳定Snail表达时发现, 当Snail/HEK293细胞给予不同细胞因子治疗6 h, TNF-α和泛素化蛋白酶体抑制剂MG-132诱导Snail的表达水平相类似. 另外, 该研究还用其他细胞因子同TNF-α相结合, 发现TNF-α与其他细胞因子之间没有协同效应, 表明通过巨噬细胞条件培养基的细胞因子中主要是TNF-α可以诱导Snail表达[4]. 有研究发现, Snail启动子对NF-κB敏感, p65NF-κB亚基或含有p65DNA结合区的嵌合蛋白Rel-Vp16的共转染与Vp16的激活元件结合, 可以激活Snail启动子片段的活性. 同时, p65的转染也提高了Snail RNA的内源性水平. Snail极小启动子活性的激活促进了细胞的EMT, 表明他包含了在此过程中刺激Snail转录所需的大部分反应元件[59]. 只有同NF-κB反应的序列位于其最小启动子(介于-94和-78之间)上游, 说明NF-κB通路可以通过转录机制调控Snail表达. Snail是一种高度不稳定的蛋白质, 他可以通过糖原合成酶激酶3β(glycogen synthase kinase 3β, GSK-3β)磷酸化和E3泛素连接酶SCFβ-TRCP介导的泛素化来降解. 有研究显示, TNF-α是通过稳定Snail水平从而诱导EMT的主要信号[60]. 其机制可能是通过TNF-α/NF-κB转录诱导β-酪蛋白(β-casein, CSN2), 干扰Snail与GSK-3β和β-Trcp的结合, 阻断Snail的磷酸化和泛素化(图2). CSN2是所有真核生物中COP9信号小体第二保守亚基, 8个CSN亚基与26s蛋白酶体的8个亚基具有显著的序列同源性, 并被认为可以同cullin家族蛋白的泛素连接酶相互作用, 是SCFβ-TRCP所属的cullin-RING泛素连接酶家族 的主要调节因子. CSN2通过与泛素/蛋白酶体系统协同调控蛋白, 如Snail的稳定性[61,62]. Wu等[60]研究发现, 在50个被TNF-α快速诱导的基因中, 只有一个基因CSN2可以稳定Snail表达. 过度表达的CSN2足以稳定Snail的表达. 当敲除CSN2基因后, TNF-α无法调控Snail表达水平. 说明CSN2对于TNF-α稳定Snail水平至关重要. 在Wu等[60]的研究中发现CSN的主要作用是令Snail远离GSK3β, 阻断GSK-3β磷酸化, 从而稳定Snail水平诱导EMT.
TNF-α是免疫系统中研究最多的细胞因子之一. 大量研究证明, TNF-α是复杂细胞因子网络中的核心分子, 他不仅调节促炎反应, 而且调节细胞通讯、分化以及凋亡等多种生理病理学过程. 近年来众多研究表明, TNF-α可通过介导EMT, 在促进肿瘤侵袭、转移和浸润, 以及器官组织的纤维化过程中发挥重要作用. TNF-α介导EMT的生物学效应主要是通过与NF-κB的结合而发挥作用, 即TNF-α可通过其受体(TNFR1和TNFR2)活化NF-κB, 继而调控诱导Snail表达或稳定Snail水平来介导EMT. 此外, TNF-α还可与TGF-β协同, 通过活化ERK或TAK1信号通路介导EMT. 本文主要通过对TNF-α/NF-κB/Snail通路介导EMT的研究现状进行了简要介绍, 有关这部分的研究工作较少, 目前仍处于起步阶段, 而且TNF-α/NF-κB通路对Slug、ZEB1和Twist等其他转录因子介导EMT也是未来的一个研究方向. 随着今后对TNF-α/NF-κB调控EMT机制的不断深入研究, 必将会为临床防治EMT以及肿瘤和器官组织纤维化提供新的思路和研究方向.
学科分类: 胃肠病学和肝病学
手稿来源地: 上海市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
编辑:闫晋利 电编:闫晋利
| 1. | Thiery JP, Acloque H, Huang RY, Nieto MA. Epithelial-mesenchymal transitions in development and disease. Cell. 2009;139:871-890. [PubMed] [DOI] |
| 3. | Kalluri R, Weinberg RA. The basics of epithelial-mesenchymal transition. J Clin Invest. 2009;119:1420. [PubMed] [DOI] |
| 4. | Wang H, Wang HS, Zhou BH, Li CL, Zhang F, Wang XF, Zhang G, Bu XZ, Cai SH, Du J. Epithelial-mesenchymal transition (EMT) induced by TNF-α requires AKT/GSK-3β-mediated stabilization of snail in colorectal cancer. PLoS One. 2013;8:e56664. [PubMed] [DOI] |
| 5. | Wu TJ, Chang SS, Li CW, Hsu YH, Chen TC, Lee WC, Yeh CT, Hung MC. Severe Hepatitis Promotes Hepatocellular Carcinoma Recurrence via NF-κB Pathway-Mediated Epithelial-Mesenchymal Transition after Resection. Clin Cancer Res. 2016;22:1800-1812. [PubMed] [DOI] |
| 6. | Legras A, Pécuchet N, Imbeaud S, Pallier K, Didelot A, Roussel H, Gibault L, Fabre E, Le Pimpec-Barthes F, Laurent-Puig P. Epithelial-to-Mesenchymal Transition and MicroRNAs in Lung Cancer. Cancers (Basel). 2017;9:pii E101. [PubMed] [DOI] |
| 7. | Kim SM, Choi JE, Hur W, Kim JH, Hong SW, Lee EB, Lee JH, Li TZ, Sung PS, Yoon SK. RAR-Related Orphan Receptor Gamma (ROR-γ) Mediates Epithelial-Mesenchymal Transition Of Hepatocytes During Hepatic Fibrosis. J Cell Biochem. 2017;118:2026-2036. [PubMed] [DOI] |
| 8. | Yang J, Zhou CZ, Zhu R, Fan H, Liu XX, Duan XY, Tang Q, Shou ZX, Zuo DM. miR-200b-containing microvesicles attenuate experimental colitis associated intestinal fibrosis by inhibiting epithelial-mesenchymal transition. J Gastroenterol Hepatol. 2017;32:1966-1974. [PubMed] [DOI] |
| 9. | Okubo K, Uenosono Y, Arigami T, Yanagita S, Matsushita D, Kijima T, Amatatsu M, Uchikado Y, Kijima Y, Maemura K. Clinical significance of altering epithelial-mesenchymal transition in metastatic lymph nodes of gastric cancer. Gastric Cancer. 2017;20:802-810. [PubMed] [DOI] |
| 10. | Heiler S, Wang Z, Zöller M. Pancreatic cancer stem cell markers and exosomes - the incentive push. World J Gastroenterol. 2016;22:5971-6007. [PubMed] [DOI] |
| 11. | Volk SW, Iqbal SA, Bayat A. Interactions of the Extracellular Matrix and Progenitor Cells in Cutaneous Wound Healing. Adv Wound Care. 2013;2:261-272. [PubMed] [DOI] |
| 12. | Rajić J, Inic-Kanada A, Stein E, Dinić S, Schuerer N, Uskoković A, Ghasemian E, Mihailović M, Vidaković M, Grdović N. Chlamydia trachomatis Infection Is Associated with E-Cadherin Promoter Methylation, Downregulation of E-Cadherin Expression, and Increased Expression of Fibronectin and α-SMA-Implications for Epithelial-Mesenchymal Transition. Front Cell Infect Microbiol. 2017;7:253. [PubMed] [DOI] |
| 13. | Huang RY, Guilford P, Thiery JP. Early events in cell adhesion and polarity during epithelial-mesenchymal transition. J Cell Sci. 2012;125:4417-4422. [PubMed] [DOI] |
| 14. | Qin Y, Capaldo C, Gumbiner BM, Macara IG. The mammalian Scribble polarity protein regulates epithelial cell adhesion and migration through E-cadherin. J Cell Biol. 2005;171:1061-1071. [PubMed] [DOI] |
| 15. | Mendez MG, Kojima S, Goldman RD. Vimentin induces changes in cell shape, motility, and adhesion during the epithelial to mesenchymal transition. FASEB J. 2010;24:1838-1851. [PubMed] [DOI] |
| 16. | Lee JM, Dedhar S, Kalluri R, Thompson EW. The epithelial-mesenchymal transition: new insights in signaling, development, and disease. J Cell Biol. 2006;172:973-981. [PubMed] [DOI] |
| 17. | Lee AY, Fan CC, Chen YA, Cheng CW, Sung YJ, Hsu CP, Kao TY. Curcumin Inhibits Invasiveness and Epithelial-Mesenchymal Transition in Oral Squamous Cell Carcinoma Through Reducing Matrix Metalloproteinase 2, 9 and Modulating p53-E-Cadherin Pathway. Integr Cancer Ther. 2015;14:484-490. [PubMed] [DOI] |
| 18. | Montesano R, Soulié P, Eble JA, Carrozzino F. Tumour necrosis factor alpha confers an invasive, transformed phenotype on mammary epithelial cells. J Cell Sci. 2005;118:3487-3500. [PubMed] [DOI] |
| 19. | Garg M. Epithelial, mesenchymal and hybrid epithelial/mesenchymal phenotypes and their clinical relevance in cancer metastasis. Expert Rev Mol Med. 2017;19:e3. [PubMed] [DOI] |
| 20. | Huang L, Wang X, Wen C, Yang X, Song M, Chen J, Wang C, Zhang B, Wang L, Iwamoto A. Hsa-miR-19a is associated with lymph metastasis and mediates the TNF-α induced epithelial-to-mesenchymal transition in colorectal cancer. Sci Rep. 2015;5:13350. [PubMed] [DOI] |
| 21. | Waters JP, Pober JS, Bradley JR. Tumour necrosis factor and cancer. J Pathol. 2013;230:241-248. [PubMed] [DOI] |
| 22. | Moss ML, Jin SL, Milla ME, Bickett DM, Burkhart W, Carter HL, Chen WJ, Clay WC, Didsbury JR, Hassler D. Cloning of a disintegrin metalloproteinase that processes precursor tumour-necrosis factor-alpha. Nature. 1997;385:733-736. [PubMed] [DOI] |
| 24. | Magis C, van der Sloot AM, Serrano L, Notredame C. An improved understanding of TNFL/TNFR interactions using structure-based classifications. Trends Biochem Sci. 2012;37:353-363. [PubMed] [DOI] |
| 25. | Kriegler M, Perez C, DeFay K, Albert I, Lu SD. A novel form of TNF/cachectin is a cell surface cytotoxic transmembrane protein: ramifications for the complex physiology of TNF. Cell. 1988;53:45-53. [PubMed] [DOI] |
| 26. | Black RA, Rauch CT, Kozlosky CJ, Peschon JJ, Slack JL, Wolfson MF, Castner BJ, Stocking KL, Reddy P, Srinivasan S. A metalloproteinase disintegrin that releases tumour-necrosis factor-alpha from cells. Nature. 1997;385:729-733. [PubMed] [DOI] |
| 27. | Adrain C, Zettl M, Christova Y, Taylor N, Freeman M. Tumor necrosis factor signaling requires iRhom2 to promote trafficking and activation of TACE. Science. 2012;335:225-228. [PubMed] [DOI] |
| 28. | Croft M, Benedict CA, Ware CF. Clinical targeting of the TNF and TNFR superfamilies. Nat Rev Drug Discov. 2013;12:147-168. [PubMed] [DOI] |
| 29. | Faustman D, Davis M. TNF receptor 2 pathway: drug target for autoimmune diseases. Nat Rev Drug Discov. 2010;9:482-493. [PubMed] [DOI] |
| 30. | Brenner D, Blaser H, Mak TW. Regulation of tumour necrosis factor signalling: live or let die. Nat Rev Immunol. 2015;15:362-374. [PubMed] [DOI] |
| 31. | Lavrik I, Golks A, Krammer PH. Death receptor signaling. J Cell Sci. 2005;118:265-267. [PubMed] [DOI] |
| 32. | Tartaglia LA, Ayres TM, Wong GH, Goeddel DV. A novel domain within the 55 kd TNF receptor signals cell death. Cell. 1993;74:845-853. [PubMed] [DOI] |
| 33. | Liu F, Xia Y, Parker AS, Verma IM. IKK biology. Immunol Rev. 2012;246:239-253. [PubMed] [DOI] |
| 34. | Haas TL, Emmerich CH, Gerlach B, Schmukle AC, Cordier SM, Rieser E, Feltham R, Vince J, Warnken U, Wenger T. Recruitment of the linear ubiquitin chain assembly complex stabilizes the TNF-R1 signaling complex and is required for TNF-mediated gene induction. Mol Cell. 2009;36:831-844. [PubMed] [DOI] |
| 35. | Hayden MS, Ghosh S. NF-κB, the first quarter-century: remarkable progress and outstanding questions. Genes Dev. 2012;26:203-234. [PubMed] [DOI] |
| 36. | Legler DF, Micheau O, Doucey MA, Tschopp J, Bron C. Recruitment of TNF receptor 1 to lipid rafts is essential for TNFα-mediated NFκB activation. Immunity. 2003;18:655-664. [PubMed] [DOI] |
| 37. | Kuphal S, Poser I, Jobin C, Hellerbrand C, Bosserhoff AK. Loss of E-cadherin leads to upregulation of NFkappaB activity in malignant melanoma. Oncogene. 2004;23:8509-8519. [PubMed] [DOI] |
| 38. | Kumar M, Allison DF, Baranova NN, Wamsley JJ, Katz AJ, Bekiranov S, Jones DR, Mayo MW. NF-κB regulates mesenchymal transition for the induction of non-small cell lung cancer initiating cells. PLoS One. 2013;8:e68597. [PubMed] [DOI] |
| 39. | Di Caro G, Carvello M, Pesce S, Erreni M, Marchesi F, Todoric J, Sacchi M, Montorsi M, Allavena P, Spinelli A. Correction: Circulating Inflammatory Mediators as Potential Prognostic Markers of Human Colorectal Cancer. PLoS One. 2016;11:e0156669. [PubMed] [DOI] |
| 40. | Ma Y, Ren Y, Dai ZJ, Wu CJ, Ji YH, Xu J. IL-6, IL-8 and TNF-α levels correlate with disease stage in breast cancer patients. Adv Clin Exp Med. 2017;26:421-426. [PubMed] [DOI] |
| 41. | Di Minin G, Bellazzo A, Dal Ferro M, Chiaruttini G, Nuzzo S, Bicciato S, Piazza S, Rami D, Bulla R, Sommaggio R. Mutant p53 reprograms TNF signaling in cancer cells through interaction with the tumor suppressor DAB2IP. Mol Cell. 2014;56:617-629. [PubMed] [DOI] |
| 42. | Li CW, Xia W, Huo L, Lim SO, Wu Y, Hsu JL, Chao CH, Yamaguchi H, Yang NK, Ding Q. Epithelial-mesenchymal transition induced by TNF-α requires NF-κB-mediated transcriptional upregulation of Twist1. Cancer Res. 2012;72:1290-1300. [PubMed] [DOI] |
| 44. | Tang D, Tao D, Fang Y, Deng C, Xu Q, Zhou J. TNF-Alpha Promotes Invasion and Metastasis via NF-Kappa B Pathway in Oral Squamous Cell Carcinoma. Med Sci Monit Basic Res. 2017;23:141-149. [PubMed] [DOI] |
| 45. | Yu L, Mu Y, Sa N, Wang H, Xu W. Tumor necrosis factor α induces epithelial-mesenchymal transition and promotes metastasis via NF-κB signaling pathway-mediated TWIST expression in hypopharyngeal cancer. Oncol Rep. 2014;31:321-327. [PubMed] [DOI] |
| 46. | Hahn S, Nam MO, Noh JH, Lee DH, Han HW, Kim DH, Hahm KB, Hong SP, Yoo JH, Yoo J. Organoid-based epithelial to mesenchymal transition (OEMT) model: from an intestinal fibrosis perspective. Sci Rep. 2017;7:2435. [PubMed] [DOI] |
| 47. | Roh YS, Song J, Seki E. TAK1 regulates hepatic cell survival and carcinogenesis. J Gastroenterol. 2014;49:185-194. [PubMed] [DOI] |
| 48. | Kulbe H, Hagemann T, Szlosarek PW, Balkwill FR, Wilson JL. The inflammatory cytokine tumor necrosis factor-alpha regulates chemokine receptor expression on ovarian cancer cells. Cancer Res. 2005;65:10355-10362. [PubMed] [DOI] |
| 49. | Techasen A, Namwat N, Loilome W, Bungkanjana P, Khuntikeo N, Puapairoj A, Jearanaikoon P, Saya H, Yongvanit P. Tumor necrosis factor-α (TNF-α) stimulates the epithelial-mesenchymal transition regulator Snail in cholangiocarcinoma. Med Oncol. 2012;29:3083-3091. [PubMed] [DOI] |
| 50. | Peinado H, Olmeda D, Cano A. Snail, Zeb and bHLH factors in tumour progression: an alliance against the epithelial phenotype? Nat Rev Cancer. 2007;7:415-428. [PubMed] [DOI] |
| 51. | Nieto MA. The snail superfamily of zinc-finger transcription factors. Nat Rev Mol Cell Biol. 2002;3:155-166. [PubMed] [DOI] |
| 52. | Dong C, Wu Y, Yao J, Wang Y, Yu Y, Rychahou PG, Evers BM, Zhou BP. G9a interacts with Snail and is critical for Snail-mediated E-cadherin repression in human breast cancer. J Clin Invest. 2012;122:1469-1486. [PubMed] [DOI] |
| 53. | Zhao Y, Yan Q, Long X, Chen X, Wang Y. Vimentin affects the mobility and invasiveness of prostate cancer cells. Cell Biochem Funct. 2008;26:571-577. [PubMed] [DOI] |
| 54. | Wang Y, Shi J, Chai K, Ying X, Zhou BP. The Role of Snail in EMT and Tumorigenesis. Curr Cancer Drug Targets. 2013;13:963-972. [PubMed] [DOI] |
| 55. | Rosivatz E, Becker I, Specht K, Fricke E, Luber B, Busch R, Höfler H, Becker KF. Differential expression of the epithelial-mesenchymal transition regulators snail, SIP1, and twist in gastric cancer. Am J Pathol. 2002;161:1881-1891. [PubMed] [DOI] |
| 57. | Francí C, Takkunen M, Dave N, Alameda F, Gómez S, Rodríguez R, Escrivà M, Montserrat-Sentís B, Baró T, Garrido M. Expression of Snail protein in tumor-stroma interface. Oncogene. 2006;25:5134-5144. [PubMed] [DOI] |
| 58. | Zhou BP, Hung MC. Wnt, hedgehog and snail: sister pathways that control by GSK-3beta and beta-Trcp in the regulation of metastasis. Cell Cycle. 2005;4:772-776. [PubMed] [DOI] |
| 59. | Barberà MJ, Puig I, Domínguez D, Julien-Grille S, Guaita-Esteruelas S, Peiró S, Baulida J, Francí C, Dedhar S, Larue L. Regulation of Snail transcription during epithelial to mesenchymal transition of tumor cells. Oncogene. 2004;23:7345-7354. [PubMed] [DOI] |
| 60. | Wu Y, Deng J, Rychahou PG, Qiu S, Evers BM, Zhou BP. Stabilization of snail by NF-kappaB is required for inflammation-induced cell migration and invasion. Cancer Cell. 2009;15:416-428. [PubMed] [DOI] |
| 61. | Wolf DA, Zhou C, Wee S. The COP9 signalosome: an assembly and maintenance platform for cullin ubiquitin ligases? Nat Cell Biol. 2003;5:1029-1033. [PubMed] [DOI] |
| 62. | Yang CC, Wolf DA. Inflamed snail speeds metastasis. Cancer Cell. 2009;15:355-357. [PubMed] [DOI] |