修回日期: 2017-02-23
接受日期: 2017-03-06
在线出版日期: 2017-03-28
探讨异常胆液质载体溃疡性结肠炎大鼠结肠组织中炎症相关因子白介素(interleukin, IL)-1α、IL-1β、IL-10在异常胆液质载体溃疡性结肠炎病证发生、发展中的作用.
根据维吾尔医学体液理论建立异常胆液质载体证候模型的基础上, 采用2,4,6-三硝基苯磺酸(trinitro-benzene-sulfonic acid, TNBS)/乙醇法构建异常胆液质载体溃疡性结肠炎(ulcerative colitis, UC)病证大鼠模型, 并进行鉴定, 应用实时荧光定量逆转录聚合酶链反应(quantitative reverse transcription-polymerase chain reaction, qRT-PCR)方法, 检测正常组与异常胆液质载体UC病证模型组(模型组)大鼠结肠组织中IL-1α、IL-1β、IL-10 mRNA表达水平, 并分析其表达差异.
模型鉴定与HE染色结果显示, 模型组大鼠体征、症状、结肠黏膜损伤等均符合异常胆液质载体UC病证模型的判定标准; qRT-PCR结果显示, 与正常组比较, 模型组大鼠结肠组织中IL-1α、IL-1β、IL-10的mRNA表达水平均上调, 差异有统计学意义(P<0.05).
异常胆液质载体UC病证模型组大鼠结肠组织中存在炎症相关因子平衡紊乱.
核心提要: 异常胆液质载体溃疡性结肠炎(ulcerative colitis, UC)病证模型组大鼠结肠组织中抗炎细胞因子和促炎细胞因子之间平衡紊乱, 与以往研究中UC模型相比异常胆液质载体UC病证模型中白介素-1β的表达量更高.
引文著录: 布威阿依谢姆·依迪斯, 卡思木江·阿西木江, 张景萍, 希林古·吾守尔, 阿布来提·阿合买提, 黄静静, 麦热拍提·阿卜杜拉, 阿地拉·阿不都艾尼, 库热西·玉努斯. IL-1、IL-10 mRNA在异常胆液质载体溃疡性结肠炎大鼠结肠组织中的表达. 世界华人消化杂志 2017; 25(9): 775-782
Revised: February 23, 2017
Accepted: March 6, 2017
Published online: March 28, 2017
To investigate the role of interleukin (IL)-1α, IL-1β and IL-10 in the pathogenesis and development of ulcerative colitis in rats with abnormal sapra syndrome.
A rat model of abnormal sapra syndrome was used to develop UC using trinitro-benzene-sulfonic acid (TNBS)/ethanol. Quantitative reverse transcription-polymerase chain reaction (qRT-PCR) was used to detect the differences in IL-1α, IL-1β and IL-10 mRNA expression levels in the colonic tissues between normal rats (control group) and UC rats with abnormal sapra syndrome (model group).
Rat signs, symptoms and colonic mucosa damage suggested that UC with abnormal sapra syndrome was successfully induced. qRT-PCR results showed that compared with the normal group, the expression of IL-1α, IL-1β and IL-10 mRNAs was significantly up-regulated in the model group (P < 0.05).
Imbalance of inflammatory factors may occur in colon tissue of UC rats with abnormal sapra syndrome.
- Citation: Buweiayixiemu•Yidisi, Kasimujiang•Aximujiang, Zhang JP, Xilinguli•Wushouer, Abulaiti•Ahemaiti, Huang JJ, Mairepaiti•Abodula, Adila•Abuduaini, Kurexi•Yunusi. Expression of IL-1 and IL-10 mRNAs in colonic tissue of ulcerative colitis rats with abnormal sapra syndrome. Shijie Huaren Xiaohua Zazhi 2017; 25(9): 775-782
- URL: https://www.wjgnet.com/1009-3079/full/v25/i9/775.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i9.775
溃疡性结肠炎(ulcerative colitis, UC)是一种发病机制复杂的慢性非特异性炎症性疾病, 他病变多位于乙状结肠和直肠, 也可延伸至降结肠, 甚至整个结肠. UC是肠道菌群平衡在遗传易感性宿主中失调而产生异常免疫应答的结果[1-3]. 其发展的分子病因涉及免疫、遗微生物、环境等多种因素, 并免疫系统在UC的发生发展中起关键性的作用[4,5]. 其中细胞因子的作用尤为重要, 促炎和抗炎细胞因子在调节肠道免疫、炎症反应中起关键作用, 在UC的发病过程中有重要的意义和作用[6,7]. 各种细胞因子表达水平的异常或两类因子之间的平衡失调, 均可导致UC的发生. 因此, 探讨细胞因子在UC发病过程中的表达调控机制对于从根本上防治UC具有十分重要的意义.
维吾尔医学体液论是维医认识人体正常生理功能和病理过程的主要理论依据, 体液论认为体液是人体摄入的营养物质通过肝脏和各种腺体的加工而形成的复杂液体. 维医将人体中的体液分为黑胆质、血液质、黏液质、胆液质4种体液组成. 各体液质在各自的数量和质量上保持着相对稳定平衡的状态并为体内各细胞、组织、器官及系统发挥正常生理功能提供稳定的内环境, 最终维持生命的正常延续[8], 所以他是维持机体健康状态的基础. 体液的异常变化是疾病发生的土壤、是疾病产生的根本所在, 不良饮食、不良环境、感染、精神状态异常(焦虑、忧郁、愤怒、恐惧感等)等内外因素的长期作用会影响体液质的生成及其调节过程, 可使体液发生结构上的失衡、数量或质量的异常变化, 产生相应的异常体液质(异常血液质、异常黏液质、异常胆液质和异常黑胆质). 在肝脏形成的胆液质一部分浓缩于胆囊, 而绝大部分通过肝静脉运输到下腔静脉, 他不仅参与营养物质的提供、消化和吸收(促进脂类物质的分解), 而且具有防毒、解毒的作用, 并帮助加快其他体液质的运输, 参与免疫调节[8-10]. 异常胆液质强烈刺激胃和胰腺, 使胃肠黏膜发生炎症, 若进一步发展会造成胃、肠溃疡等疾病, 因此异常胆液质旺盛可诱发UC[11]. 文献报道[12]129例UC患者中异常黑胆质型患者占20.93%, 异常血液质型患者占16.28%, 异常黏液质型患者占18.60%, 异常胆液质型患者占44.19%, 异常胆液质型UC患者最多, 说明异常胆液质体液是UC发生的易感因素, 但其具体机制尚不清楚.
因此本研究在维吾尔医学理论的指导下建立异常胆液质载体溃疡性结肠炎病证大鼠模型, 检测大鼠结肠组织中炎症相关因子IL-1α、IL-1β、IL-10的mRNA表达水平的变化, 并探讨其在异常胆液质载体溃疡性结肠炎病证发生、发展过程中的作用, 进一步为方药干预UC奠定基础.
1.1 材料 健康的SPF级♂、体质量200 g±30 g之间的Wistar大鼠20只(由新疆医科大学实验动物中心提供). 黑胡椒、干姜、西红花(由新疆维吾尔自治区维吾尔医院提供). TNBS(Sigma, 美国, 批号: #SLB 6263V), RNA提取试剂TRIzol购自Invitrogen公司, 逆转录试剂盒购自美国Thermo, 2×SYBR-Green Mix购自德国QIAGEN, 2×Taq PCR MasterMix购自北京TIANGEN, 核酸染料GoldenView, 琼脂糖(BIOWEST, 西班牙), 水合氯醛、生理盐水, 无水乙醇、液体石蜡、乙醚, 甲醛, 异丙醇、氯仿, 引物借助Primer 5.0软件设计, 由华大基因科技服务总部合成. 仪器设备: FLI-2999HT型人工气候箱; 梯度PCR仪(BIO-RAD inCyclerTM Thermal Cycler, 美国); 实时荧光定量PCR仪(ABI 7500 Real-Time PCR, 美国); 低温高速离心机(Eppendorf centrifuge 5417R, 德国); 凝胶成像仪(BIO-RAD, 美国); 超微量分光光度计(Thermo Scientific NanoDrop 2000c, 美国); -80 ℃超低温冰箱(Thermo Forma 900 series, 美国).
1.2.1 动物分组: 将动物适应性喂养1 wk以后, 完全随机法随机分为正常组(10只)、异常胆液质载体UC病证组(10只).
1.2.2 异常胆液质载体UC病证模型组: (1)异常胆液质证的建立. 异常胆液质载体UC病证组(模型组)按照黄静静等[13]的研究方法, 建立并鉴定异常胆液质载体动物模型. 正常组(对照组)大鼠室内温度不受任何刺激也不做任何处理; (2)异常胆液质载体UC病证模型组的构建. 异常胆液质证建立成功后, 在此基础上, 建立UC模型. 造模前1 d禁食; 大鼠以10%水合氯醛0.3 mL/100 g的剂量腹腔注射麻醉后, 在液体石蜡的润滑下, 用输液导管(直径3 mm, 长度约8 cm)经肛门轻缓插入大鼠结肠内约8 cm处, 注入70 mg/kg 2,4,6-三硝基苯磺酸(trinitro-benzene-sulfonic acid, TNBS)加入等体积50%乙醇的灌肠液, 将大鼠头倒放置1 min, 然后保持平躺自然清醒. 观察24 h之后处理动物并收集标本.
1.2.3 标本的收集: 用乙醚麻醉, 从腹主动脉取血; 取距肛门5-8 cm的结肠组织, 沿肠系膜缘剪开, 用生理盐水冲洗干净后并将结肠展开, 黏膜表面朝上, 进行肉眼观察结肠黏膜损伤, 按评分标准评分(表1); 剪取病灶部位取材, 一部分约0.5 cm×0.5 cm立即置于40 g/L甲醛溶液固定, 石蜡包埋切片, HE染色, 进行病理组织学观察, 按文献[14]所述评分标准进行评分(表1)以盲法阅组织切片; 结肠组织装在冻存管后均置于-80 ℃冰箱保存, 备用.
| 分值 | 肉眼观察结肠黏膜损伤程度 | 镜下组织病理学观察 | ||
| 上皮细胞 | 炎细胞 | 黏膜 | ||
| 0 | 肠壁无损伤 | 形态正常 | 没有炎细胞浸润 | - |
| 1 | 肠壁轻度充血、水肿, 表面光滑, 无糜烂或溃疡 | 有杯状细胞丢失 | 炎细胞浸润至黏膜基底层 | 黏膜正常或基本正常, 形成肉芽组织伴纤维化 |
| 2 | 肠壁充血水肿, 黏膜粗糙呈颗粒感, 有糜烂或肠黏连 | 杯状细胞大面积丢失 | 炎细胞浸润至黏膜肌层, 有大量慢性炎性细胞浸润 | 上皮覆盖不全 |
| 3 | 肠壁黏膜充血水肿, 表面有坏死及溃疡形成, 大纵径<1 cm, 肠壁增厚或表面有坏死及炎症 | 杯、柱状细胞丢失 | 浸润深入到黏膜下层, 有大量中性粒细胞浸润 | 有溃疡形成, 伴随黏膜增厚和明显水肿 |
| 4 | 肠壁高度充血水肿, 黏膜坏死及溃疡形成, 溃疡最大纵径≥1 cm, 或全壁结肠坏死、中毒性巨结肠导致死亡; 病变范围每增加1 cm, 计分加1 | 杯、柱状细胞大面积丢失 | 浸润到达黏膜下层 | - |
1.2.4 实时荧光定量逆转录聚合酶链反应: (1)结肠组织总RNA的提取. 采用经典的TRIzol法提取大鼠结肠组织总RNA. 按TRIzol试剂说明书进行. 所有试剂及耗材均要求无DNA和RNA酶; (2)总RNA的鉴定. 在含核酸染料的1%琼脂糖凝胶进行RNA电泳. 电泳条件: 80 V进样5 min, 50 V电泳40 min. 在紫外灯下观察结果, 并通过凝胶成像仪获取图像. 检测浓度及纯度: 应用NanoDrop超微量分光光度计测定RNA样品浓度以及260 nm/280 nm比值(比值应>1.8), 即纯度; (3)引物序列的设计与合成. 在Genbank中寻找β-actin、IL-1α、IL-1β、IL-10的mRNA序列, 采用Primer5.0软件设计引物, 由华大基因技术服务总部合成引物. 引物序列如表2; (4)实时荧光定量RT-PCR检测. 取1 μg总RNA以Thermo反转录试剂盒进行DNA消化并RNA反转录为cDNA. 然后在梯度PCR仪上进行对cDNA的质检、对引物退火温度以及引物量的摸索, 最后以合成的cDNA为模板, 以β-actin为内参照在ABI 7500 Real-time PCR仪上进行PCR扩增, qPCR反应体系为: 2×SYBR-Green Reaction Mix 10 μL, 上下引物各0.5 μL(IL-10上下引物各0.3 μL), cDNA模板1 μL, 加ddH2O补足体系至20 μL, 反应程序: 预变性95 ℃10 min, 95 ℃15 s+退火温度1 min, 循环40次. 记录各样本对应的Ct值.
| 基因 | 引物序列 | 扩增产物长度(bp) | 退火温度(℃) |
| IL-1α | 上游: ACATGTATGCCTACTCATCGGG | 127 | 57 |
| 下游: TCCGGAATCTCCTTCAGCCAAC | |||
| IL-1β | 上游: AGGAGAGACAAGCAACGACAA | 122 | 57 |
| 下游: GTTTGGGATCCACACTCTCCA | |||
| IL-10 | 上游: GCTCAGCACTGCTATGTTGC | 183 | 67 |
| 下游: TGTTGTCCAGCTGGTCCTTC | |||
| β-actin | 上游: AGCCATGTACGTAGCCATCC | 115 | 57 |
| 下游: ACCCTCATAGATGGGCACAG |
统计学处理 数据应用SPSS17.0统计软件处理. 通过2-ΔΔCt法[15], 获取mRNA的相对表达量. 采用χ2检验和t检验, 数据以mean±SD表示, P<0.05为差异具有统计学意义.
异常胆液质证建立后, 与正常组相比, 一般状态发生了明显的变化, 比如舌苔干、黄, 毛发没有光泽, 易怒, 对刺激较敏感, 尿色深黄, 大便颗粒状、略硬等. 异常胆液质载体UC病证成功建立后, 与正常组相比, 异常胆液质载体UC病证组大鼠的活动明显减少, 体质量减轻, 精神萎靡, 喜欢蜷缩, 毛色暗淡无光泽, 可出现稀便、黏液便、脓液便以及血便.
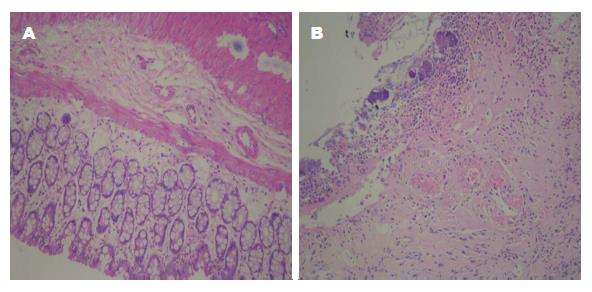
与正常组相比模型组大鼠结肠黏膜明显有充血水肿, 肠黏连、溃疡形成, 严重者溃疡最长径介于1-2 cm之间, 黏膜坏死以及肠壁增厚. 病理切片结果显示: 黏膜上皮细胞坏死脱落, 腺体脱落, 纤维素渗出, 隐窝细胞大面积丢失, 炎细胞浸润达到黏膜下层, 中性粒细胞浸润, 脱落处部分区域淋巴滤泡增生, 溃疡形成, 重者溃疡深达黏膜下层及肌层, 伴有个别黏膜腺体核大、深染、增生(图1); 如表3所示, 正常组与模型组病理学评分分级有统计学差异(P<0.05).
维医认为溃疡性结肠炎是由于人体气质及体液平衡失调, 各个支配器官功能失调, 环境、饮食、遗传因素等多种内外因素相互共同作用引起的全身性疾病[16]. 目前, 对于UC的发病机制尚缺乏一个完整的阐述. 但已确定UC的发病机制涉及环境, 肠道菌群, 免疫系统和遗传4个基本要素[17-19]. 其中免疫系统方面的研究, 特别是自身免疫学说更为广泛地受到关注, 尤其是UC作为一种全身性疾病, 有许多细胞因子参与结肠黏膜的炎症免疫反应, 而且与UC的发病及严重程度密切相关[20].
异常胆液质证人群白细胞计数(主要是淋巴细胞)和血红蛋白数量都减少, 导致体内抗炎、抗病毒作用、免疫功能、能量生成等均会受到影响, 因此比较好发消化系统疾病[21,22]. 本课题组前期研究结果表明, 异常胆液质载体证候模型组大鼠结肠组织黏膜及黏膜下层存在炎细胞浸润、淋巴细胞浸润形成滤泡, 存在细胞膜模糊不清、细胞间隙增宽、柱状细胞和杯状细胞出现异常、线粒体空泡变等超微结构的变化. 说明干热环境、慢性电刺激等复合因素可能诱发异常胆液质证大鼠结肠组织的炎症反应[13]. 因此进一步研究异常胆液质载体溃疡性结肠炎中细胞因子的表达, 对探讨异常胆液质载体溃疡性结肠炎病证发生、发展具有重要意义.
细胞因子包括促炎因子和抗炎因子, 二者在UC的发病过程中有重要的意义和作用. 促炎因子与抗炎因子之间的平衡失调被视为UC的一个重要发病机制[7].
IL-1细胞因子是与免疫调节、炎症和组织损伤密切相关的重要介质. IL-1家族成员众多, 主要包括IL-1α、IL-1β和IL-1受体拮抗剂(IL-lRa). IL-1α、IL-1β结合相同的受体, 并发挥相同的生物活性, 但其产生和分泌的方式有区别. IL-1在炎症或应激条件下主要由髓系细胞产生、分泌, 其中最主要是单核细胞和巨噬细胞[23]. 本实验结果显示, 异常胆液质载体UC病证组大鼠结肠组织中IL-1α、IL-1β的mRNA表达水平均上调, 此外, L-1β的mRNA表达水平高于IL-1α. IL-1反作用于巨噬细胞和T淋巴细胞, 促进IL-2、IFN-γ、IL-8等更多炎性细胞因子的释放; 还具有吸收中性粒细胞等炎性细胞进入肠道黏膜, 促使其产生炎症趋化作用[6]. IL-1在免疫调节和炎症过程中通过诱导许多效应蛋白的表达而起重要作用, 例如细胞因子/趋化因子、环氧合酶2(cyclooxygenase-2, COX-2)、一氧化氮合酶(inducible nitric oxide synthase, iNOS)和基质金属蛋白酶(matrix metalloproteinase, MMP)[24]. 通过在内皮细胞、基质细胞和白细胞上增加整合素的表达从而促进炎症细胞浸润, 诱发组织发生炎症反应[23]. IL-1β可激活T淋巴细胞和B淋巴细胞, 增强NK细胞活性, 从而上调免疫功能. 更重要的是, IL-1β促使中性粒细胞和巨噬细胞活化, 促进炎性细胞释放前列腺素、血栓素、血小板活化因子等, 从而增加上皮细胞和内皮细胞的通透性[25].
IL-10是重要的多效性免疫调节细胞因子, 由巨噬细胞、T辅助1(Th1)、Th2淋巴细胞、树突细胞、细胞毒性T细胞、单核细胞和肥大细胞分泌. IL-10的免疫调节活性基于其抑制细胞因子合成和抗原递呈的能力[26]. IL-10的主要生物学功能是抑制IL-1β、IL-2、IL-4、IL-5、IL-6 、IL-8、TNF-α、IFN-γ、单核细胞炎症蛋白-1α(macrophage inflammatory protein-1 alpha, MIP-1α)、嗜酸粒细胞趋化因子以及iNOS、COX-2等的分泌和调节几种免疫细胞的分化与增殖, 减少组织相容性复合物(major histocompatibilty complex, MHC)增加IL-1受体拮抗剂、可溶性TNF-α受体和MMP的组织抑制剂等几种抗炎蛋白的表达, 从而限制和终止炎症反应[27-30].
研究[31]发现, UC模型组大鼠结肠组织中IL-1β mRNA第1天和第3天的表达量分别为正常组的87倍和159倍; IL-10 mRNA第1天和第3天的表达量分别为正常组的36倍和70倍, 且第3天他们的表达量达到高峰. 本研究发现, 与正常组相比, 模型组结肠组织中IL-1α、IL-1β、IL-10 mRNA表达水平均上调, 差异有统计学意义, 尤其是IL-1α、IL-1β的mRNA表达上调水平分别为正常组的137倍、291倍, 也明显高于IL-10, IL-10的上调水平为正常组的10倍. 说明, 促炎和抗炎细胞因子之间平衡失调, 且促炎因子的作用占优势, 因此IL-1α、IL-1β表达上调有利于炎性始动因子的作用, 同时可使黏膜充血、水肿、屏障功能减弱, 引起肠道细菌移位, 从而加重肠黏膜炎症[25].
本研究表明, 异常胆液质载体UC病证模型组大鼠结肠组织中存在抗炎细胞因子和促炎细胞因子之间平衡紊乱. 抗炎因子和促炎因子的平衡失调是UC发生发展的诱发因素. 提示抗炎因子和促炎因子的平衡关系为UC的方药干预治疗和研究提供靶点.
溃疡性结肠炎(ulcerative colitis, UC)作为一种全身性疾病, 有许多细胞因子参与结肠黏膜的炎症免疫反应, 而且与UC的发病及严重程度密切相关, 维吾尔医学认为异常胆液质型人群易患胃肠炎、胃肠溃疡、胆囊炎、胰腺炎、肝炎、肝硬化、阑尾炎等消化系统疾病. 有关文献报道UC患者中异常胆液质型UC患者最多, 异常胆液质是UC的易感因素, 异常胆液质旺盛可诱发UC, 因此进一步研究异常胆液质载体溃疡性结肠炎中细胞因子的表达, 对探讨异常胆液质载体溃疡性结肠炎病证发生、发展以及对UC的治疗具有重要意义.
关于UC发病的免疫学机制研究目前较多是从细胞因子方面开展, 细胞因子是对UC研究的热点, 后续方药干预研究中作者可以通过检测并分析炎症相关细胞因子的表达水平来判断疗效、研究药物作用靶点和药物作用的分子生物学机制.
(1)维医认为溃疡性结肠炎是由于人体气质及体液平衡失调、各个支配器官功能失调、环境、饮食、遗传因素等多种内外因素相互共同作用引起的全身性疾病; (2)体液的异常变化是疾病发生的土壤、是疾病产生的根本所在. 维医疾病治疗原则是根据引起疾病的异常体液的性质, 调节体液质的数量、质量及他们之间的关系, 首先使异常体液排出体外, 使气质复原、体液平衡, 达到治疗目的; (3)异常胆液质证人群白细胞计数(主要是淋巴细胞)和血红蛋白数量都减少, 导致体内抗炎、抗病毒作用、免疫功能、能量生成等均会受到影响, 因此比较好发现消化系统疾病; (4)细胞因子与抗炎细胞因子之间的平衡失调被视为UC的一个重要发病机制.
本研究表明在异常胆液质载体UC病证模型组大鼠结肠组织中存在抗炎细胞因子和促炎细胞因子之间平衡紊乱. 抗炎因子和促炎因子的平衡失调是UC发生发展的诱发因素. 本研究发现异常胆液质载体溃疡性结肠炎大鼠结肠组织中白介素(interleukin, IL)-1α、IL-1β、IL -10的mRNA表达水平均上调, 其中IL-1β的表达水平比以往研究中UC模型IL-1β的表达水平高.
本文不仅在研究异常胆液质载体溃疡性结肠炎病证发生、发展过程中具有重要意义, 还有进一步为方药干预UC奠定基础. 此外在研究UC发病机制及发展中有重要意义.
胆液质: 所摄取的干热性食物被消化后通过肝脏和各种腺体的加工生成一种颜色略黄、味极苦的体液, 属性干热. 其一部分浓缩于胆囊, 而绝大部分通过肝静脉运输到下腔静脉, 他不仅参与营养物质的提供、消化和吸收(促进脂类物质的分解), 而且具有防毒、解毒的作用, 并帮助加快其他体液质的运输, 参与免疫调节;
异常胆液质: 正常胆液质由于各种内外因素作用下质量和数量上发生变化, 从而变成为相应疾病的发生创造内环境的异常体液;
异常胆液质载体UC: 又称异常胆液质型UC, 异常胆液质的基础上形成的溃疡性结肠炎.
迟雁, 副教授, 北京大学第一医院消化内科
本文进行了异常胆液质载体溃疡性结肠炎模型的构建并监测了其结肠组织中炎性因子和抗炎性因子的表达, 有一定的价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 新疆维吾尔自治区
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑:闫晋利 电编:李瑞芳
| 1. | Chretien PB, Lipson SD, Makuch R, Kenady DE, Cohen MH, Minna JD. Thymosin in cancer patients: in vitro effects and correlations with clinical response to thymosin immunotherapy. Cancer Treat Rep. 1978;62:1787-1790. [PubMed] [DOI] |
| 2. | Danese S, Fiocchi C. Etiopathogenesis of inflammatory bowel diseases. World J Gastroenterol. 2006;12:4807-4812. [PubMed] |
| 3. | Khor B, Gardet A, Xavier RJ. Genetics and pathogenesis of inflammatory bowel disease. Nature. 2011;474:307-317. [PubMed] [DOI] |
| 4. | Yang H, Rotter JI, Toyoda H, Landers C, Tyran D, McElree CK, Targan SR. Ulcerative colitis: a genetically heterogeneous disorder defined by genetic (HLA class II) and subclinical (antineutrophil cytoplasmic antibodies) markers. J Clin Invest. 1993;92:1080-1084. [PubMed] [DOI] |
| 5. | Yamamoto-Furusho JK, Uscanga LF, Vargas-Alarcón G, Ruiz-Morales JA, Higuera L, Cutiño T, Rodríguez-Pérez JM, Villarreal-Garza C, Granados J. Clinical and genetic heterogeneity in Mexican patients with ulcerative colitis. Hum Immunol. 2003;64:119-123. [PubMed] [DOI] |
| 7. | Anand AC, Adya CM. Cytokines and inflammatory bowel disease. Trop Gastroenterol. 1999;20:97-106. [PubMed] |
| 8. | 哈木拉提·吾甫尔, 阿不都热依木·玉苏甫. 维吾尔基础理论学. 新疆人民卫生出版社. 2011;125-135. |
| 9. | 哈木拉提·吾甫尔. 维医气质、体液论及其现代研究. 新疆科技出版社. 2003;51-52. |
| 10. | 买买提明·沙比尔. 维吾尔医学诊断学. 新疆科技卫生出版社. 1993;224-229. |
| 11. | 张景萍, 买提哈斯木·吾布力艾山, 黄静静, 钟莉, 卡思木江·阿西木江, 许晨波, 吴桂霞, 麦日排提·阿卜杜拉, 哈木拉提·吾甫尔, 库热西·玉努斯. 维吾尔医异常胆液质载体证候大鼠结肠代谢组学研究. 新疆医科大学学报. 2016;39:1363-1367. |
| 12. | 阿衣努尔·买提斯迪克, 吾尔古丽·阿卜杜来海提, 哈木拉提·吾甫尔, 肉孜巴克·阿吉. 129例溃疡性结肠炎患者维医异常体液分型的量化诊断入选项专家咨询研究. 科技导报. 2013;31:64-70. |
| 13. | 黄静静, 张景萍, 李小溪, 湛文博, 卡思木江·阿西木江, 哈木拉提·吾甫尔, 库热西·玉努斯. 维医异常胆液质载体症候大鼠模型的建立. 新疆医科大学学报. 2016;39:1353-1358. |
| 14. | Obermeier F, Dunger N, Strauch UG, Grunwald N, Herfarth H, Schölmerich J, Falk W. Contrasting activity of cytosin-guanosin dinucleotide oligonucleotides in mice with experimental colitis. Clin Exp Immunol. 2003;134:217-224. [PubMed] [DOI] |
| 15. | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2[-Delta Delta C(T)] Method. Methods. 2001;25:402-408. [PubMed] [DOI] |
| 16. | 哈木拉提·吾甫尔, 阿不都热依木·卡地尔. 维吾尔医药及其他传统医学研究与应用. 新疆人民卫生出版社. 2003;39-40. |
| 17. | Sartor RB. Mechanisms of disease: pathogenesis of Crohn's disease and ulcerative colitis. Nat Clin Pract Gastroenterol Hepatol. 2006;3:390-407. [PubMed] [DOI] |
| 18. | Fiocchi C. Future of IBD pathogenesis: how much work is left to do? Inflamm Bowel Dis. 2008;14 Suppl 2:S145-S147. [PubMed] [DOI] |
| 19. | Kaser A, Zeissig S, Blumberg RS. Inflammatory bowel disease. Annu Rev Immunol. 2010;28:573-621. [PubMed] [DOI] |
| 22. | 帕丽旦·麦麦提, 甫拉提·吐尔逊, 买买提卡斯木·吾布力艾山, 哈木拉提·吾甫尔, 努尔比亚·吾布力, 库热西·玉努斯. 维吾尔医学异常体液与血常规相关性研. 新疆医科大学学报. 2014;14:3104-3106. |
| 23. | Voronov E, Dotan S, Krelin Y, Song X, Elkabets M, Carmi Y, Rider P, Idan Cohen M, Kaplanov I, Apte RN. Unique Versus Redundant Functions of IL-1α and IL-1β in the Tumor Microenvironment. Front Immunol. 2013;4:177. [PubMed] [DOI] |
| 24. | Dinarello CA. The IL-1 family and inflammatory diseases. Clin Exp Rheumatol. 2002;20:S1-S13. [PubMed] |
| 25. | Zhang JX, Dang SC, Qu JG, Wang XQ, Chen GZ. Changes of gastric and intestinal blood flow, serum phospholipase A2 and interleukin-1beta in rats with acute necrotizing pancreatitis. World J Gastroenterol. 2005;11:3578-3581. [PubMed] [DOI] |
| 26. | Hyun MH, Lee CH, Kang MH, Park BK, Lee YH. Interleukin-10 promoter gene polymorphisms and susceptibility to asthma: a meta-analysis. PLoS One. 2013;8:e53758. [PubMed] [DOI] |
| 27. | Rosenwasser LJ, Borish L. Genetics of atopy and asthma: the rationale behind promoter-based candidate gene studies (IL-4 and IL-10). Am J Respir Crit Care Med. 1997;156:S152-S155. [PubMed] [DOI] |
| 28. | Peng H, Wang W, Zhou M, Li R, Pan HF, Ye DQ. Role of interleukin-10 and interleukin-10 receptor in systemic lupus erythematosus. Clin Rheumatol. 2013;32:1255-1266. [PubMed] [DOI] |
| 29. | Borish L. IL-10: evolving concepts. J Allergy Clin Immunol. 1998;101:293-297. [PubMed] [DOI] |
| 30. | Trifunović J, Miller L, Debeljak Ž, Horvat V. Pathologic patterns of interleukin 10 expression--a review. Biochem Med (Zagreb). 2015;25:36-48. [PubMed] [DOI] |
| 31. | 李 进, 杨 锐, 邓 豫, 蔡 少鑫, 曹 小年, 李 小兰, 陶 德定, 胡 俊波. IL-1β、IL-10在大鼠溃疡性结肠炎模型中的表达. 南昌大学学报(医学版). 2010;12:41-45. |