修回日期: 2017-11-21
接受日期: 2017-11-26
在线出版日期: 2017-12-28
评价美沙拉嗪不同给药方式在治疗轻中度溃疡性结肠炎(ulcerative colitis, UC)中的疗效差别及影响因素.
将2012-07/2015-05中山大学附属第六医院收治的轻中度UC 227例, 依据给药方式分为口服、局部和联合组; 比较组间短期和长期药物治疗疗效(χ2检验), 并对影响因素行Logistic回归分析.
短期疗效评价时, 口服组总有效率76.00%、局部组79.31%、联合组93.64%; 联合组最高, 三组差异具统计学意义(χ2 = 8.662, P = 0.003和χ2 = 6.618, P = 0.010); 长期评价时, 总有效率分为62.50%、73.08%、91.84%, 虽与短期有效率相比均无统计学差异, 但单一组长期完全缓解率呈降低趋势(口服28% vs 12.50%, 局部34.48% vs 15.38%), 联合组疗效更趋稳定(51.02% vs 50.87%). Logistic分析显示, 仅给药方式是影响该药疗效的独立风险因素.
美沙拉嗪治疗轻中度UC有效, 推荐联合用药, 疗效优于单一方式.
核心提要: 研究已证实美沙拉嗪对溃疡性结肠炎的治疗效应, 但尚缺标准化应用指导. 本研究基于长短期疗效, 将与该药相关的多种风险因素, 如给药方式、疾病的范围、程度均纳入评估, 提出了多途径联合给药方式优于单一方式的治疗观点.
引文著录: 胡俊, 谌黄威, 张敏, 梁春妙, 张媛琪, 郅敏. 美沙拉嗪不同给药方式治疗溃疡性结肠炎的疗效评估. 世界华人消化杂志 2017; 25(36): 3203-3210
Revised: November 21, 2017
Accepted: November 26, 2017
Published online: December 28, 2017
To compare the curative effect of three different routes of mesalazine administration in the treatment of patients with mild to moderate ulcerative colitis (UC).
A total of 227 mild to moderate UC cases were recruited at the Sixth Affiliated Hospital of Sun Yat-sen University from July 2012 to May 2015. Oral, topical, or combined route of administration of mesalazine was adopted. At 30 d and 1 year after treatment, clinical efficacy was compared among different groups, and related epidemiological risk factors were retrospectively identified.
For all the included UC patients, the total effective rate at 30 d was 76.00% for the oral medication group, 79.31% for the local group, and 93.64% for the combined group, and there was a significant difference in the total effective rate between the oral and combined groups (χ2 = 8.662, P = 0.003) and between the local and combined groups (χ2 = 6.618, P = 0.010), but not between the oral and local groups. At 1 year, the effective rates of the three groups were 62.50%, 73.08%, and 91.84%, respectively. For each administration route, there was no significant difference in the effective rate between long-term and short-term observation. However, the long-term complete remission rate in the single-route groups showed an obviously decreasing trend (oral 28% vs 12.50%, local 34.48% vs 15.38%), while the curative effect in the combined group was stable (51.02% vs 50.87%). Logistic regression analysis showed that administration route was an independent risk factor affecting the effect of mesalazine, while gender, age, smoking, BMI, disease duration, and lesion degree/range were not.
Mesalazine is an effective drug to treat mild to moderate UC. Combined oral/topical usage has higher efficacy than each of the two separate applications.
- Citation: Hu J, Chen HW, Zhang M, Liang CM, Zhang YQ, Zhi M. Curative effect of different routes of mesalazine administration in treatment of patients with ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2017; 25(36): 3203-3210
- URL: https://www.wjgnet.com/1009-3079/full/v25/i36/3203.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i36.3203
溃疡性结肠炎(ulcerative colitis, UC)是一种病因尚不十分清楚的直肠和结肠慢性非特异性炎症性疾病, 病变主要限于大肠黏膜和黏膜下层. 在我国UC的发病率呈现逐渐上升趋势, 且患者个体临床表现程度差别很大, 治疗UC的常用药物包括柳氮磺胺吡啶(salazosulfapyridine, SASP)、5-氨基水杨酸(5-aminosalicylic acid, 5-ASA)、激素、免疫抑制剂和生物制剂等, 但由于药物不良反应和经济等因素的影响, 激素、免疫抑制剂和生物制剂等的广泛使用仍受到一定程度的限制, 目前临床应用最为普遍和安全的是5-ASA和SASP制剂, 且以美沙拉嗪(mesalazine)为主的5-ASA较为常用.
关于美沙拉嗪目前被广泛接受的观点认为, UC治疗模式的选择依赖于疾病的定位与个体病情严重程度. 当UC病变局限于左半结肠, 美国和欧洲的专业机构推荐首选治疗方法都是该药的局部治疗[1,2]. 虽已有研究[3-6]指出, 在UC的治疗中, 美沙拉嗪联合用药效果优于单独口服用药, 但联合与单一方式用药(含局部用药)长期疗效对比的报道仍相对较少; 且由于东西方UC的流行病学、预后等的差异[7,8], 国内该方面的研究有待完善与充实. 基于此, 本研究回顾性的将中山大学附属第六医院炎症性肠病(inflammatory bowel disease, IBD)中心符合分析要求的227例轻中度活动期UC患者的治疗方案进行了分组, 针对不同给药方式进行了随访及长短期临床疗效评估, 以期深入了解提高美沙拉嗪应用效果的方法, 为其在国内的标准化治疗提供新的理论依据.
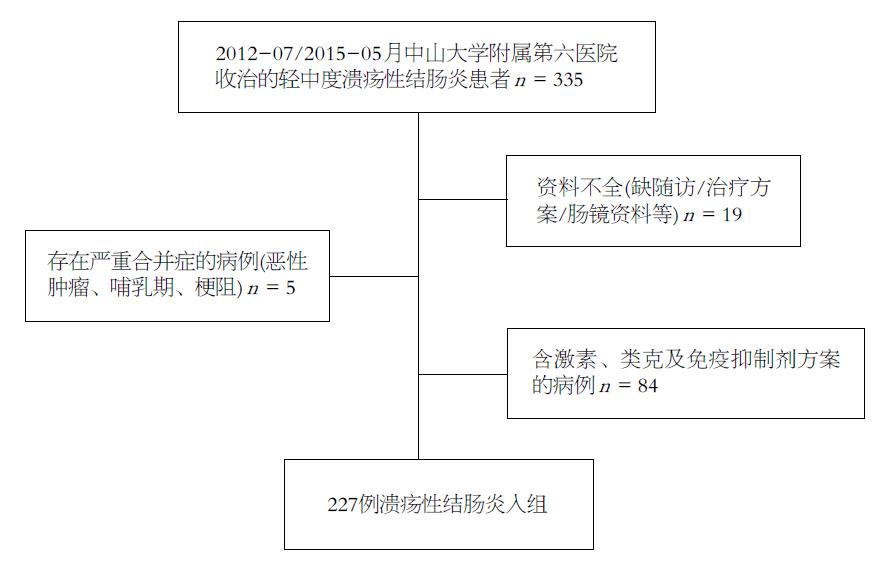
收集2012-07/2015-05中山大学附属第六医院IBD中心确诊的所有经美沙拉嗪治疗过的UC患者335例, 参考《IBD诊断与治疗的共识意见(2012年. 广州)》诊断标准[6], 病情处于轻中度活动期, 予以募集. 病例具体选取流程如图1. 病情程度判断标准如下, 轻度: 患者腹泻每日4次以下, 便血轻或无, 无发热、脉搏加快或贫血, 血沉正常; 中度: 介于轻度和重度之间; 重度: 腹泻6次/d以上明显黏液血便, 体温为37.5 ℃, 脉搏在90次/min 以上, 血红蛋白<100 g/L, 血沉>30 mm/h.
本研究中, 经半年随访未达到临床确诊或病理确诊者在统计时予以剔除, 同时排除缓解期、重症UC患者、对水杨酸类过敏者、伴随其他严重或进展性疾病者、有肠道切除手术史者、妊娠或哺乳期妇女、感染性肠炎者; 还要求入组患者在观察期间未同时应用激素、免疫抑制剂或生物制剂等其他治疗药物.
根据指南意见[6], 中山大学附属第六医院收治的UC患者, 根据病情, 使用的美沙拉嗪剂量为: 口服2.0-4.0 g/d; 局部用药包括栓剂和灌肠剂, 栓剂为"美沙拉嗪栓"(商品名: 莎尔福栓), 灌肠剂为"美沙拉嗪灌肠液"(商品名: 莎尔福灌肠液). 应用剂量为栓剂0.5-1.0 g/d, 灌肠液1.0-4.0 g/d; 联合治疗则同时应用了口服与局部给药. 本研究为回顾性研究, 关注的疗效风险因素包括: 患者性别、年龄、吸烟、体质量指数(body mass index, BMI)、病程时长、病变程度和病变范围.
参照指南对UC治疗规范的建议[6], 通过门诊复诊、电话随访的方式对其预后进行随访: 统计治疗30 d和1年后的临床疗效, 包括完全缓解和部分缓解, 从而计算总有效率. 根据以下客观标准进行评价[9]: (1)完全缓解: 临床症状完全好转, 包括大便次数≤2次/d, 无血便、腹痛、发热、体重下降或肠外表现; (2)部分缓解: 临床症状部分好转, 包括大便次数≤4次/d, 有血便、腹痛, 或大便次数较治疗前减少4次/d, 但无全身症状如发热、体质量下降或肠外表现; (3)无效: 临床症状无改善. 总有效率 = (完全缓解+部分缓解)/总例数. 依据药物使用剂量来判断最终疗效: (1)显效: 美沙拉嗪随访治疗30 d(1年)时出现治疗药物减量, 可维持临床缓解; (2)有效: 美沙拉嗪治疗后维持临床完全或部分缓解, 即患者使用美沙拉嗪维持原剂量可维持临床缓解; (3)无效: 使用美沙拉嗪治疗后不能达到临床缓解, 需增加药物剂量或改用激素、生物制剂、免疫抑制剂或手术等其他方案.
统计学处理 采用SPSS13.0软件进行统计学处理, 计量资料采用mean±SD差表示, 计数资料采用n(%)表示, 计量资料比较采用t检验, 多组比较采用one-way ANOVA检验; 计数资料用百分率(%)表示, 采用χ2检验或Fisher's确切概率法分析; 以Logistic回归法分析影响UC疗效的风险因素, P<0.05为差异有统计学意义.
227例UC患者中, 男性143例, 女性84例, 男女比例1.70:1, 年龄18-73岁, 平均年龄39.36岁±11.82岁, 平均病程7.45 mo±9.67 mo, 在病变范围上, 直肠型106例(46.70%), 左半结肠型69例(30.40%), 广泛结肠型52例(22.91%). 按照给药方式的不同, 分成口服组、局部用药组和联合用药组, 3组之间在性别、年龄、平均病程、平均BMI、吸烟率、病变程度等基线资料上无统计学差异(P>0.05). 由于本研究根据UC病变范围来决定用药方式, 因此在已有医疗背景下, 3组病变范围存在统计学差异(P = 0.000, 表1). 美沙拉嗪对不同病变范围UC患者的临床疗效: 根据UC患者的不同病变范围, 选择不同的美沙拉嗪给药方式, 结果发现, 治疗30 d后, 106例直肠型UC患者94例有效, 69例左半结肠型患者63例有效, 52例广泛结肠型患者47例有效, 总有效率分别为88.68%、91.30%、90.38%. 3组有效率比较, 差异无统计学意义(χ2 = 1.644, P = 0.801, 表2).
| 口服组 | 局部用药组 | 联合用药组 | 合计 | P值 | |
| 总例数(n) | 25 | 29 | 173 | 227 | |
| 性别 | |||||
| 男 | 13 | 12 | 111 | 143 | 0.478 |
| 女 | 12 | 10 | 62 | 84 | |
| 年龄(岁) | 41.64±12.68 | 39.48±11.07 | 39.01±11.84 | 39.36±11.82 | 0.582 |
| 平均病程(mo) | 3.64±3.84 | 5.93±8.61 | 7.82±10.02 | 7.11±9.43 | 0.090 |
| 平均BMI | 21.20±3.46 | 20.34±2.49 | 21.01±2.81 | 20.94±2.84 | 0.479 |
| 吸烟史 | |||||
| 有 | 6 (24.00) | 5 (17.24) | 43 (24.86) | 54 (23.79) | 0.672 |
| 无 | 19 | 24 | 130 | 173 | |
| 病变范围 | |||||
| 直肠型(≤18 cm) | 3 | 24 | 79 | 106 | 0.000 |
| 左半结肠型(18 cm<病变≤60 cm) | 7 | 4 | 58 | 69 | |
| 广泛结肠型(>60 cm) | 15 | 1 | 36 | 52 | |
| 病变程度 | |||||
| 轻度 | 16 | 26 | 137 | 179 | 0.069 |
| 中度 | 9 | 3 | 36 | 48 | |
| 分组 | n | 完全缓解 | 部分缓解 | 无效 | 总有效率 (%) | χ2值 | P值 |
| 直肠型 | 106 | 45 (42.45) | 49 (46.23) | 12 (11.32) | 88.68 | 1.644 | 0.801 |
| 左半结肠型 | 69 | 36 (52.17) | 27 (39.13) | 6 (8.70) | 91.30 | ||
| 广泛结肠型 | 52 | 24 (46.15) | 23 (44.23) | 5 (9.62) | 90.3 | ||
| 合计 | 227 | 105 (46.26) | 99 (43.61) | 23 (10.13) | 89.8 |
227例UC患者治疗30 d, 根据UC患者的不同病情, 按口服、局部、联合3种不同给药方式分组, 结果显示: 口服治疗组、局部用药组和联合用药组有效率分别为76.00%(19/25)、79.31%(23/29)和93.64%(162/173), 总有效率为89.87%. 其中, 口服组与局部组差别无统计学意义(χ2 = 0.085, P = 0.770); 联合用药组短期疗效优于口服组(χ2 = 8.662, P = 0.003)与局部用药组(χ2 = 6.618, P = 0.010, 表3), 差异有统计学意义.
随访1年末UC患者140例, 持续应答119例(85.00%), 其中完全缓解56例(40.00%), 部分缓解63例(45.00%), 无效21例(15.00%), 中位维持缓解时间为365 d. 3组给药方式的有效率分别为62.50%、73.08%和91.84%, 联合组分别与口服组、局部组比较均具统计学差异(χ2 = 10.989, P = 0.001和χ2 = 6.801, P = 0.009, 表4).
对比美沙拉嗪的短期和长期疗效发现, 口服组的长期完全缓解率低于短期(12.50% vs 28.00%, χ2 = 1.368, P = 0.242), 局部组的长期完全缓解率亦低于近期(15.38% vs 34.48%, χ2 = 2.635, P = 0.105), 但均无统计学差异; 而联合组的疗效也无明显变化(51.02% vs 50.87%, χ2 = 0.001, P = 0.981), 差异亦无统计学意义.
为了解UC患者美沙拉嗪治疗短期和长期疗效的影响因素, 本研究进行了Logistic回归分析, 结果显示, 性别、年龄、吸烟、BMI、病变时长、病变程度、病变范围均与美沙拉嗪对UC患者的疗效无显著性相关. 而给药方式与短期、长期疗效均具有显著相关, 且联合组较口服组、局部组均具有统计学差异(P<0.05), 其中, 短期疗效口服组和局部组的OR分别为0.22(95%CI: 0.07-0.65)和0.26(95%CI: 0.26-0.77), 长期疗效口服组和局部组的OR分别为0.15(95%CI: 0.04-0.51)和0.24(95%CI: 0.08-0.75), 提示联合组较口服和局部用药更有持续的疗效(表5).
| 变量 | 短期疗效 | 长期疗效 | ||
| P值 | OR (95%CI) | P值 | OR (95%CI) | |
| 性别 | ||||
| 男性 | 1.00 | 1.00 | ||
| 女性 | 0.26 | 1.75 (0.66-4.64) | 0.047 | 3.65 (1.02-13.09) |
| 年龄 | 0.94 | 1.00 (0.97-1.04) | 0.838 | 1.00 (0.97-1.04) |
| 吸烟与否 | ||||
| 不吸烟 | 1.00 | 1.00 | ||
| 吸烟 | 0.07 | 0.44 (0.18-1.08) | 0.233 | 2.53 (0.55-11.58) |
| BMI | 0.74 | 0.97 (0.84-1.13) | 0.349 | 0.93 (0.79-1.09) |
| 病变时长 | 0.29 | 1.04 (0.97-1.12) | 0.227 | 1.04 (0.98-1.10) |
| 病变程度 | ||||
| 轻度 | 1.00 | 1.00 | ||
| 中度 | 0.32 | 1.89 (0.54-6.64) | 0.637 | 0.77 (0.25-2.31) |
| 病变范围 | ||||
| 直肠和乙状结肠 | 1.00 | 1.00 | ||
| 左半结肠≤60 cm | 0.58 | 1.34 (0.48-3.76) | 0.973 | 1.02 (0.31-3.36) |
| 广泛结肠>60 cm | 0.75 | 1.20 (0.40-3.61) | 0.112 | 0.41 (0.14-1.23) |
| 治疗方式 | ||||
| 联合用药 | 1.00 | 1.00 | ||
| 口服 | 0.01 | 0.22 (0.07-0.65) | 0.003 | 0.15 (0.04-0.51) |
| 局部 | 0.02 | 0.26 (0.09-0.77) | 0.014 | 0.24 (0.08-0.75) |
近年来, UC的中国国内的发病率逐年升高, 目前中国的UC发病率为1.45/10万[7,8]. 但中国UC患者的病情较西方国家轻, 78.3%为轻中度, 重型少见, 仅占2.4%, 明显低于国外报道的15%[7,9]. 现时轻中度UC患者的治疗仍以5-ASA、SASP等水杨酸制剂为主. 相较于传统的SASP制剂, 5-ASA具有更佳的临床疗效、更小的不良反应[10-12], 因而在UC药物治疗方案中, 无论诱导期还是缓解期, 美沙拉嗪较其他药物在疗效及安全性方面更具优势, 被选用为诱导和维持UC缓解的常规药物[2]. 本研究结果显示, 大部分UC患者对美沙拉嗪有效, 轻中度UC患者的临床总有效率达到89.87%, 其中, 46.26%的患者达到完全缓解, 43.61%的患者达到部分缓解, 仅有10.13%的UC患者治疗无效, 说明美沙拉嗪在我国也是诱导轻中度活动期UC缓解的有效药物.
UC患者的治疗方式应个体化, 目前美沙拉嗪制剂有口服和局部多种剂型, 包括口服的颗粒剂、片剂和局部的栓剂、灌肠剂、泡沫剂、凝胶剂等, 针对不同病变程度和病变范围选用不同剂型, 并且应做好患者宣教, 增加患者的依从性[13,14]. 本研究227例轻中度UC患者中, 直肠型占46.70%, 左半结肠型占30.40%, 广泛结肠型占22.91%, 根据病变部位选择用药方式, 直肠型、左半结肠型和广泛结肠型患者的疗效分别达到88.68%、91.30%、90.38%, 3组之间疗效无统计学差异, 说明根据部位选择用药方式, 病变范围并不影响疗效.
在美沙拉嗪的给药方式方面, 既往有研究报道, 无论在直肠型、左半结肠型, 还是广泛结肠型的UC患者, 美沙拉嗪联合用药的临床疗效均较口服用药效果更佳[3,4,14]. 本研究中联合用药的UC患者短期有效率高达93.64%, 高于单独口服和单独局部用药组的76.00%和79.31%, 且联合组与口服组比较、联合组与局部组比较均具有统计学差异, 与Probert等[5]的报道一致. 而口服组与局部组比较无显著性差异, 这可能与本研究根据病变范围选择用药有关. 同时这些数据也表明, 中国UC患者对美沙拉嗪有较好的治疗反应. 此外, 我们还研究了使用美沙拉嗪维持治疗1年后的长期疗效, 结果发现, 口服、局部用药的有效率分别为62.50%、73.08%, 较近期疗效均有不同程度下降, 但均无统计学差异, 这与Kruis等[15]的研究结果相符, 而联合组的有效率仍高达91.84%. 说明随着治疗时间的延长, 口服、局部的临床疗效均有较明显的下降, 而联合组不但疗效更佳, 且无明显下降(93.64% vs 91.84%), 效果更稳定.
通常影响UC结局的因素包括年龄、吸烟、病变程度和病变范围等[16-19], 发病年龄较轻或有IBD家族史者疗效欠佳, 吸烟则是UC的保护性因素, 而病变程度和病变范围与UC的预后有较明显的相关性. 我们对应用美沙拉嗪后影响UC疗效的因素进行Logistic分析发现, 年龄、吸烟均与用药后的疗效无明显相关性, 本研究并未发现病变程度与疗效的相关性, 可能与入组的病例均为轻中度活动期有关. 本研究亦未发现病变范围与UC疗效的显著性关系, 推测可能与不同的给药方式倾向有关, 且不同病变范围的总有效率均较高, 反应良好.
同时我们还发现, 给药方式是UC短期和长期疗效的显著性影响因素, 且联合组较口服组、局部组均具有统计学差异(P<0.05), 口服组和局部组的短期疗效OR分别为0.22(95%CI: 0.07-0.65)和0.26(95%CI: 0.26-0.77), 长期疗效的OR分别为0.15(95%CI: 0.04-0.51)和0.24(95%CI: 0.08-0.75), 提示在有效性方面, 无论是短期还是长期, 联合组较口服组和局部组均更加强大.
总之, 本研究比较了美沙拉嗪不同给药方式对轻中度UC治疗30 d和1年的临床疗效, 发现联合用药较单一口服或局部应用具有更好的疗效, 中国UC患者对美沙拉嗪的反应效果良好, 不同病变范围之间疗效无明显统计学差异; 通过统计分析显示, 给药方式是影响短期和长期疗效的显著因素, 且联合用药较单一口服或局部美沙拉嗪效果更佳, 但由于本研究为回顾性分析, 在病例的选择方面具有一定局限性, 单位时间内收集的病例, 经分组后部分组内样本例数有限, 如研究中口服和局部用药组病例数较少, 可能存在一定的统计偏倚, 未来我们将推进前瞻性对照研究以进一步明确美沙拉嗪在中国人群中的的最佳应用剂量与应用模式.
溃疡性结肠炎(ulcerative colitis, UC)是一种病因尚不明确的直肠和结肠慢性非特异性炎症性疾病, 且多青壮年期发病, 对患者的生活质量影响大, 因而也越来越被普通大众所关注和认识. 在我国UC的发病率呈现逐渐上升趋势, 主要的治疗药物包括柳氮磺胺吡啶(salazosulfapyridine, SASP)、5-氨基水杨酸(5-aminosalicylic acid, 5-ASA)、激素、免疫抑制剂和生物制剂等, 可由于药物不良反应和经济等因素的影响, 激素、免疫抑制剂和生物制剂等的广泛使用在一定程度上受限, 临床应用较为普遍和安全的是5-ASA和SASP制剂. 尤以美沙拉嗪(mesalazine)为主的5-ASA更为常用. 关于美沙拉嗪目前被广泛接受的观点认为, UC治疗模式的选择依赖于疾病的定位与个体病情严重程度. 当UC病变局限于左半结肠, 美国和欧洲的专业机构推荐首选该药局部治疗. 虽已有研究指出在UC的治疗中, 美沙拉嗪联合用药效果优于单独口服用药, 但联合与单一方式用药(含局部用药)长期疗效对比的报道仍相对较少; 同时由于东西方UC的流行病学、预后等存在差异, UC疾病表现个体差异也大, 国内该方面的研究确实急待完善与充实.
美沙拉嗪在治疗轻中度UC中的疗效已经得到充分的肯定, 但目前尚缺针对国人的标准化应用指导. 本研究分析了与该药疗效相关的多种影响因素, 以期能进一步深入了解提高美沙拉嗪应用效果的方法, 为其标准化治疗提供新的理论依据.
本文的研究目标就是为更好的应用美沙拉嗪治疗UC, 提供关键性的指导要点. UC就好发部位而言, 常见于直肠和左半结肠, 现行临床诊治原则的不足在于更多地强调口服药物治疗而没有充分地重视局部治疗. 本研究即通过比较不同给药方式下美沙拉嗪治疗轻中度UC的疗效, 并做长短期评估, 初步提示联合用药对UC维持缓解的具有重要作用, 要给予充分重视, 达到实验预设的目标. 同时, 因作者的观察对象以广东本地人群为主, 将为推进本区域标准化治疗方案的拟定提供更多依据.
本研究团队收集了一个固定时间段内(2012-07/2015-05)中山大学附属第六医院收治的所有335例轻中度UC患者信息, 为能明确分析美沙拉嗪给药方式与定期疗效间关系, 作者规定了严格的入组排除标准, 对收集到的不同类型数据资料采用不同的统计分析模型(详见正文方法学部分), 并对还在治疗中的患者进行了积极地动态随访, 在一定程度上拿到了更为精确的评估数据, 为对最终结果的准确解释及在本中心可能的推广应用创造了条件.
美沙拉嗪在对本地轻中度UC患者的治疗中同样有效. 即使发病部位差异性存在, 仍推荐联合用药, 从长期疗效来看, 将优于单一方式应用美沙拉嗪. 目前临床上应用美沙拉嗪主要以口服治疗为主, 病变部位低等特殊情况下才会考虑联用局部治疗, 疗效虽可见, 但因患者间差异大, 效果不稳定. 本研究就是针对这一现状, 力求探究保障患者获益的标准化治疗方法, 所获结论提示预设的试验目标是合理且有实现可能. 遵循这一思路, 后期作者将按计划推进前瞻性队列研究, 相信所获结果将有助于更深入了解提高美沙拉嗪治疗效果的方法, 为其在国内的标准化应用提供更全面的理论依据.
本研究有着回顾性研究不可回避的缺陷, 因试验的开始是在基本病历资料完成收集之后, 故数据的完整性和同质性常有欠缺; 依据分析因素分组后, 分组间的均衡性不受控, 有引入较大偏倚的可能. 因此本研究制定了严格的入组排除标准, 并配合进行了主动的电话等多种沟通方式的来完善核实随访信息的采集, 力求尽可能提高分析数据的质量. 在现有结论的基础上, 作者将计划推进前瞻性的药物治疗队列研究, 通过完善的方案设计、规范的信息管理, 以期获取更准确的疗效参数(如引入Mayo评分系统进行疗效的客观评价等). 相信未来将有机会为美沙拉嗪在国内标准化应用方案地拟定提供更有效的依据.
感谢胡品津教授全力推动炎症性肠病数据库建立, 感谢丁妮完善资料收集与质量控制流程, 感谢何欢、蒋晓东在打随访电话、登记资料过程中积极地参与, 所有前期的努力都为本研究的推进奠定了坚实的基础并创造了条件.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 广东省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑:马亚娟 电编:杜冉冉
| 1. | Kornbluth A, Sachar DB; Practice Parameters Committee of the American College of Gastroenterology. Ulcerative colitis practice guidelines in adults: American College Of Gastroenterology, Practice Parameters Committee. Am J Gastroenterol. 2010;105:501-523; quiz 524. [PubMed] [DOI] |
| 2. | Harbord M, Eliakim R, Bettenworth D, Karmiris K, Katsanos K, Kopylov U, Kucharzik T, Molnár T, Raine T, Sebastian S. Third European Evidence-based Consensus on Diagnosis and Management of Ulcerative Colitis. Part 2: Current Management. J Crohns Colitis. 2017;11:769-784. [PubMed] [DOI] |
| 3. | Marteau P, Probert CS, Lindgren S, Gassul M, Tan TG, Dignass A, Befrits R, Midhagen G, Rademaker J, Foldager M. Combined oral and enema treatment with Pentasa (mesalazine) is superior to oral therapy alone in patients with extensive mild/moderate active ulcerative colitis: a randomised, double blind, placebo controlled study. Gut. 2005;54:960-965. [PubMed] [DOI] |
| 4. | Ford AC, Khan KJ, Achkar JP, Moayyedi P. Efficacy of oral vs. topical, or combined oral and topical 5-aminosalicylates, in Ulcerative Colitis: systematic review and meta-analysis. Am J Gastroenterol. 2012;107:167-176; author reply 177. [PubMed] [DOI] |
| 5. | Probert CS, Dignass AU, Lindgren S, Oudkerk Pool M, Marteau P. Combined oral and rectal mesalazine for the treatment of mild-to-moderately active ulcerative colitis: rapid symptom resolution and improvements in quality of life. J Crohns Colitis. 2014;8:200-207. [PubMed] [DOI] |
| 8. | Zhao J, Ng SC, Lei Y, Yi F, Li J, Yu L, Zou K, Dan Z, Dai M, Ding Y. First prospective, population-based inflammatory bowel disease incidence study in mainland of China: the emergence of "western" disease. Inflamm Bowel Dis. 2013;19:1839-1845. [PubMed] [DOI] |
| 9. | Chow DK, Sung JJ, Tsoi KK, Wong VW, Wu JC, Leong RW, Chan FK. Predictors of corticosteroid-dependent and corticosteroid-refractory inflammatory bowel disease: analysis of a Chinese cohort study. Aliment Pharmacol Ther. 2009;29:843-854. [PubMed] [DOI] |
| 10. | Connolly MP, Nielsen SK, Currie CJ, Marteau P, Probert CS, Travis SP. An economic evaluation comparing concomitant oral and topical mesalazine versus oral mesalazine alone in mild-to-moderately active ulcerative colitis based on results from randomised controlled trial. J Crohns Colitis. 2009;3:168-174. [PubMed] [DOI] |
| 11. | Feagan BG, Macdonald JK. Oral 5-aminosalicylic acid for maintenance of remission in ulcerative colitis. Cochrane Database Syst Rev. 2012;10:CD000544. [PubMed] [DOI] |
| 12. | Feagan BG, Macdonald JK. Oral 5-aminosalicylic acid for induction of remission in ulcerative colitis. Cochrane Database Syst Rev. 2012;10:CD000543. [PubMed] [DOI] |
| 13. | Munkholm P, Michetti P, Probert CS, Elkjaer M, Marteau P. Best practice in the management of mild-to-moderately active ulcerative colitis and achieving maintenance of remission using mesalazine. Eur J Gastroenterol Hepatol. 2010;22:912-916. [PubMed] [DOI] |
| 14. | Gionchetti P, Rizzello F, Venturi A, Ferretti M, Brignola C, Miglioli M, Campieri M. Comparison of oral with rectal mesalazine in the treatment of ulcerative proctitis. Dis Colon Rectum. 1998;41:93-97. [PubMed] [DOI] |
| 15. | Kruis W, Jonaitis L, Pokrotnieks J, Mikhailova TL, Horynski M, Bátovský M, Lozynsky YS, Zakharash Y, Rácz I, Kull K. Randomised clinical trial: a comparative dose-finding study of three arms of dual release mesalazine for maintaining remission in ulcerative colitis. Aliment Pharmacol Ther. 2011;33:313-322. [PubMed] [DOI] |
| 16. | da Silva BC, Lyra AC, Rocha R, Santana GO. Epidemiology, demographic characteristics and prognostic predictors of ulcerative colitis. World J Gastroenterol. 2014;20:9458-9467. [PubMed] [DOI] |
| 17. | Lunney PC, Kariyawasam VC, Wang RR, Middleton KL, Huang T, Selinger CP, Andrews JM, Katelaris PH, Leong RW. Smoking prevalence and its influence on disease course and surgery in Crohn's disease and ulcerative colitis. Aliment Pharmacol Ther. 2015;42:61-70. [PubMed] [DOI] |
| 18. | Wang YF, Ou-Yang Q, Xia B, Liu LN, Gu F, Zhou KF, Mei Q, Shi RH, Ran ZH, Wang XD. Multicenter case-control study of the risk factors for ulcerative colitis in China. World J Gastroenterol. 2013;19:1827-1833. [PubMed] [DOI] |
| 19. | Ananthakrishnan AN. Epidemiology and risk factors for IBD. Nat Rev Gastroenterol Hepatol. 2015;12:205-217. [PubMed] [DOI] |